基于VDAC1/mPTP调节机制探讨葛根素抗心肌细胞缺氧/复氧损伤的保护作用
马 文,徐勇民,孟 艳,贺 敏,杨小梅,何 明,廖章萍
(1. 南昌大学药学院药理学教研室,江西 南昌 330006;2. 南昌市第三医院麻醉科,江西 南昌 330006;3. 南昌市第三医院护理部,江西 南昌 330006)
葛根是豆科多年生落叶藤本植物,其干燥根入药为葛根,是常用中药,始载于《神农本草经》。葛根素(puerarin,Pue)为其主要有效成分,属异黄酮类,分子式为C21H20O9,化学名为8-β-D-葡萄吡喃糖-4′,7-二羟基异黄酮[1]。研究表明,葛根素具有很多药理作用[2],包括良好的抗心律失常、抗心肌缺血作用、抗氧化作用、拮抗Ca2+超载、抑制细胞凋亡、降血糖和血脂、减轻炎症反应、改善心肌收缩、促进微循环等作用。
临床上,当心肌出现缺血缺氧时会造成一定的损伤,解决的办法就是尽快恢复血供,然而供血后非但不能减轻损伤,反而加重细胞功能代谢障碍和结构损伤的现象,即缺血/再灌注 (ischemia/reperfusion, I/R)损伤。近年来,研究发现[3],线粒体通透性转换孔道(mitochondria permeability transition pore, mPTP)与心肌I/R损伤密切相关。mPTP的开放,将引起I/R损伤从可逆向不可逆转变。因此,要实现有效的心肌保护作用,可通过降低mPTP的开放程度或增加mPTP的关闭来实现。mPTP由多种蛋白构成,是一种非选择性、高导电性的复合孔道,位于线粒体的内外膜之间,由位于外膜的电压依赖性阴离子通道(voltage-dependent anion channel, VDAC)、基质的亲环素D( cyclophilin D, CyP-D)和内膜的腺苷酸转运酶(adenylate transporter , ANT)等组成[4]。其中VDAC担任通道开关的角色,调节mPTP的开放和关闭,控制着离子和代谢物的转运,进而影响一些生理及病理过程[5]。VDAC有3个亚型,其中VDAC1在哺乳动物线粒体膜上分布最广、生理作用最关键。Wang等[6]研究发现,在肾小管上皮细胞,葛根素可有效抑制铅介导的mPTP开放及细胞凋亡。本实验室前期研究表明[7,9],葛根素可通过上调PKCε蛋白,对抗心肌细胞缺氧/复氧(anoxia/reoxygenation, A/R)损伤,且终浓度为320 μmol·L-1时细胞存活率最高。因此,在此基础上,我们推测葛根素可能通过影响mPTP开放,从而对抗I/R损伤,发挥心肌保护作用。本研究拟在心肌细胞建立A/R损伤模型,研究葛根素的心肌保护作用及其与VDAC1/mPTP线粒体通路的关系,阐明葛根素对抗心肌I/R损伤的分子生物学机制,为其临床应用提供理论依据。
1 材料与方法
1.1材料
1.1.1细胞株 大鼠H9c2心肌细胞株,购自中国科学院细胞库。
1.1.2药品与试剂 葛根素购自中国药品生物制品检定所;特级胎牛血清(fetal bovine serum, FBS)购自WISENT公司;高糖(dulbecco’s modified of eagle’s medium, DMEM)培养基购自Solarbio公司;TransZol购自北京全式金生物技术有限公司;逆转录试剂盒购自TaKaRa公司;Real-time PCR试剂盒购自德国QIAGEN生物公司;Anti-VDAC1(ab15895)和Anti-beita Actin(ab6276)购自Abcam公司;二抗辣根酶标记山羊抗兔IgG(H+L) (Peroxidase-Conjugated Goat anti-Rabbit IgG(H+L) , ZB-2301),辣根酶标记山羊抗小鼠IgG(H+L) (Peroxidase-Conjugated Goat anti-Mouse IgG(H+L), ZB-2305)购自北京中杉金桥生物技术有限公司;Lipofectamine 2000TM脂质体购自Invitrogen公司;线粒体提取试剂盒、Annexin V-FITC/PI双染细胞凋亡检测试剂盒,购自江苏凯基生物科技公司;乳酸脱氢酶(lactate dehydrogenase, LDH)、肌酸激酶(creatine kinase, CK)试剂盒均购自南京建成生物工程研究所;其余化学试剂均为国产分析纯。
1.1.3仪器 FormaTM310 直热式 CO2培养箱、全波长酶标仪、三气培养箱(美国Thermo公司);SW-CJ-2FD型超净化工作台(苏州净化设备);倒置显微镜(日本Olympus);Bio-Rad CFX96实时荧光定量PCR仪(美国Bio-Rad公司);流式细胞仪(美国Beckman公司);5804-R低温高速离心机(德国Eppendorf); DYY-Ⅱ型稳压电源(北京六一仪器厂)。
1.2H9c2心肌细胞的培养H9c2心肌细胞接种于无菌的细胞培养板,含10% FBS的高糖培养基提供营养,置于含5% CO2,37℃恒温、湿度饱和的清洁无菌孵箱中培养。
1.3H9c2心肌细胞A/R模型的建立心肌细胞生长至接近融合状态时,弃培养基,换用模拟缺氧缺糖溶液(pH=6.8,NaH2PO40.9 mmol·L-1、KCl 10.0 mmol·L-1、Hepes 20.0 mmol·L-1、NaHCO36.0 mmol·L-1、MgSO4·7H2O 1.2 mmol·L-1、乳酸钠40.0 mmol·L-1、CaCl21.0 mmol·L-1、NaCl 98.5 mmol·L-1),置于密闭性良好的A/R装置(37℃)中缺氧孵育3 h后,再换用模拟再灌注溶液(pH=7.4,NaH2PO40.9 mmol·L-1、KCl 5.0 mmol·L-1、NaHCO320.0 mmol·L-1、CaCl21.0 mmol·L-1、Hepes 20.0 mmol·L-1、MgSO4·7H2O 1.2 mmol·L-1、Glu·H2O 1.2 mmol·L-1、NaCl 129.5 mmol·L-1),复氧孵育2 h[9],并通过检测LDH和CK来确定模型的构建是否成功。
1.4VDAC1真核表达载体pFLAG-VDAC1在H9c2心肌细胞中的表达参照本实验室已建立方法,构建pFLAG-VDAC1质粒[9],构建完成后,以空载质粒pFLAG为对照,进行重组质粒表达效率的检测,随后扩增、提取、纯化、转染至H9c2心肌细胞中。转染之前,弃去培养基,用不含血清的培养基漂洗细胞2次,换上新鲜的无抗生素、无血清的培养基,将质粒用Lipofectamine 2000TM脂质体转染至心肌细胞中,放入孵箱中继续培养。48 h后,裂解细胞,提取RNA和蛋白,利用Real-time PCR和Western blot分别检测VDAC1 mRNA和蛋白的表达水平。
1.5实验分组实验共分4组:① Control组,正常培养不做处理;② A/R组,弃去培养基换用缺氧缺糖溶液,置于密闭装置中,通入含95% N2、5% CO2的混合气体缺氧孵育3 h;然后弃缺氧缺糖溶液,换用再灌注溶液,通入含95% O2、5% CO2的混合气体复氧孵育2 h;③ 葛根素组,加葛根素320 μmol·L-1孵育[9],24 h后处理同A/R组;④ pFLAG-VDAC1-葛根素组,将重组质粒pFLAG-VDAC1转染至H9c2细胞中,24 h后处理同葛根素组。每组重复5次。
1.6生化指标检测建模结束后,收集各组复氧液500 μL,根据试剂盒说明书检测LDH、CK活性。
1.7VDAC1真核表达载体pFLAG-VDAC1转染效率的检测以空载质粒载体pFLAG为对照,将重组质粒 pFLAG-VDAC1 转染至H9c2细胞48 h后,裂解细胞,提取蛋白,Western blot检测VDAC1蛋白表达。
1.8RNA提取和实时定量PCR(Real-timePCR)检测[8]采用TransZol试剂盒,提取各实验组细胞总RNA,使用逆转录酶合成cDNA,逆转成2 μg体系。实时荧光定量PCR仪进行扩增,使用Real-time PCR试剂盒按下列循环条件进行40个循环:95℃,2 min;95℃,5 s;60℃,10 s。VDAC1引物:上游5′-GACTGCTGTCAATCTCGCCT-3′,下游5′-GGAGTTGTTCACTTTGGCCG-3′;β-actin引物:上游5′-ATGACGATATCGCTGCGCTC-3′,下游5′-CAGTTGGTGACAATGCCGTG-3′。
1.9Westernblot检测H9c2心肌细胞VDAC1蛋白造模结束后,提取各组H9c2细胞总蛋白,取适量的蛋白提取液,利用BCA法进行浓度测定,定量上样蛋白总量,聚丙烯酰胺凝胶电泳(SDS-PAGE,12%分离胶),电泳结束后湿转至PVDF膜,5%脱脂奶粉室温摇床封闭2 h,4℃过夜孵育VDAC1、β-actin的一抗。洗膜液洗去未结合的一抗,后用辣根过氧化物酶标记的二抗室温摇床孵育2 h,ECL化学发光法检测。以β-actin为内参,标化相应组VDAC1的蛋白条带密度。
1.10mPTP开放检测采用线粒体提取试剂盒,提取各组H9c2心肌细胞线粒体,通过线粒体肿胀实验检测mPTP的开放[10]。使用CaCl2诱导剂后,mPTP开放程度增加,则线粒体通透性逐渐增大,最终导致线粒体肿胀甚至破裂,此时吸光度明显下降。在520nm波长处,测各组吸光度初值(OD1),记录此时数值,随后各实验组加200 μmol·L-1CaCl2诱导剂,每分钟检测1次吸光度,直到约20 min后吸光度不再变化,记录此时吸光度值(OD2),△OD=OD1-OD2。用△OD/min×1 000表示mPTP开放程度,此数值越大,表示mPTP开放程度越大。
1.11AnnexinV-FITC和PI双染色法检测H9c2心肌细胞凋亡Annexin V是分子量约为36 ku的Ca2+依赖性磷脂结合蛋白,当细胞受损发生早期凋亡时,磷脂酰丝氨酸由膜内移到膜外,Annexin V则可与之结合。碘化丙啶(propidium iodide, PI)是一种DNA荧光染料,不能透过细胞膜,当细胞受损或坏死时细胞膜被破坏,PI透入胞核并嵌入双链DNA中发出红色荧光。将Annexin V用荧光素FITC标记,发出绿色荧光,以标记的Annexin V作为荧光探针。因此,常用Annexin V-FITC和PI双染色法区分不同凋亡时期的细胞。正常细胞:Annexin V(-),PI(-);凋亡中、晚期或坏死细胞:Annexin V(+),PI(+);早期凋亡细胞:Annexin V(+),PI(-)。各组细胞用冷的1×PBS清洗2次,吸尽1×PBS,加入适量不含EDTA的胰酶消化细胞,用无血清培养基终止消化,离心收集细胞;再用冷的1×PBS洗涤细胞2次,加入500 μL 1×Annexin V结合液悬浮细胞,另加入5 μL Annexin V-FITC染色液,混匀后避光孵育15 min;最后加入5 μL PI染色液,混匀后避光孵育10 min,立即用流式细胞仪检测。

2 结果
2.1葛根素对A/R损伤后LDH、CK活性的影响当心肌细胞损伤时,LDH和CK由胞内释放到胞外。如Fig 1所示,与Control组相比,H9c2心肌细胞经A/R处理后,LDH、CK活性均明显提高(P<0.05),说明A/R模型构建成功;葛根素预处理组LDH、CK活性降低,但转染pFLAG-VDAC1重组质粒后,则可取消葛根素的保护作用。
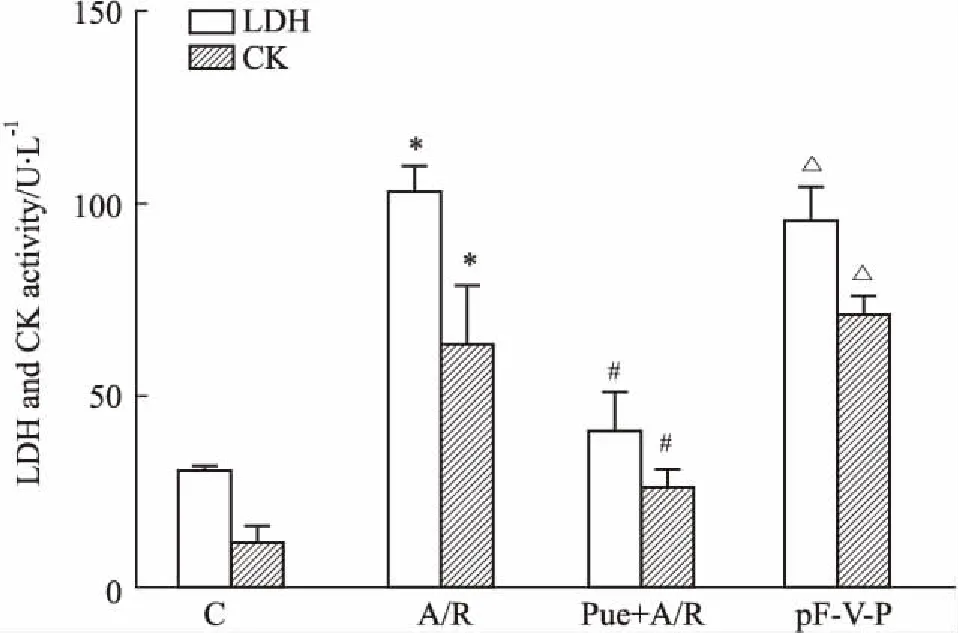
Fig 1 Effect of puerarin treatment on LDH and CK activity in H9c2 subjected to A/R n=5)
C: Control group; A/R: A/R group; Pue+A/R: Pue+A/R group; pF-V-P: pFLAG-VDAC1-Pue group.*P<0.05vscontrol group;#P<0.05vsA/R group;△P<0.05vsPue+A/R group.
2.2重组质粒pFLAG-VDAC1表达效率的检测如Fig 2所示,空载质粒pFLAG组VDAC1蛋白水平与Control组相比,无明显改变,而pFLAG-VDAC1组VDAC1蛋白水平明显提高,说明重组质粒转染成功,并有效表达。

Fig 2 Western blot analysis of VDAC1 in H9c2 cells transfected with VDAC1 recombinant vector n=5)
C: Control group; pF: pFLAG group; pF-V: pFLAG-VDAC1 group.*P<0.05vscontrol group;#P<0.05vspF group.
2.3葛根素对VDAC1mRNA表达的影响由Fig 3可知,与Control组相比,A/R组VDAC1 mRNA水平明显上调;葛根素预处理24 h可明显抑制VDAC1 mRNA的上调。

Fig 3 Real-time PCR analysis of VDAC1 mRNA expression in H9c2 subjected to A/R n=5)
C: Control group; A/R: A/R group; Pue+A/R: Pue+A/R group; pF-V-P: pFLAG-VDAC1-Pue group.▲P<0.05vscontrol group;*P<0.05vsA/R group;#P<0.05vsPue+A/R.
2.4葛根素对心肌细胞VDAC1蛋白表达的影响Fig 4的Western blot结果显示,A/R组VDAC1表达明显上调;葛根素预处理组的VDAC1表达水平较A/R组明显下调(P<0.05)。

Fig 4 Effect of puerarin treatment on the expression of VDAC1 in H9c2 cells exposed to A/R n=5)
C: Control group; A/R: A/R group; Pue+A/R: Pue+A/R group; pF-V-P: pFLAG-VDAC1-Pue group.*P<0.05vscontrol group;#P<0.05vsA/R group;△P<0.05vsPue+A/R group.
2.5葛根素对mPTP开放的影响当mPTP开放时,线粒体通透性增高,用200 μmol·L-1CaCl2处理后,则进入线粒体而导致线粒体肿胀。如Fig 5所示,A/R组A520急剧下降,但葛根素预处理组则缓慢下降,△OD/min值较A/R组明显减小(P<0.05),说明mPTP开放受到抑制。而在pFLAG-VDAC1-葛根素组,线粒体A520变化与A/R组差异无统计学意义。
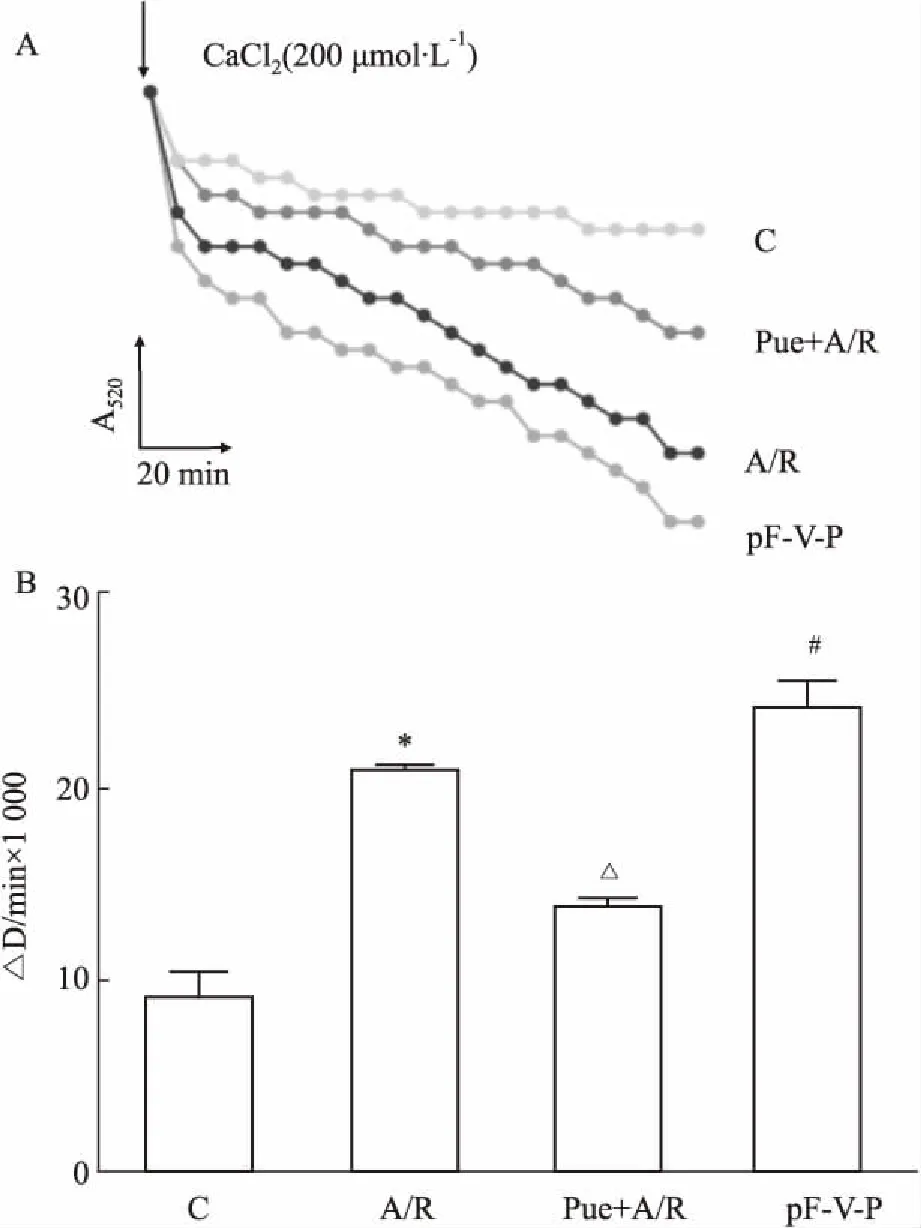
Fig 5 Effect of puerarin treatment on mPTP opening in H9c2 subjected to A/R n=5)
A: Original traces were shown for Ca2+-dependent mitochondrial swelling, monitored by the decrease in absorbance at 520 nm; B: Rate of mitochondrial swelling induced by 200 μmol·L-1CaCl2. Data were shown as a change of A520(△D/min).*P<0.05vscontrol group;#P<0.05vsPue+A/R group;△P<0.05vsA/R group.
2.6葛根素对A/R损伤后心肌细胞凋亡的影响如Fig 6所示,H9c2心肌细胞经A/R处理后,与Control组比较,细胞凋亡数明显增加(P<0.05);葛根素预处理组细胞凋亡数明显减少(P<0.05);pFLAG-VDAC1-葛根素组细胞凋亡数增高,说明上调VDAC1表达可取消葛根素的保护作用。
3 讨论
葛根素抗A/R损伤的作用已有研究[11-12],其可通过调节PKCε蛋白、Bcl-2、Bax蛋白的表达发挥抗损伤作用。本文首次研究VDAC1与葛根素抗A/R损伤作用之间的关系,及其可能的分子机制。

Fig 6 Puerarin preconditioning could inhibited the apoptosis of cardiomyocytes suffered n=5)
A: Representative flow cytometric dot plots (x-axis: Annexin V staining, y-axis: PI staining); B: Quantification of apoptotic cells population.*P<0.05vscontrol group;△P<0.05vsA/R group;#P<0.05vsPue+A/R group.
mPTP是位于线粒体跨膜的非特异性孔道,正常情况处于关闭状态,是维持线粒体结构完整,实现其生理功能的必要条件。缺血期,Na+/K+-ATP酶失效,钠钙离子交换受阻,使得钙离子超载,线粒体氧化磷酸化抑制,ATP合成减少,乳酸堆积,导致细胞内的pH降低,mPTP处于关闭状态;再灌注期,恢复有氧呼吸,ATP合成增加,钙超载加重,活性氧大爆发,导致线粒体上mPTP不可逆开放[13]。mPTP开放将引起线粒体膜电位降低,直至崩溃,又由于基质肿胀和内膜伸展,随后引起外膜破裂,促凋亡因子由线粒体释放到胞质,激活下游凋亡蛋白,最终诱导细胞凋亡或坏死。因此,抑制mPTP的开放,可有效地抑制细胞凋亡或坏死,从而发挥抗损伤作用。本研究发现,A/R损伤后,mPTP开放,细胞凋亡明显增加;葛根素预处理后mPTP开放得到抑制,细胞凋亡减少,VDAC1高表达组则可取消葛根素抑制mPTP开放的作用,可认为葛根素通过抑制或者部分抑制mPTP开放来减少细胞凋亡。
VDAC1参与调控线粒体外膜通透性,控制离子和代谢物进出细胞,影响细胞凋亡;同时VDAC1也是Bcl-2家族的重要结合位点,它可与Bax/Bak相互作用形成孔径增大的孔道,使线粒体内的凋亡相关蛋白如细胞色素C等进入胞质,激活caspase-3,启动细胞凋亡的程序[15]。当细胞中VDAC1蛋白过表达时,会导致VDAC1由单体状态向多聚体状态发生转变,释放促凋亡蛋白到胞质,诱导细胞凋亡[14-15]。本研究结果表明,H9c2心肌细胞经A/R损伤后,VDAC1基因和蛋白水平均明显上调,细胞凋亡水平较高;葛根素预处理则可下调VDAC1的表达,细胞凋亡水平较低;而导入pFLAG-VDAC1质粒,上调VDAC1表达后,细胞凋亡水平较高,则说明取消了葛根素的保护作用,葛根素可能通过影响VDAC1的表达发挥抗A/R损伤的作用。
综上所述,我们推断,葛根素抗A/R损伤作用与VDAC1/mPTP机制密切相关。其通过下调VDAC1的表达,防止mPTP的过度开放,从而发挥保护作用。葛根素作为心血管保护药物,其可能涉及的分子机制还有待于进一步研究。
(致谢:本实验研究主要在南昌大学医学部江西省药理学重点实验室完成,感谢实验室人员的指导和帮助!)
[1] 曾祥伟, 冯 倩, 张莹莹, 等. 葛根素对炎症相关疾病研究进展[J]. 中国药理学通报, 2018,34(1): 8-11.
[1] Zeng X W, Feng Q, Zhang Y Y, et al. Progress in the study of Puerarin in the treatment of inflammatory diseases[J].ChinPharmacolBull, 2018,34(1): 8-11.
[2] 房 伟. 葛根药理作用研究进展[J]. 中国药物经济学, 2017,12(11): 159-60.
[2] Fang W. Research progress of pharmacological effects of puerarin[J].ChinaJPharmEconomics, 2017,12(11): 159-60.
[3] 向仕钊, 张 萌, 江 波. 线粒体膜通透性转换孔对缺血/再灌注损伤心肌细胞的影响[J]. 中国分子心脏病学杂志, 2016,16(6): 1940-4.
[3] Xiang S Z, Zhang M, Jiang B. The affection from mitochondrial permeability transition pore on cardiomyocytes induced-by ischemia [J].MolCardiolChina, 2016,16(6): 1940-4.
[4] Rottenberg H, Hoek J B. The path from mitochondrial ROS to aging runs through the mitochondrial permeability transition pore[J].AgingCell, 2017,16(5): 943-55.
[5] Shoshan-Barmatz V, Krelin Y, Shteinfer-Kuzmine A. VDAC1 functions in Ca2+homeostasis and cell life and death in health and disease[J].CellCalcium, 2018,69: 81-100.doi:10.1016/j.cela.2017.06.007.
[6] Wang Z K, Zhou X L, Song X B, et al. Alleviation of lead-induced apoptosis by puerarin via inhibiting mitochondrial permeability transition pore opening in primary cultures of rat proximal tubular cells[J].BiolTraceElemRes, 2016,174(1): 166-76.
[7] 汤 蕾, 胥甜甜, 易小清, 等. PKCε信号通路介导的葛根素抗心肌细胞缺氧/复氧损伤作用[J]. 中国药理学通报, 2014,30(1): 77-81.
[7] Tang L, Xu T T, Yi X Q, et al. Role of PKCε signal pathway in puerarin preconditioning against cardiomyocytes anoxia/reoxygenatio[J].ChinPharmacolBull, 2014,30(1): 77-81.
[8] 曾祥伟, 冯 倩, 张莹莹, 等. 葛根素对MC3T3-E1 细胞增殖、分化和矿化及TRPM3 mRNA表达的影响[J]. 中国药理学通报, 2017,33(7): 977-82.
[8] Zeng X W, Feng Q, Zhang Y Y, et al. Effects of puerarin on proliferation, differentiation and mineralization of MC3T3-E1 cells and expression of TRPM3 mRNA[J].ChinPharmacolBull, 2017,33(7): 977-82.
[9] Tang L, Liu D, Yi X, et al. The protective effects of puerarin in cardiomyocytes from anoxia/reoxygenation injury are mediated by PKCε[J].CellBiochemFunct, 2014,32(4): 378-86.
[10] 廖章萍, 章志玲, 邹逢琳, 等. 白藜芦醇对抗线粒体电压依赖性阴离子通道介导心肌损伤作用的研究[J]. 中国药理学通报, 2011,27(4): 477-81.
[10] Liao Z P, Zhang Z L, Zou F L, et al. Effects of resveratrol on myocardial injury induced by mitochondrial voltage-dependent anion channels[J].ChinPharmacolBull, 2011,27(4): 477-81.
[11] Wang W, Zhang T, Zhao W, et al. A single talent immunogenic membrane antigen and novel prognostic predictor: voltagedependent anion channel1 (VDAC1) in pancreatic cancer[J].SciRep, 2016,6: 33648.doi:10.1038/srep33648.
[12] 李 军, 石 博, 黄可欣, 等. 葛根素对心肌缺血/再灌注大鼠心肌组织Bcl-2、Bax和Caspase-3表达水平的影响[J]. 中国实验诊断学, 2013,17(4): 631-3.
[12] Li J, Shi B, Huang K X, et al. Effect of puerarin on myocardio ischemia and reperfusion in rat cardiac tissue Bcl-2, Bax and Caspase-3 expression levels[J].ChinJLabDiagn, 2013,17(4): 631-3.
[13] 王 超, 刘 昭, 张佳丽, 等. 防治心肌缺血/再灌注损伤心肌mPTP开放情况的研究进展[J]. 辽宁中医杂志, 2013,40(12): 2615-7.
[13] Wang C, Liu Z, Zhang J L, et al. Progress of studies on prevention of myocardial ischemia/reperfusion injury in myocardial mptp open[J].LiaoningJTraditChinMed, 2013,40(12): 2615-7.
[14] Shoshan-Barmatz V, Krelin Y, Chen Q. VDAC1 as a player in mitochondria-mediated apoptosis and target for modulating apoptosis[J].CurrMedChem, 2017,24(40): 4435- 46.
[15] Tong Z, Xie Y, He M, et al. VDAC1 deacetylation is involved in the protective effects of resveratrol against mitochondrial-mediated apoptosis in cardiomyocytes subjected to anoxia/reoxygenation injury[J].BiomedPharmacother, 2017 ,95: 77-83.doi:10.1016/j.biopha.2017.08.046.

