蓝舌病1型病毒灭活疫苗绵羊免疫试验
廖德芳,苗海生,李 乐,寇美玲,高 林,李华春
(云南省畜牧兽医科学院,云南省热带亚热带动物病毒病重点实验室,云南昆明 650224)
蓝舌病(Bluetongue,BT)是由呼肠孤病毒科环状病毒属的蓝舌病病毒(Bluetongue virus,BTV)引起的,主要感染绵羊、牛和其他家养及野生反刍动物的一种非接触性虫媒病毒病。BTV广泛分布于热带、亚热带地区,至少有27种血清型,且型间无交叉保护。世界动物卫生组织(OIE)将BT列为须通报动物疫病[1-4]。在欧洲,BT已成为继口蹄疫后最受关注的重要动物疫病之一。2005年至今,BT在欧洲及南亚地区大规模流行,疫情范围波及比利时、荷兰、德国、法国、卢森堡、英国、葡萄牙、希腊、奥地利和印度[5-6],给这些国家带来巨大经济损失。我国于1979年首次报道了BT疫情。2008年流行病学调查发现,我国31个省份存在BTV血清抗体阳性家畜,云南、湖北、重庆、山西、新疆、内蒙古、广西等地在自然感染羊中分离到了BTV[7]。
疫苗免疫接种是预防和控制BT的重要手段。BTV弱毒疫苗是最早使用的疫苗,但由于在减弱制备过程中存在毒力返强风险,目前除南非外,其它地区已不再使用[8]。灭活疫苗是目前预防和控制BT的主要手段。2008年前后,欧洲国家在大范围暴发BT疫情时,广泛使用了灭活疫苗,使疫情得到了有效控制[9]。由于BTV有多个血清型,且型间不能交叉保护,本研究选择致病性强的BTV-1型V863毒株制备灭活抗原,开展灭活疫苗免疫试验和攻毒保护试验,以评价疫苗免疫效果。
1 材料与方法
1.1 疫苗毒株复壮与扩增
疫苗毒株采用BTV-1型V863毒株,由云南省畜牧兽医科学院保存。将毒株用单层生长至90%并且状态良好的BHK-21细胞进行复壮,用PBS清洗细胞1次,然后接种病毒,培养72~96 h;与对照相比,病变达80%时即可收获;病毒滴度达到106TCID50/mL以上时,进行大量扩增。
1.2 病毒灭活、定量及疫苗制备
1.2.1 病毒灭活 每1 000 mL病毒悬液中加入
0.1 mol/L的BEI灭活剂3 mL,置37 ℃搅拌灭活;灭活20 h后换瓶,30 h后加入3 mL 1 mol/L的硫代硫酸钠终止反应,置4 ℃保存;取10 mL灭活病毒液,加入到长满BHK-21细胞的800 mL培养方瓶内,另加入50 mL培养液,置37 ℃温箱,每日观察至第5日;对未发生病变的细胞,反复冻融3次后继续传代观察,如第3代仍未出现病变,则视为灭活彻底。
1.2.2 抗原定量 采用蔗糖密度梯度离心法纯化BTV毒株,获得标准抗原;利用BCA蛋白定量方法定量标准抗原。倍比稀释标准抗原后,利用ACELISA同时检测标准抗原和病毒灭活液,获得标准抗原含量变化曲线;将病毒灭活液与该曲线对比,获得病毒灭活液抗原含量。
1.2.3 抗原浓缩及乳化 每1 000 mL病毒液内加入70 g PEG6000和22.2 g氯化钠,4 ℃搅拌过夜,充分溶解;置Backman J2-M1转头离心瓶内,4 000 r/min离心60 min;每1 000 mL抗原液用10 mL MEM维持液重悬沉淀;将浓缩抗原,用MEM维持液分别稀释为1、5、10、50和100 μg抗原含量;对1、5、10、50、100 μg/mL抗原含量的病毒液分别进行乳化,最后加入2 mL Tween-80及1 mL 1%的硫柳汞,完成100 mL疫苗制备。
1.3 动物免疫、攻毒和样品采集
1.3.1 试验动物及分组 36只成年考摩型绵羊购自云南省种羊场。利用BTV cELISA方法、微量细胞中和试验确定试验羊为BTV抗体阴性羊。随机分为6组,每组6只。其中:1组为空白对照组,免疫乳化后的BHK-21细胞液;其他5个试验组分别免疫抗原含量为 1、5、10、50、100 μg/只份的疫苗。
1.3.2 免疫及样品采集 疫苗免疫:待试验绵羊适应新饲养环境后,采用皮下注射,进行第1次免疫。试验组每只免疫2 mL疫苗,空白对照组免疫乳化后的BHK-21细胞液。首次免疫后第3周进行第2次免疫,方法及用量同上。样品采集:疫苗免疫0、1、2、3、4、5周后,分别用普通采血管和肝素钠抗凝采血管,各采集血样5~8 mL。
1.3.3 攻毒试验及样品采集 首次免疫后5周,用同型BTV攻毒,每只绵羊皮下接种血毒1 mL。采用滴度为104.25CEID50的BTV-1肝素抗凝血(云南省热带亚热带动物病毒病重点实验室保存)攻毒,并分别于0、2、4、6、8、10、12、14 d采集EDTA抗凝血,进行qRT-PCR检测。
1.4 微量血清中和试验
微量细胞中和试验方法,按世界动物卫生组织(OIE)标准操作指南进行。首先将血清于56 ℃水浴灭活30 min;在微量细胞培养板各孔内,加入50 μL维持液,第1排再加25 μL维持液;将待检血清加入第1排孔中,每孔25 μL,即第1排孔血清为1/4倍稀释;混匀后,用移液器从第1排孔内吸取50 μL移入第2排孔混匀,则第2排孔内血清为1/8稀释,依次稀释,则第8排孔内血清为1/512倍稀释。将病毒稀释成100 TCID50(50 μL),每孔加 50 μL 病毒稀释液,并 设 立 100 TCID50、10 TCID50、1 TCID50的病毒和空白对照。将细胞培养板放入37 ℃ 5%CO2养箱中反应1 h;最后每孔加100 μL BKH-21细胞悬液,置37 ℃ CO2培养箱中(CO2浓度为5%)培养48 h。当对照成立时,进行试验结果判定:被检血清孔出现100%的细胞病变(CPE)时,判为阴性;50%以上出现保护,则为阳性。用Karber法计算血清中和抗体滴度。
1.5 qRT-PCR检测
qRT-PCR检测在ABI FAST 7500上进行。采用一步法RT-PCR TAKARA RR064A试剂盒(大连宝生物),按照试剂盒说明书配制反应液。采用20 μL体系,每个反应加模版2 μL、引物0.4 μL、探针0.4 μL。反应条件为:42 ℃反转录5 min,95 ℃反应10 s,45个循环扩增反应包括95 ℃ 5 s,60 ℃延伸34 s。引物和探针按SWISS ASSAY方法进行[10]。引物和探针如下:
BTVF-MH:5'-TGGAAAAGCGATGTCAAA-3'
BTVR-MH:5'-ACATCATCACGAAACGCTTC-3'
BTVP-MH:
5'- FAM-ARGCTGCATTCGCATCGTACGC-BHQ1-3'
2 结果
2.1 抗原定量
经抗原定量检测,确定本批次抗原浓度为6.25 μg/mL。应用PEG 6000浓缩后,分别制备1、5、10、50、100 μg/只份的5组灭活疫苗。
2.2 微量血清中和试验
应用微量血清中和试验,对免疫后绵羊血清进行BTV-1型中和抗体滴度检测。检测结果显示(表1):第1组(1 μg/只份)首次免疫后阳性率为33.3%,第2次免疫后阳性率为66.7%;第2组(5 μg/只份)首次免疫后阳性率为66.7%,第2次免疫后阳性率为100%;第3组(10 μg/只份)首次免疫后阳性率为83.3%,第2次免疫后阳性率为83.3%;第4组(50 μg/只份)首次免疫后阳性率为66.7%,第2次免疫后阳性率为66.7%;第5组(100 μg/只份)首次免疫后阳性率为33.3%,第2次免疫后阳性率为50.0%。其中,最高抗体滴度是第5组的13152号绵羊,抗体滴度达362。
2.3 qRT-PCR 检测
攻毒后第1~5免疫组的核酸阴性率分别为66.7%、83.3%、83.3%、50.0%、66.7%,总核酸阴性率为70.0%,对照组核酸阴性率为0。其中,5、10 μg/只份组的BTV核酸阴性率均为83.3%,保护效果最好(表2)。
2.4 中和抗体滴度与攻毒后病毒检出率比较
以第5周攻毒时的中和抗体滴度为基准进行对比。结果显示:免疫绵羊中,当中和抗体滴度<11时,攻毒后病毒阳性率为62.5%;当中和抗体滴度≥64时,攻毒后病毒阳性率为0,即实现了完全保护;介于二者之间时,病毒阳性率为20.0%~25.0%(表3)。
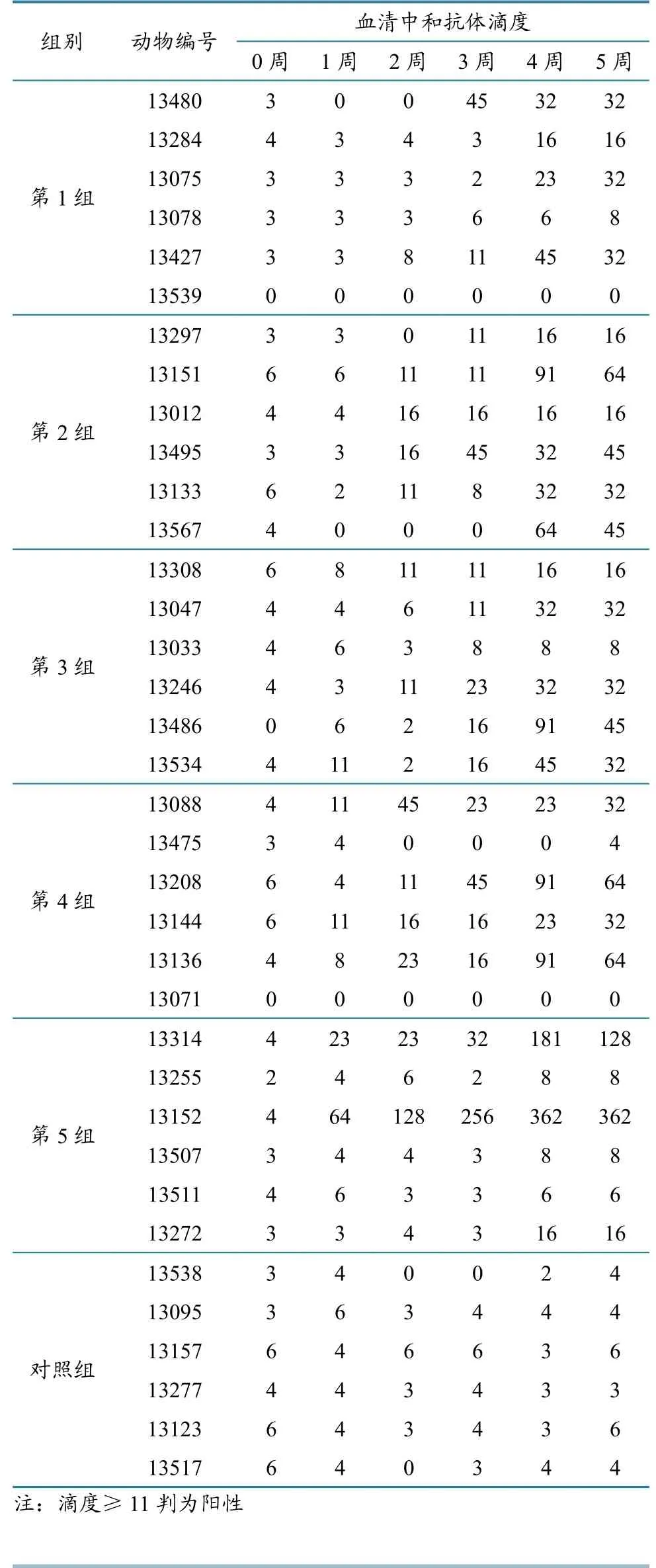
表1 BTV中和抗体滴度检测结果

表3 中和抗体滴度与攻毒后病毒检出率比较
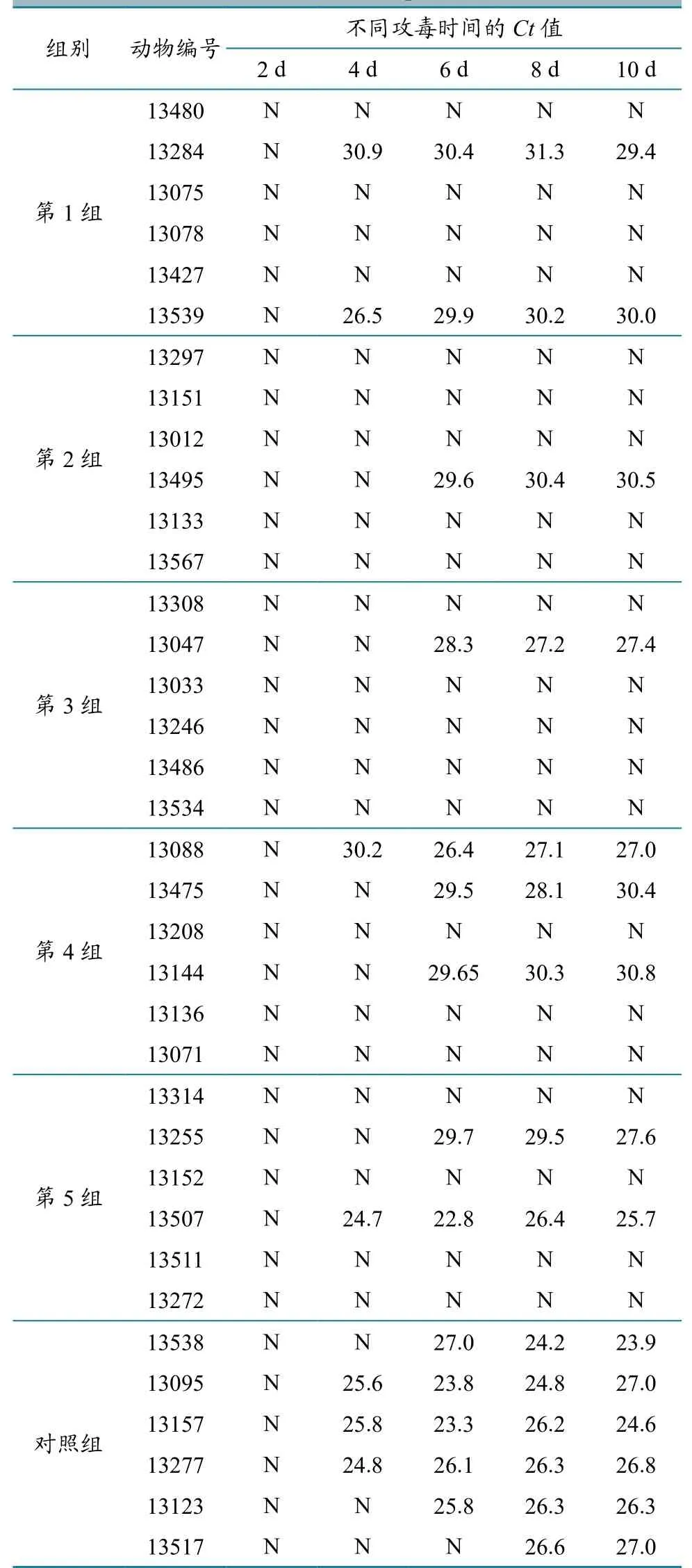
表2 疫苗免疫试验攻毒后qRT-PCR检测结果
3 讨论与结论
目前国际上预防和控制BT的主要手段是对易感动物接种BTV灭活疫苗。我国目前对该病的重视程度远远不够,相关预防技术储备缺失,一旦疫情暴发,将难以控制。
本研究采用BTV-1型 V863毒株制备的BTV-1型灭活油佐剂疫苗,能够刺激绵羊机体产生BTV-1型中和抗体;应用微量血清中和试验,对免疫后绵羊血清进行中和抗体检测,发现接种1、5、10、50、100 μg/只份 BT灭活疫苗的绵羊,经2次免疫后抗体阳性率分别为66.7%、100%、83.3%、66.7%、50.0%。其中,5 μg/只份组的BTV-1型中和抗体均呈阳性(滴度≥11判为阳性),100 μg/只份组内最高血清中和抗体滴度高达362,免疫效果理想,达到应用要求。由于国内流行的BTV毒株一般不会导致动物出现显著临床症状,因此在攻毒试验环节,除通过观察绵羊是否出现临床症状外,主要依据BTV在绵羊血液中能否扩增来衡量疫苗保护效果[10]。中和抗体滴度与攻毒后病毒检出率比较结果表明,只有中和抗体滴度≥64时,才可实现完全保护,因此在生产实践中要保证免疫动物处于较高的免疫保护水平。qRT-PCR检测结果表明,第1~5组绵羊攻毒后的病毒阴性率分别为66.7%、83.3%、83.3%、50.0%、66.7%,即相应比率绵羊获得了保护,其中5 μg/只份组和10 μg/只份组BTV核酸阴性率均为83.3%,保护效果较好。
本试验使用绵羊数量偏少,绵羊个体差异可能会影响疫苗免疫效果,造成高抗原含量疫苗组反而比低抗原含量疫苗组免疫效果差,但不影响10 μg/只份的BTV灭活抗原含量可作为BTV灭活疫苗生产的推荐用量,这在BTV疫苗生产中具有一定的指导意义。同时试验表明,BTV中和抗体滴度≥64时可以实现完全保护,可以此作为今后高效BTV灭活疫苗研究的依据。
[1] MACLACHLAN N J,DREW C PDARPEL K E,et al.The pathology and pathogenesis of Bluetongue[J]. Journal of comparative pathology,2009,141(1):1-16.
[2] PETER M,MATTHEW B,PHILIP A. Bluetongue[M].London:Academic Press,2008.
[3] BHANUPRAKASH V,INDRANI B K,HOSAMANI M,et al. Bluetongue vaccines:the past,present and future[J]. Expert review of vaccines,2009,8(2):191-204.
[4] DAVIES F,MUNGAI J,PINI A,et al. A new bluetongue virus serotype isolated in Kenya [J]. Veterinary microbiology,1992,31(1):25-32.
[5] FRANCO O L,OGAS M L,COMBESSIES G,et al.Single dilution Avidity-Blocking ELISA as an alternative to the Bovine viral diarrhea virus neutralization test[J].Journal of virological methods,2011,175(2):228-235.
[6] AL M Z,BRUYAS J F,PELLERIN J L,et al.Evaluation of bluetongue virus(BTV)decontamination techniques for caprine embryos produced in vivo [J].Theriogenology,2012,78(6):1286-1293.
[7] 朱建波,杨仕标,李华春,等. 谨防以羊、牛为侵害对象的“杀手”--蓝舌病流行病学及防控技术研究进展[J].中国动物卫生保健,2008,107(1):105-108.
[8] ESCHBAUMER M,HOFFMANN B,KONIG P,et al.Ef fi cacy of three inactivated vaccines against bluetongue virus serotype 8 in Sheep[J]. Vaccine,2009,27(31):4169-4175.
[9] HOFMANN M,GRIOT C,CHAIGNAT V,et al.Bluetongue disease reaches Switzerland [J]. Schweiz arch tierheilkd,2008,150(2):49-56.
[10] RAMAKRISHNAN M A,PANDEY A B,SINGH K P,et al. Immune responses and protective efficacy of binary ethylenimine(BEI)-inactivated bluetongue virus vaccines in sheep[J]. Veterinary research communication,2006,30(8):873-880.

