浙江省一规模猪场副猪嗜血杆菌的分离鉴定
周 蕾,虞一聪,董建斐,柴 娟,王雅婷,刘爱军,谢荣辉,倪柏锋,张传亮,赵灵燕,桂平雄
(浙江省动物疫病预防控制中心,浙江杭州 310018)
副猪嗜血杆菌(Haemofhilus parasuis,Hps)是巴氏杆菌科嗜血杆菌属的,体积较小、不运动、多形性(从单球杆菌到丝状链)革兰氏阴性菌,在巧克力琼脂平板培养1~3 d后,产生小的、棕色至灰白色菌落,在血平板上(含烟酰胺腺嘌呤二核苷酸,NAD),产生小的、半透明、不溶血菌落[1],是定殖于仔猪上呼吸道的一种常在菌。仔猪出生后可通过分娩时与母猪接触而感染Hps。家猪和野猪是该菌当前已知的仅有宿主[1-2]。早在1910年,德国科学家Glässer在患有纤维素性浆膜炎的病猪渗出液中发现了该菌。1969年,Biberstein和White证实该菌在生长时不需要X因子(氯化高铁血红素),并将其命名为副猪嗜血杆菌[1]。2017年12月,浙江省杭州市萧山区一规模猪场保育舍猪群出现高热(41.5 ℃)、咳嗽、腹式呼吸、关节肿胀伴有跛行和被毛粗乱等临床症状,为明确病原,对2头死病猪的肺脏进行了细菌分离鉴定。
1 材料
1.1 设备
LH11 CO2培养箱:购自Thermo scienti fi c公司;Scope A1显微镜:购自ZEISS公司;1300 Series A2生物安全柜:购自Thermo scienti fi c公司;Research plus移液器:购自Eppendorf公司;Thermo Mixer C恒温混匀仪:购自Eppendorf公司;5424离心机:购自Eppendorf公司;Speed Cycler2 PCR仪:购自Analytik jena公司。
1.2 培养基和试剂
血琼脂平板、巧克力平板:购自郑州安图生物工程股份有限公司;革兰氏染色液试剂盒:购自青岛高科技工业园海博生物科技有限公司;金黄色葡萄球菌、副猪嗜血杆菌标准菌株:购自中国兽医药品监察所;氧化酶试剂:购自杭州怡丹生物技术有限公司;Ex Taq酶:购自TaKaRa;QIAamp®DNA纯化试剂盒-Mini:购自QIAGEN;引物和探针:由上海生工公司合成。
1.3 样本来源
2017年12月21日,对浙江省杭州市萧山区某规模猪场2头40日龄病死保育猪进行剖检,无菌采集2份肺脏病变样品(编号为肺1、肺2)做细菌分离培养。
2 方法
2.1 细菌分离和纯化
2.1.1 细菌分离 无菌操作,切开肺脏病变组织,用接种环刮取病料接种于血平板,再用金黄色葡萄球菌作交叉划线,37 ℃ 5% CO2条件下培养24 h。
2.1.2 细菌纯化 挑取单个可疑菌落接种于巧克力平板,37 ℃ 5% CO2条件下培养24 h。
2.2 细菌鉴定
2.2.1 菌落形态 于血平板上培养18~24 h,观察菌落形态。
2.2.2 细菌形态及染色特性 挑取可疑菌落进行革兰氏染色,油镜下观察细菌形态及染色情况。
2.2.3 V因子需要测定 将可疑菌株纯培养物接种于血平板(方法同2.2.1)。
2.2.4 过氧化氢酶试验 在洁净的载玻片上滴1滴3%的H2O2溶液,用接种环挑取适量的可疑菌与H2O2溶液混匀,观察是否有气泡产生。
2.2.5 氧化酶试验 用灭菌滤纸条刮取待检细菌纯培养物,并在上面滴1滴氧化酶试剂,10~30 s内观察结果。
2.2.6 PCR检测 根据逯忠新等[3]的方法,合成特异性引物。F1:TAT CGG GAG ATG AAA GAC;F2:GTA ATG TCT AAG GAC TAG;Revx:GAC GAA GCC GCG AGG。 用 DNA 纯化试剂盒,提取待检Hps可疑菌株和标准菌株核酸,分别作为PCR模板和阳性对照。扩增体系为:Taq 酶 0.12 μL,dNTPs 2 μL,F1、F2 引物各0.2 μL,Revx 引物 0.4 μL,10×buffer 2 μL,ddH2O 10.08 μL,DNA模板5 μL。按照以下程序进行扩增:94 ℃预变性 3 min;94 ℃变性 1 min,56 ℃退火 45 s,72 ℃延伸1 min,35个循环;72 ℃延伸10 min。取扩增产物进行琼脂糖凝胶电泳。
3 结果
3.1 细菌分离
在肺2样品中分离到Hps可疑菌株,编号为ZJYK-01235。
3.2 细菌形态学检查
3.2.1 菌落形态 培养24 h后,血平板上呈现半透明、不溶血小菌落,直径为0.5~1 mm。靠近金黄色葡萄球菌菌苔的菌落较大,随着与葡萄球菌生长线距离的增加而变小或不生长,呈“卫星现象”(图1)。
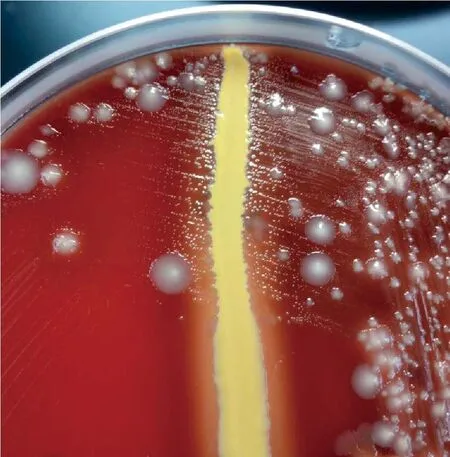
图1 初分离情况
3.2.2 细菌形态 涂片、革兰氏染色后镜检,发现为革兰氏阴性、短小杆菌,呈多形态,从球杆状到丝状链(图2)。
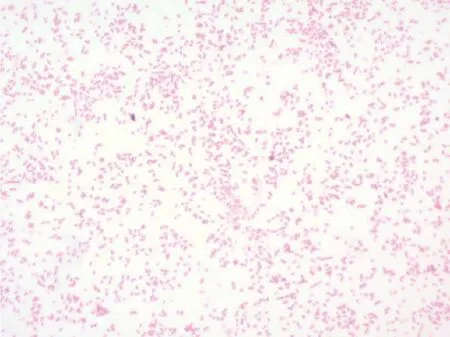
图2 ZJYK-01235菌株显微镜下形态
3.3 V因子需要测定
可疑菌株(ZJYK-01235)在血平板上生长有“卫星现象”(图1),表明该菌株需要V因子。
3.4 过氧化氢酶、氧化酶试验
ZJYK-01235菌株过氧化氢酶试验结果阳性,氧化酶试验阴性。
3.5 PCR检测
对ZJYK-01235菌株进行PCR检测,发现一条1 090 bp大小条带,表明该菌株为Hps(图3)。
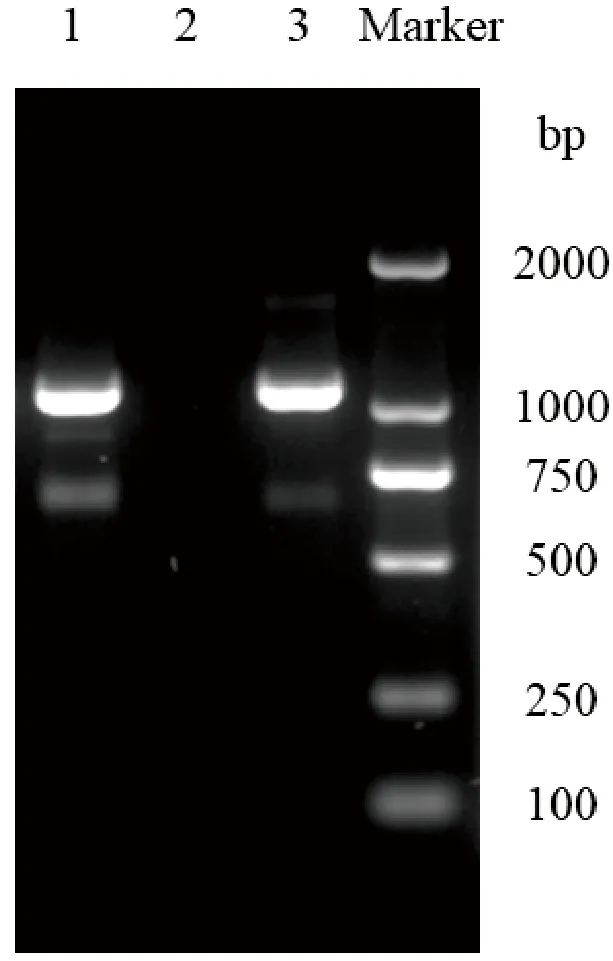
图3 ZJYK-01235菌株PCR检测结果
3.6 结果判定
综合分析ZJYK-01235菌株的菌落形态、生长特性、细菌形态学检查情况和PCR检测结果,可以判定该菌株为Hps。
4 讨论
Hps可导致原发性或继发性呼吸道疾病,但在免疫抑制情况下能够侵入机体,扩散到机体其他部分,因而可从全身各部位分离获得[1]。浙江省流行的Hps血清型主要为5/12型、4型、13型和14型,部分猪场还存在2种血清型共感染现象[4]。健康状态下,仔猪在受母源抗体保护时可出现Hps定居,而且在定居菌与仔猪免疫之间达成平衡。当室内温度不稳定、通风不良、早期断奶,以及存在其他病原体感染或猪群中引进了Hps毒力菌株或新毒力菌株时,这种平衡便被打破,从而引起本病发生。Hps可影响2周龄到4月龄的猪,主要导致断奶后和保育阶段的猪发病,通常见于5~8周龄仔猪,发病率一般在10%~15%之间,严重时死亡率可达50%,主要临床表现为咳嗽、呼吸困难、消瘦、跛行和被毛粗乱,主要剖检病变为纤维素性胸膜炎、心包炎、腹膜炎、关节炎和脑膜炎等[5]。
Hps在生长过程中需要V因子(烟酰胺腺嘌呤二核苷酸,NAD),可在巧克力琼脂平板和含NAD的TSA平板上生长。该菌虽然在普通血平板上不能生长,但如果将其接种在能够提供V因子来源的葡萄球菌划线血平板上进行培养,在靠近葡萄球菌菌苔附近能够生长,并呈现特征性的“卫星现象”。在临床病料初分离时,可以利用这一特点,挑取可疑菌落作进一步纯化和鉴定,这有助于提高该菌的分离率。在Hps初分离时,初学者不宜直接使用巧克力平板和TSA平板。因为在这两种培养基上,Hps菌落特征并不明显,很难与其他杂菌菌落区分开。在Hps纯化培养时,可选用巧克力平板或TSA平板。
在Hps鉴定时要重视形态学检查,并做初步的生化试验,对符合Hps特点的可疑菌株进一步做PCR检测,然后综合形态学、生化特性和PCR检测结果,对分离菌株作出最终鉴定结果。
值得注意的是,Hps也是猪呼吸道疾病综合征(PRDC)的病原体之一。采用抗生素防治是控制保育阶段Hps、猪肺炎支原体、胸膜肺炎放线杆菌等细菌继发/混合感染的有效手段,是减少猪群死淘率的重要措施。
5 结论
本研究剖检2头具有Hps感染症状病死猪,可见纤维素性肺炎和心包积液;将肺脏病料接种于血平板,并用金黄色葡萄球菌作交叉划线,于37 ℃ 5% CO2条件下培养24 h,其中一份病料分离到呈“卫星现象”生长的Hps可疑菌落。挑取可疑菌落纯化培养镜检,发现其为革兰氏阴性短小杆菌,呈多形态。氧化酶试验结果为阴性,过氧化氢酶试验为阳性。提取该菌株DNA进行PCR检测,发现一条1 090 bp条带。综合病猪临床症状、剖检变化和分离菌株的形态学检查、生化试验及PCR检测结果,证明该分离株为Hps。
[1] ZIMMERMAN J J,KARRIKER L A,RAMIREZ A,et al.猪病学[M]. 10版. 赵德明,张仲秋,周向梅,等主译.北京:中国农业大学出版社,2014:795-803.
[2] 蒋增海,徐耀辉,邓同炜,等. 副猪嗜血杆菌分离鉴定及药敏试验[J],动物医学进展,2016,37(6):124-128.
[3] 逯忠新,贺英,储岳峰,等. 副猪嗜血杆菌PCR检测方法:NY/T2417-2013[S]. 北京:农业部,2014.
[4] 江军,姜平,王一成,等. 浙江省副猪嗜血杆菌血清型调查及其潜在毒力相关基因分析[J]. 畜牧与兽医,2016,48(8):1-7.
[5] 蔡旭旺,刘正飞,陈焕春,等. 副猪嗜血杆菌的分离培养和血清型鉴定[J]. 华中农业大学学报,2005,24(1):55-58.

