两种基因型菊芋幼苗对盐胁迫的生长及生理响应
段海霞, 邹恭鲁, 杨永鑫, 李 颖, 吕世奇, 孙 杉, 赵长明
(兰州大学生命科学学院,草地农业生态系统国家重点实验室,甘肃 兰州 730000)
土壤盐渍化是影响农业生产以及生态环境的一个全球性问题,在全世界干旱和半干旱地区,土壤盐渍化限制作物生产[1,2]。据统计,我国有1亿多公顷各种盐渍土地,主要集中于西部六省区,其面积约占全国盐渍土面积的66.6%,西部盐渍化耕地约344.7 × 104hm2,占西部地区耕地面积13.93%,占全国盐渍化耕地37.4%,其中以典型盐土面积最大且土壤盐分以氯化物和硫酸盐为主要成分[3,4]。盐胁迫是农业生产中影响植物生产力最主要的非生物胁迫之一,盐胁迫下植物吸收水分和营养物质能力降低,且生产速率迅速降低[5],也能引起一些和水分胁迫十分相似的新陈代谢变化[6]。尤其农作物受到盐胁迫时,在盐离子丰富的环境中由于农作物各组织中多种营养物质可以抵抗该胁迫,将会导致植物营养不足,并且产生特殊毒害[7]。
菊芋(HelianthustuberosusL.)为菊科向日葵属草本植物,又名洋姜,起源于北美。菊芋生物量大、管理成本低、易转化,是一种理想的非粮能源植物[8-11]。此外,菊芋具有极强的无性繁殖能力和抗逆性,特别是抗旱、抗盐碱、耐贫瘠等[12],在盐碱地种植菊芋可产生明显的经济效益和生态效应[13]。关于菊芋对单盐、单碱或是盐碱混合的响应机理研究报道较多[6, 13-17],但是使用氯化钠和硫酸钠中性复合盐模拟西部盐渍土对具有不同遗传背景菊芋种质影响的研究较为鲜见。人们总是有意或无意地改变作物的株型以获得较高的产量,植物为了适应新环境会在产量和抗逆性之间权衡[18]。为了探究不同遗传背景菊芋种质耐盐性的差异及其耐盐机理,本试验选择具有不同遗传背景的两种基因型菊芋LZJ028和LZJ017为研究对象,其中LZJ028有性繁殖能力强且营养品质高,LZJ017块茎产量高[19],测定这两种基因型菊芋幼苗形态指标、气体交换参数及叶绿素荧光参数等生理指标,探究在盐胁迫下菊芋生理生态响应机理,为进一步筛选耐盐菊芋和改良西部盐渍土提供理论指导。
1 材料与方法
1.1 试验材料
选择具有不同遗传背景的两种基因型菊芋为试验材料,LZJ028有性繁殖能力强且营养品质高,推测更倾向于野生化,LZJ017具有较高的块茎产量,推测倾向于经历了较长时间的人工驯化[19],菊芋来源及编号见表1。

表1 试验材料编号和来源
1.2 试验设计
2015年4月1日~11月20日在兰州大学榆中校区试验站遮雨棚内进行盆栽试验。用规格相同的塑料盆(内径30cm,深45cm),分别装风干混匀的沙土17 kg(土与沙比例为3∶1)。选取20 g左右、大小一致的完整新鲜菊芋块茎,用自来水及蒸馏水冲洗干净,经体积分数为0.05%的多菌灵进行块茎表面灭菌,然后栽种于塑料盆中。试验处理使用NaCl和Na2SO4(摩尔比为2∶1)中性复合盐按照土壤含盐量的质量分数设置为:低度盐化即土壤含盐量2 g·kg-1(2‰)、中度盐化即土壤含盐量4 g·kg-1(4‰)、重度盐化即土壤含盐量6 g·kg-1(6‰)三个盐分梯度[20],无盐处理为对照(CK),每个处理种植8盆,共计64盆,每盆定株一颗。每隔两天于18∶00时,采用称重法补充水分,土壤含水量保持在试验用土最大持水量的70%。待菊芋出苗25 d后,每个处理选取3株长势均一的植株取样并测定苗期各指标。
1.3 指标测定
1.3.1 形态指标和生物量的测定 利用卷尺测定菊芋幼苗株高和冠幅、游标卡尺测定其基径,用叶面积仪(Li-3000a, Li-COR USA)测定其整株叶面积。幼苗地上部分以单株为单位分别称叶和茎鲜重,并于115℃杀青30 min,85℃烘干至恒重,称其生物量干重。
1.3.2 生理生化指标的测定 每个处理采集菊芋幼苗植株上部相同位置(自植株顶部第3~5片)完全展开叶进行液氮保存,然后带回实验室采用茚三酮法测定叶片游离脯氨酸含量、NBT光还原法测定SOD活性、蒽酮法测定可溶性糖和丙酮比色法测定叶绿素含量[21]。
1.3.3 气体交换和叶绿素荧光参数的测定 在形态指标测定前,利用便携式光合作用测定系统(Li-6400, Li-COR USA)于上午10∶00选取相同位置(自植株顶部第3片)完全展开叶测定各处理菊芋幼苗的净光合速率(Pn)、蒸腾速率(Tr)和气孔导度(Gs),水分利用效率(WUE)由Pn/Tr计算所得[22]。利用植物效率分析仪(Handy PEA, Hansatech, UK)测定叶绿素荧光参数指标,包括初始荧光(Fo)、最大荧光(Fm)、可变荧光(Fv)、最大光化学效率(Fv/Fm)、潜在光化学效率(Fv/Fo)和电子传递光量子产量(φEo)。
1.4 数据处理
采用Excel 2013和SPSS17.0进行数据处理和分析,并用单因素方差分析(One-way ANOVA)和最小显著性差异法(LSD法)分析差异显著性,用Origin 8.0作图。数据用平均值±标准误表示。
2 结果与分析
2.1 盐胁迫对两种基因型菊芋幼苗形态特征和地上生物量的影响
随着盐浓度升高,两种基因型菊芋幼苗株高、叶面积、冠幅和基径均呈下降趋势,且存在基因型间差异(图1)。与对照相比,LZJ028株高、叶面积和冠幅在低盐(2‰)胁迫时无显著差异,中、高盐(4‰和6‰)胁迫时显著降低,高盐(6‰)胁迫下,分别下降24.8%, 29.67%和27.98%;而LZJ017株高、叶面积和冠幅在各盐度下均显著降低,如:高盐胁迫下,其株高、叶面积和冠幅分别下降27.56%, 63.18%和45.20%。高盐胁迫下,LZJ017基径与对照相比显著下降,而LZJ028无显著差异。在对照和低盐处理组,LZJ017的株高、叶面积和基径显著高于LZJ028,但是在中、高盐胁迫时,LZJ028叶面积显著高于LZJ017,而高盐胁迫时两基因型菊芋株高、冠幅和基径无显著差异。
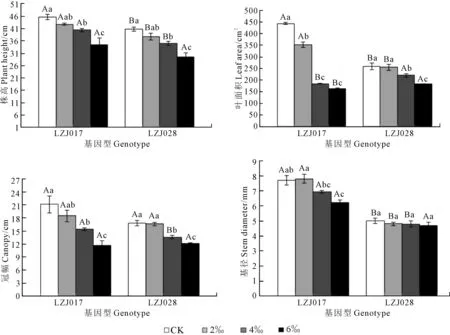
注:同指标数据柱上小写字母不同表示处理间差异显著(P<0.05);同指标数据柱上大写字母不同表示基因型间差异显著(P<0.05)。下同。Note: Different small letters show the significant difference between treatments (P<0.05); Different capitals show the significant difference between genotypes (P<0.05). The same as below.图1 盐胁迫对菊芋幼苗株高、叶面积、冠幅和基径的影响Fig. 1 Effects of salt stress on plant height, leaf area, canopy and stem diameter of jerusalem artichoke seedlings
低盐胁迫下,两种基因型菊芋叶片和茎的干鲜物质积累与其对照相比差异不明显,但中、高盐胁迫下各指标含量呈显著下降趋势(表2)。与对照相比,中、高盐胁迫下LZJ028叶鲜物质积累分别减少10.19%和24.75%,而LZJ017分别减少28.08%和59.32%,表明LZJ028叶鲜物质积累减少幅度明显小于LZJ017。叶干物质和茎干、鲜物质积累均呈现类似规律,即LZJ028减少幅度同样小于LZJ017。盐胁迫LZJ028形态指标和地上生物量积累在低盐胁迫时与对照无显著差异,而在高盐胁迫时所测各指标下降幅度均低于LZJ017。
2.2 盐胁迫对两种基因型菊芋幼苗生理特性的影响
随盐浓度升高,两种基因型菊芋SOD活性、游离脯氨酸和可溶性糖含量呈上升趋势(表3)。高盐胁迫下,LZJ028 SOD活性为对照的2.87倍,而LZJ017升高幅度较小,为对照的1.41倍;LZJ017脯氨酸含量升高幅度明显低于LZJ028,两基因型在高盐度下分别为对照的9.26和43.99倍。对照和低盐处理时,LZJ028与LZJ017可溶性糖含量无显著差异,但在中、高盐胁迫时LZJ028可溶性糖含量显著高于LZJ017的含量。
表2盐胁迫对菊芋幼苗地上部分鲜物质和干物质含量的影响
Table 2 Effects of salt stress on fresh and dry biomass of aerial part of jerusalem artichoke seedlings
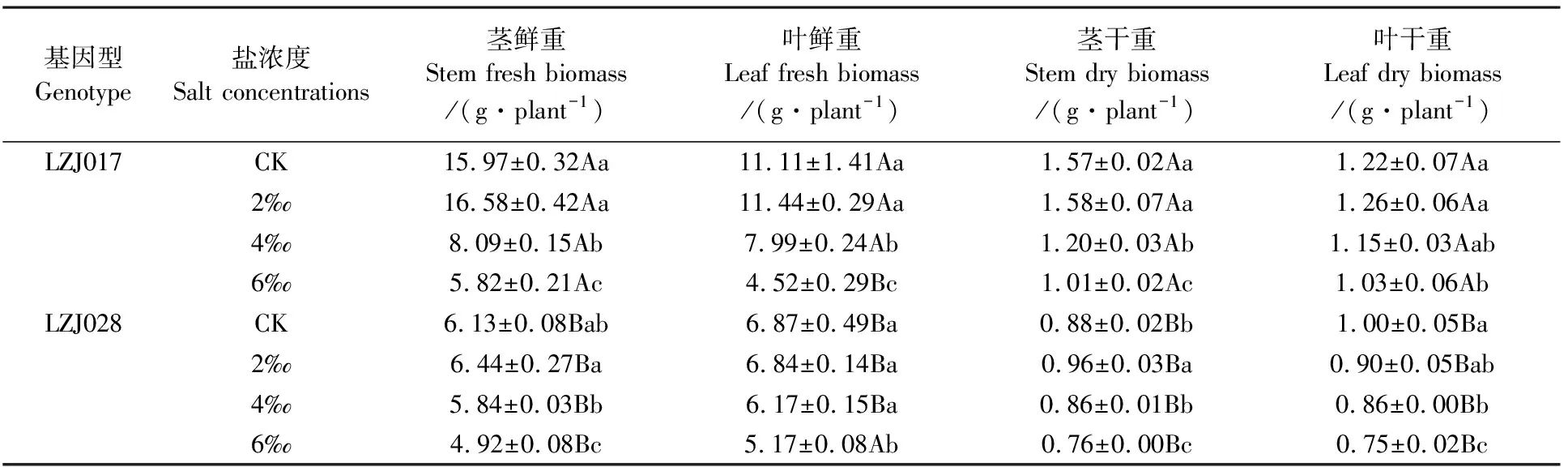
基因型Genotype盐浓度Salt concentrations茎鲜重Stem fresh biomass/(g·plant-1)叶鲜重Leaf fresh biomass/(g·plant-1)茎干重Stem dry biomass/(g·plant-1)叶干重Leaf dry biomass/(g·plant-1)LZJ017CK15.97±0.32Aa11.11±1.41Aa1.57±0.02Aa1.22±0.07Aa2‰16.58±0.42Aa11.44±0.29Aa1.58±0.07Aa1.26±0.06Aa4‰8.09±0.15Ab7.99±0.24Ab1.20±0.03Ab 1.15±0.03Aab6‰5.82±0.21Ac4.52±0.29Bc1.01±0.02Ac1.03±0.06AbLZJ028CK6.13±0.08Bab6.87±0.49Ba0.88±0.02Bb1.00±0.05Ba2‰6.44±0.27Ba6.84±0.14Ba0.96±0.03Ba 0.90±0.05Bab4‰5.84±0.03Bb6.17±0.15Ba0.86±0.01Bb0.86±0.00Bb6‰4.92±0.08Bc5.17±0.08Ab0.76±0.00Bc0.75±0.02Bc
注:同列小写字母不同表示处理间差异显著(P<0.05);同列大写字母不同表示基因型间差异显著(P<0.05)。下同。
Note:In same column different small letters show the significant difference between treatments (P<0.05); In same column different capitals show the significant difference between treatments (P<0.05). The same as below.
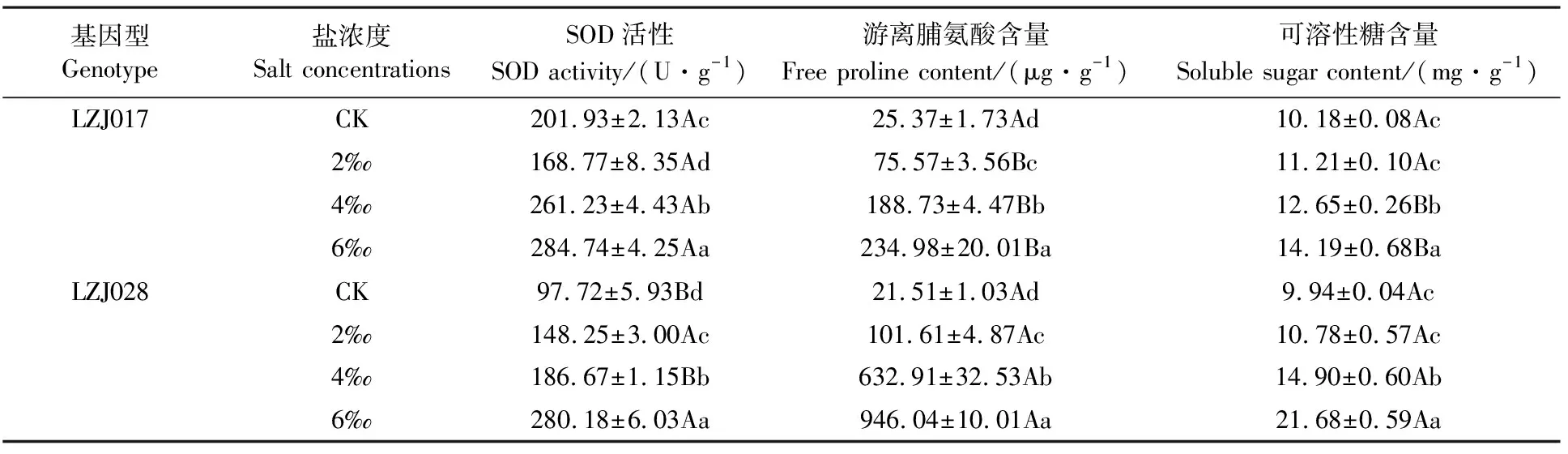
表3 盐胁迫对菊芋幼苗SOD活性、游离脯氨酸和可溶性糖含量的影响
2.3 盐胁迫对两种基因型菊芋幼苗气体交换参数的影响
两种基因型菊芋叶片净光合速率(Pn)和气孔导度(Gs)随着盐浓度升高均呈下降趋势(图2),LZJ017的蒸腾速率(Tr)随着盐浓度升高而下降,LZJ028的蒸腾速率大体呈下降趋势,在盐浓度为6‰时其Tr比4‰有所升高。高盐胁迫下,LZJ028Pn下降幅度较小,与对照比下降18.27%;而LZJ017下降26.29%,降幅较大。高盐胁迫下LZJ028Gs和Tr分别下降29.00%和13.71%,而LZJ017分别下降47.00%和23.16%,降幅显著大于LZJ028。两种基因型菊芋叶片瞬时水分利用效率(WUE)随着盐浓度升高呈先上升后下降的趋势(图2)。LZJ028 WUE最大值出现在盐浓度为4‰,而LZJ017 WUE最大值出现在2‰;且在各处理下LZJ028 WUE明显高于LZJ017。相关性分析表明Pn与Gs、叶绿素含量变化均呈显著正相关关系(图3)。
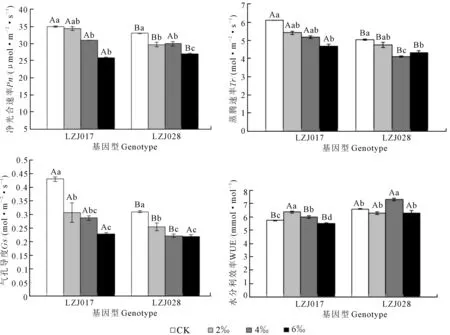
图2 盐胁迫对菊芋幼苗气体交换参数的影响Fig. 2 Effects of salt stress on gas exchange parameters of jerusalem artichoke seedlings
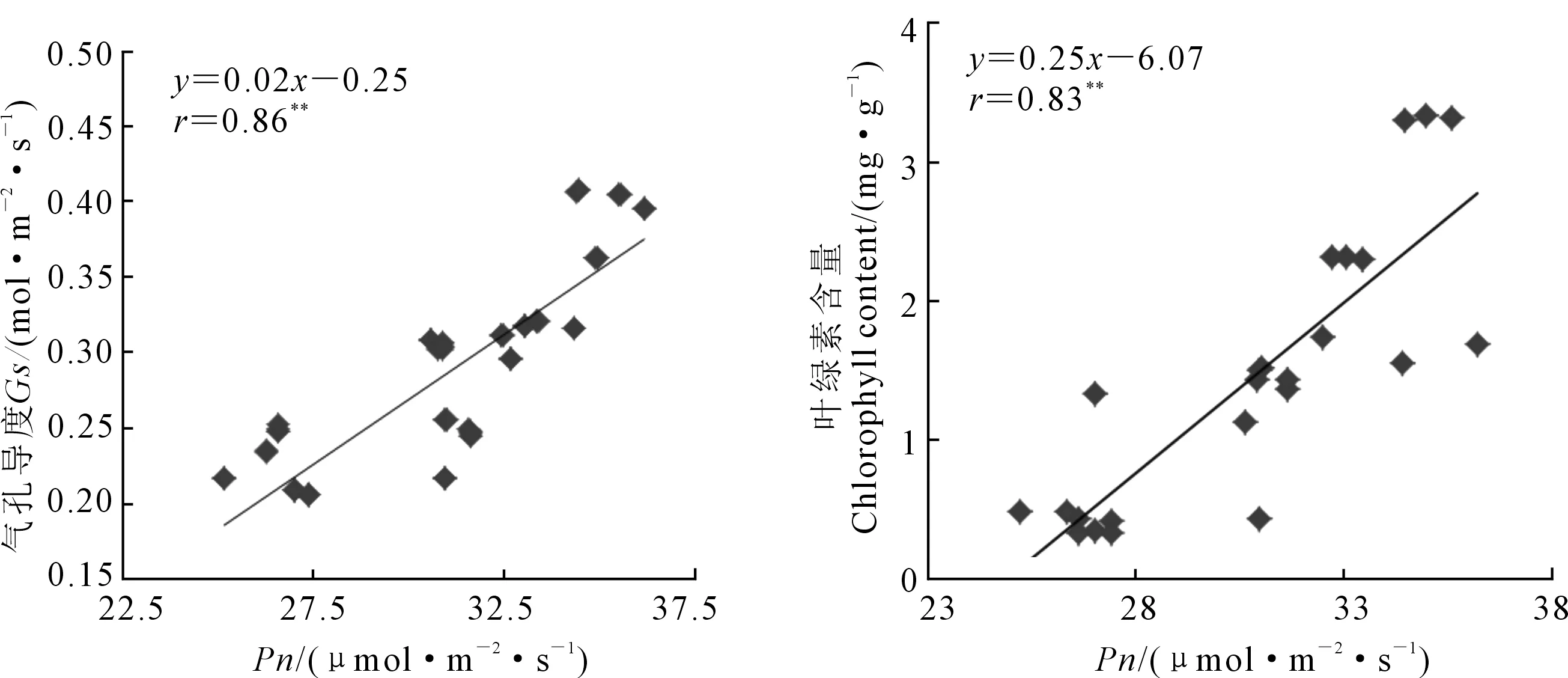
注: **表示相关性显著(P<0.01)。Note:** means significant correlation (P<0.01).图3 Pn与Gs和Chl的相关性分析Fig. 3 Relationships between Pn and Gs, Pn and Chl
2.4 盐胁迫对两种基因型菊芋幼苗叶绿素荧光参数的影响
两种基因型菊芋叶片叶绿素含量随盐浓度升高而显著下降(图4)。在对照和低盐处理时,LZJ017的叶绿素含量显著高于 LZJ028,但当盐浓度达到4‰和6‰时二者叶绿素含量无显著差异,可知LZJ017的下降幅度明显大于LZJ028。
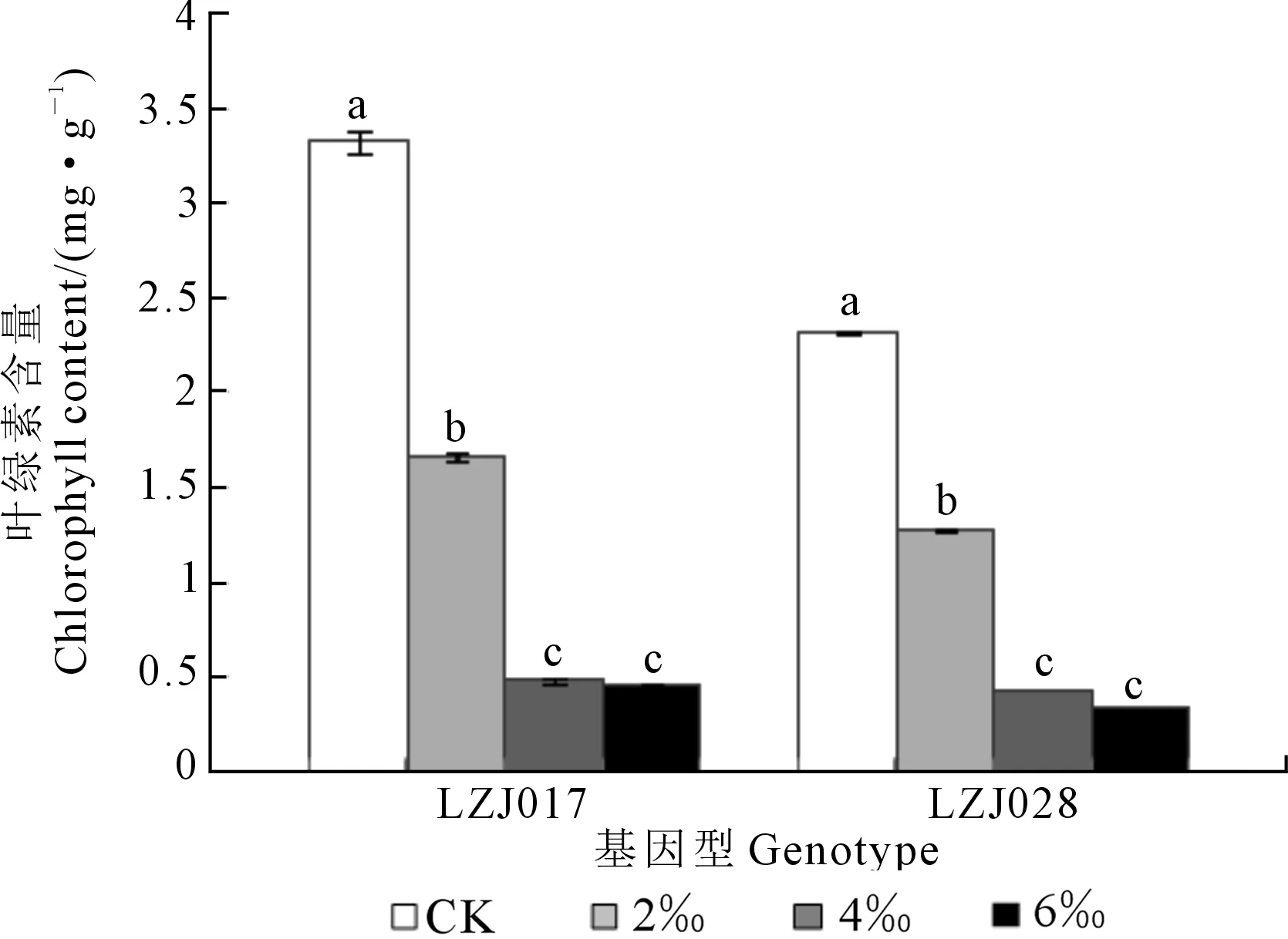
图4 盐胁迫对菊芋幼苗叶绿素含量的影响Fig. 4 Effects of salt stress on chlorophyll content of jerusalem artichoke seedlings
随着盐浓度升高,两种基因型菊芋Fv/Fo、Fv/Fm和Fm均呈下降趋势,尤其在高盐胁迫时显著下降(表4)。高盐胁迫下,LZJ028的Fv/Fo和Fv/Fm与对照相比分别下降47.88%和9.81%,而LZJ017下降78.04%和42.59%。在对照和低盐胁迫时,LZJ017与LZJ028的Fv/Fo和Fv/Fm无显著差异,当中、高盐胁迫时, LZJ017该指标显著低于LZJ028,可见LZJ017的降幅较大。LZJ028下降幅度小于LZJ017,说明高盐胁迫下LZJ028叶片PSⅡ的光化学效率稳定性较好。两种基因型菊芋Fo随盐胁迫的加剧均呈上升趋势(表4),LZJ028上升幅度显著小于LZJ017,如:高盐胁迫下其只比对照升高0.05倍,说明其PSⅡ反应中心受损伤程度较小。LZJ028φEo变化不明显,而LZJ017在中、高盐胁迫时显著下降,也说明LZJ028 PSⅡ电子传递受到影响较小。
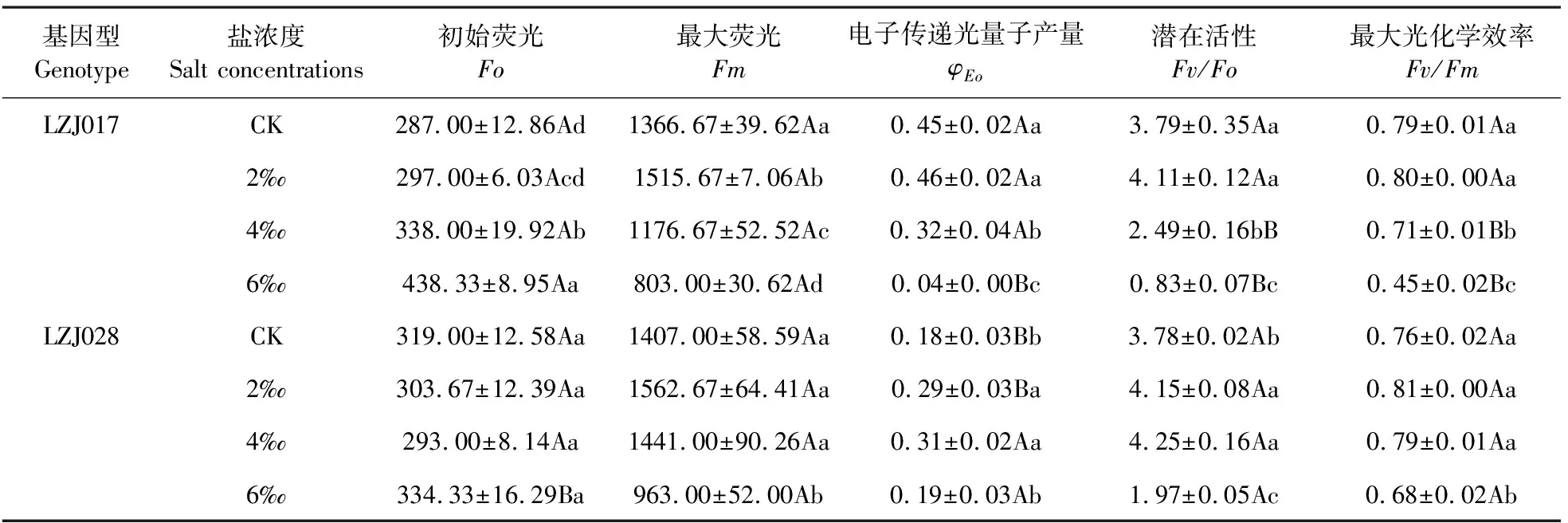
表4 盐胁迫对菊芋幼苗荧光参数的影响
3 讨论与结论
植物通过光合作用获得的能量大部分用于维持生命活动,只有一小部分用于生长发育及生物量积累等,当植物受到盐胁迫时,用于生长发育的那部分能量会重新分配用于抵御逆境[23,24]。本研究结果显示两种基因型菊芋株高、叶面积和冠幅随盐浓度升高呈下降趋势,与对照相比,LZJ028的株高、叶面积和冠幅在低盐胁迫时无显著差异,在高盐胁迫时显著降低,而LZJ017该指标在低盐和高盐胁迫下均显著低于对照,且下降幅度高于LZJ028,说明LZJ028较耐盐。生物量积累是维持植物生物活性和评价各种胁迫对植物影响的最重要指标[25]。菊芋地上生物量随盐胁迫的加剧而逐渐减少,且LZJ017降幅高于LZJ028,说明其受盐胁迫影响较大。LZJ028的株高、冠幅、叶面积以及生物量积累受到的影响较小可能由于其自身较耐盐,用于抵御盐胁迫的能量比例低于LZJ017,使其可以有更多能量用于自身的生长发育。
盐胁迫下,植物光合作用受到不同程度的抑制[26],气孔导度是CO2进入植物体内进行碳同化的关键限制因子[27]。两种基因型菊芋随着盐浓度升高其净光合速率下降。LZJ017和LZJ028在高盐胁迫时,与对照相比Gs降低,与Win等[28]对于黑绿豆的研究结果一致,且两种基因型菊芋Pn与Gs变化趋势一致,表明其光合速率的下降受气孔导度影响。叶绿素是反映光合强度的重要指标[29],本试验显示盐浓度升高,菊芋叶片叶绿素含量下降,且两种基因型菊芋的Pn与Chl具有显著的正相关性,表明菊芋光合速率的下降也与叶绿体的活性下降有关。蒸腾作用是植物对水分吸收和运输的主要动力,可以间接地为光合作用提供所需水分和矿质元素[30]。本研究中随着盐浓度升高,两种基因型菊芋Tr逐渐下降,与Win等[28]研究结果一致,表明高盐胁迫时,菊芋降低蒸腾速率,从而维持各组织水分,在一定程度抑制了光合作用,但对其在逆境条件下生存有重要意义。在中、高盐胁迫时,LZJ028的水分利用效率较高,而LZJ017较低,表明盐逆境时LZJ028对于水分的利用效率较高,使其保持一定的含水量。
与“表观性”的气体交换参数相比,叶绿素荧光参数更具有反映“内在性”的特点[31]。光系统Ⅱ(PSⅡ)是植物叶片进行有机物合成的光合器官重要组分之一,其功能稳定性决定着植物光能的吸收和电子传递水平,从而限制植物有机物累积能力[32],且叶绿素荧光与光合作用中各种反应过程密切相关,能够用来验证植物受到胁迫时被伤害的程度[33, 34]。PSⅡ反应中心的破坏或可逆失活则能引起Fo的增加[35],Fo的变化程度可用来鉴别植物的不同抵抗或耐盐能力[14],φEo指吸收光能用于QA-以后的电子传递的能量比例,Fv/Fm是反映PSⅡ光化学效率的稳定指标。本研究结果显示在高盐胁迫下,与对照相比LZJ028φEo和Fv/Fm下降幅度较小且Fo变化不显著,而LZJ017在中、高盐胁迫时其变化幅度较大,说明LZJ028 PSⅡ电子传递受到的影响较小,PSⅡ的损伤不明显,具有较高的耐盐性,而LZJ017 PSⅡ受到较大损害。
光合系统受到破坏抑制了光合作用的原初反应[36],在光抑制过程中电子传递受阻导致能量滞留,产生大量活性氧[37]。SOD是植物体内防御系统的第一道防御,是清除植物体内活性氧的主要抗氧化酶[38]。本研究表明随着盐浓度升高,两种基因型菊芋SOD活性均增强,与王恩军等人[39]的研究结果一致。植物利用各种策略对抗土壤中的盐,最重要的一个策略就是渗透调节,所有细胞调控积累足够的可溶性渗透物质如脯氨酸和可溶性糖用于降低细胞渗透势,保持细胞膨压[23]。本试验中两种基因型菊芋叶片脯氨酸和可溶性糖含量随盐浓度升高均逐渐增加,与Muchate等人[40]的研究结果一致,且LZJ028的增幅大于LZJ017,表明LZJ028具有较高的耐盐性。有研究表明随着盐胁迫程度加深,植物可溶性糖含量增加可能是淀粉含量和总糖含量积累引起的[38]。
综上,盐胁迫使菊芋叶片叶绿素含量和气孔导度下降,破坏叶绿素合成系统,且通过破坏PSⅡ的反应中心以及阻碍电子传递,使能量滞留产生大量活性氧,进而影响最大光化学效率和抑制光合作用,最终抑制菊芋生长。本研究通过对两种基因型菊芋在不同浓度盐胁迫下的形态特征、生理特性和光合特性进行研究和对比,结果表LZJ028较耐盐,LZJ017对盐较敏感,两基因型菊芋在盐胁迫下主要通过提高SOD抗氧化酶活性清除体内的活性氧,且积累大量的可溶性渗透物质脯氨酸和可溶性糖降低细胞渗透势维持细胞膨压,进而抵御逆境。
参考文献:
[1] Athar H U R, Zafar Z U, Ashraf M. Glycinebetaine improved photosynthesis in canola under salt stress: Evaluation of chlorophyll fluorescence parameters as potential indicators [J]. Journal of Agronomy and Crop Science, 2015, 201(6):428-442.
[2] Munns R. Comparative physiology of salt and water stress[J]. Plant Cell and Environment, 2002. 25(2):239-250.
[3] 顾国安. 新疆盐渍化土壤的形成及其防治[J]. 干旱区地理, 1984, 7(4):1-16.
[4] 樊自立,马英杰,马映军. 中国西部地区的盐渍土及其改良利用[J]. 干旱区研究, 2001, 18(3):1-6.
[5] Li Q, Tang Z, Hu Y, et al. Functional analyses of a putative plasma membrane Na+/H+antiporter gene isolated from salt tolerant Helianthus tuberosus[J]. Molecular Biology Reports, 2014,41(8):5097-5108.
[6] Xue Y F, Liu Z P. Antioxidant enzymes and physiological characteristics in two Jerusalem artichoke cultivars under salt stress [J]. Russian Journal of Plant Physiology, 2008,55(6):776-781.
[7] Tuteja N, Gill S S. Na+tolerance and Na+transport in higher plants [J]. Annals of Botany, 2003,91(5):503-527.
[8] Li X F, Hou S L, Su M, et al. Major energy plants and their potential for bioenergy development in China [J]. Environmental Management, 2010,46(4):579-589.
[9] 寇一翾, 吕世奇, 刘建全, 等. 寡糖类能源植物菊芋及其综合利用研究进展[J]. 生命科学, 2014, 26(5):451-457.
[10] 吕世奇, 寇一翾, 杨彬, 等. 半干旱地区菊芋品系植株表型与光合特性分析[J]. 作物学报,2014, 40(10):1857-1864.
[11] 刘祖昕, 谢光辉. 菊芋作为能源植物的研究进展[J]. 中国农业大学学报, 2012, 17(6):122-132.
[12] Zhuang D F, Jiang D, Liu L, et al. Assessment of bioenergy potential on marginal land in China [J]. Renewable & Sustainable Energy Reviews, 2011,15(2):1050-1056.
[13] Lu Y, Ye H J, Geng S B, et al. Effects of NaCl stress on growth, leaf photosynthetic parameters and ion distribution of Helianthus tuberosus seedling [J]. Journal of Plant Resources and Environmen, 2010,19(2):86-91.
[14] Long X H, Liu Z P, Zheng Q S, et al. Effects of seawater with different concentrations on growth and physiological and biochemical characteristics ofHelianthustuberosusseedlings [J]. Acta Ecologica Sinica, 2005, 25(8):1881-1889.
[15] 薛延丰, 刘兆普. 不同浓度NaCl和Na2CO3处理对菊芋幼苗光合及叶绿素荧光的影响[J]. 植物生态学报, 2008, 32(1):161-167.
[16] 吴成龙, 周春霖, 尹金来, 等. 碱胁迫对不同品种菊芋幼苗生物量分配和可溶性渗透物质含量的影响[J]. 中国农业科学, 2008, 41(3): 901-909.
[17] 黄增荣, 隆小华, 刘兆普, 等. KNO3对NaCl胁迫下两菊芋品种幼苗生长及光合能力的影响[J]. 草业学报,2011,20(1):82-88.
[18] 王建永, 李朴芳, 程正国, 等. 旱地小麦理想株型与生长冗余[J]. 生态学报, 2015, 35 (8):2428-2437.
[19] 寇一翾. 菊芋种质资源多样性及高产量形成机理研究[D]. 兰州:兰州大学, 2013.
[20] 陈丽娟,冯起,成爱芳. 民勤绿洲土壤水盐空间分布特征及盐渍化成因分析[J]. 干旱区资源与环境,2013,27(11):99-105.
[21] 高俊凤. 植物生理学实验指导[M]. 北京:高等教育出版社, 2006.
[22] 曲桂敏, 束怀瑞, 王鸿霞. 钾对苹果树水分利用效率及有关参数的影响[J]. 土壤学报, 2000, 37(2):257-262.
[23] Rana M, Matthew G. Salinity tolerance of crops - what is the cost? [J]. New Phytologist, 2015, 208(3):668-73.
[24] Jacoby R P, Taylor N L, Millar A H. The role of mitochondrial respiration in salinity tolerance [J]. Trends in Plant Science, 2011, 16(11):614-23.
[25] Gong B, Wen D, Vandenlangenberg K, et al. Comparative effects of NaCl and NaHCO3stress on photosynthetic parameters, nutrient metabolism, and the antioxidant system in tomato leaves [J]. Scientia Horticulturae, 2013,157(3):1-12.
[26] Chaves M M, Flexas J, Pinheiro C. Photosynthesis under drought and salt stress: Regulation mechanisms from whole plant to cell[J]. Annals of Botany, 2009, 103(4):551-60.
[27] 寇伟锋, 刘兆普, 陈铭达, 等 . 不同浓度海水对油葵幼苗光合作用和叶绿素荧光特性的影响[J]. 西北植物学报, 2006, 26(1):73-77.
[28] Win K T, Oo A Z, Ookawa T, et al. Changes in hydraulic conductance cause the difference in growth response to short-term salt stress between salt-tolerant and -sensitive black gram (Vignamungo) varieties [J]. Journal of Plant Physiology, 2016, 193:71-78.
[29] Lin Z H, Chen L S, Chen R B, et al. CO2assimilation, ribulose-1,5-bisphosphate carboxylase/oxygenase, carbohydrates and photosynthetic electron transport probed by the JIP-test, of tea leaves in response to phosphorus supply [J]. Bmc Plant Biology, 2009, 9(4):43.
[30] 刘金祥, 陈伟云, 肖生鸿. 黑籽雀稗的光合生理特性研究[J]. 草业学报, 2009, 18(6):254-258.
[31] 沈允钢, 施教耐, 许大全. 动态光合作用[M]. 北京:科学出版社,1998.
[32] 马飞, 徐婷婷, 陈立同, 等. 低温胁迫下二倍体杂交种高山松光系统Ⅱ功能稳定性研究[J]. 西北植物学报, 2011, 31(6):1174-1179.
[33] 马清, 楼洁琼, 王锁民. Na+对渗透胁迫下霸王幼苗光合特性的影响[J]. 草业学报, 2010, 19(3):198-203.
[34] 许耀照, 曾秀存, 郁继华, 等. 水杨酸对高温胁迫下黄瓜幼苗叶绿素荧光参数的影响[J]. 西北植物学报,2007,27(2):267-271.
[35] 李磊, 李向义, 林丽莎, 等. 两种生境条件下6种牧草叶绿素含量及荧光参数的比较[J]. 植物生态学报, 2011, 35(6):672-680.
[36] Meloni D A, Oliva M A, Martinez C A, et al. Photosynthesis and activity of superoxide dismutase, peroxidase and glutathione reductase in cotton under salt stress [J]. Environmental & Experimental Botany, 2003,49(49):69-76.
[37] Duarte B, Santos D, Marques J C, et al. Ecophysiological adaptations of two halophytes to salt stress: Photosynthesis, PS II photochemistry and anti-oxidant feedback-Implications for resilience in climate change [J]. Plant Physiology & Biochemistry, 2013,67(3):178-188.
[38] Farhangi-Abriz S, Torabian S. Antioxidant enzyme and osmotic adjustment changes in bean seedlings as affected by biochar under salt stress[J]. Ecotoxicology & Environmental Safety, 2017:64-70.
[39] 王恩军,李善家,韩多红,等. 中性盐和碱性盐胁迫对黑果枸杞种子萌发及幼苗生长的影响[J]. 干旱地区农业研究,2014,32(06):64-69.
[40] Muchate N S, Nikalje G C, Rajurkar N S, et al. Physiological responses of the halophyte Sesuvium portulacastrum, to salt stress and their relevance for saline soil bio-reclamation[J]. Flora - Morphology, Distribution, Functional Ecology of Plants, 2016, 224:96-105.

