不同外源调节物质对低温胁迫下玉米的缓解效应分析
赵小强,彭云玲,方 鹏,武博洋,闫慧萍
(甘肃省干旱生境作物学重点实验室/甘肃农业大学农学院,甘肃 兰州 730070)
低温冷害是农业可持续稳定发展最为重要的自然灾害之一,其具有大尺度性、综合性及地区差异性等特点。据统计,严重灾害年可使我国粮食减产100亿kg左右。玉米(ZeamaysL.)是一种起源于热带、亚热带的喜温作物,萌发期和苗期对低温十分敏感[1-2]。萌发期遇到10℃以下低温时,玉米种子的发芽势、发芽率、种子活力明显降低;遇到5℃以下低温时玉米种子不能发芽,甚至引发烂种[3-5]。苗期遇到10℃以下低温时,玉米幼苗生长明显受到抑制,生理生化代谢紊乱;6~8℃时幼苗停止生长;温度更低时细胞和组织产生不可逆的伤害,幼苗死亡[6-8]。在中国北方特别是东北地区,每年因低温冷害而造成这一区域春玉米减产幅度在15%以上[9-10]。因而,研究低温胁迫对玉米萌发及幼苗的伤害机理,探索玉米抗寒性机制及制定玉米抗寒预防、抵御措施,对提高玉米抗寒性具有重要的理论和实践意义。
脯氨酸(Proline,Pro)是一种可溶性小分子有机物,是植物蛋白质组分之一,其游离状态广泛存在于植物体内。而甜菜碱(Glycine betaine,GB)是一种烷基烃类含氮化合物,属于甘氨酸的季铵衍生物,其广泛存在于动植物和微生物体内。当植物受到逆境(低温、盐渍、干旱等)胁迫时,外源Pro或GB可作为渗透调节物质参与植物细胞的渗透调节、稳定膜和蛋白等亚细胞结构及清除活性氧,保护细胞抵御逆境胁迫的不利影响[11-15]。
近年来,外源Pro或GB对低温胁迫下植物耐寒性的影响已有报道。马文广等[16]报道外源Pro浸种能显著促进烟草种子发芽,提高低温逆境下幼苗根长、苗高、幼苗干鲜重及SOD、POD、CAT和APX活性,10mg·L-1Pro综合效果较好,可作为提高烟草种子及幼苗抗寒性的处理方法。梁小红等[17]报道外源GB能够有效缓解低温胁迫下结缕草叶绿素含量的下降,减少电解质渗透率和丙二醛含量的升高,显著提高SOD、POD、CAT和APX的活性、可溶性糖含量和脯氨酸含量,外施100mmol/L GB对提高结缕草的耐低温能力的效果最为显著。这些研究虽然揭示一定浓度的外源Pro或GB可有效缓解低温对植物的伤害,进而提高植物的耐寒性,但不能明确外源Pro或GB对植物低温缓解综合效果的大小,而低温胁迫下外源Pro或GB对玉米耐寒性方面的研究尚未见报道。为此,本研究以前期筛选、鉴定的3份寒敏感玉米自交系为试材,在10℃低温胁迫下,萌发期和苗期添加不同浓度外源Pro或GB后,研究不同浓度外源Pro或GB对低温胁迫下玉米种子萌发和幼苗的影响,并综合评价其缓解效果,以期为提供玉米萌发期和苗期耐寒性提供参考,为外源Pro或GB的合理使用奠定基础。
1 材料和方法
1.1 供试材料
以本课题组前期筛选、鉴定的3份寒敏感玉米自交系为试验材料[18],由甘肃农业大学农学院玉米课题组提供。其中H105W来源于33-16/A6323,K22来源于掖478衍生系,B68来源于BSSS衍生系。
1.2 试验方法
1.2.1 种子预处理 3份寒敏感自交系中选择饱满、均匀一致的种子,先用0.5%的NaClO溶液消毒10min后用双蒸水冲洗3次且灭菌滤纸吸干附着水,再分别各以5种不同浓度的Pro或GB溶液,及双蒸水常温(25℃)浸种24h,备试验所需。5种Pro或GB溶液分别为:T1(200μmol·L-1);T2(400μmol·L-1);T3(600μmol·L-1);T4(800μmol·L-1);T5(1000μmol·L-1)或T1*(10μmol·L-1);T2*(20μmol·L-1);T3*(30μmol·L-1);T4*(40μmol·L-1);T5*(50μmol·L-1)。
1.2.2 低温萌发试验 将T1~T5、T1*~T5*溶液浸种后的种子各30粒,分别置于消毒发芽盒中,双层灭菌滤纸做发芽床,然后分别加入相应浓度的Pro、GB溶液,将其先置于(10±1)℃的气候培养箱中暗培养7d,再转置于(25±1)℃的气候培养箱中继续暗培养7d的种子作为试验处理。将双蒸水浸种并用其培养的种子作为对照处理,其中(25±1)℃的气候培养箱中暗培养7d的种子作为正向对照CK(+),(10±1)和(25±1)℃的气候培养箱中先后暗培养各7d的种子作为负向对照CK(-)。气候培养箱相对湿度60%~80%,培养期间每隔2d补一次对应浓度溶液各15mL,待CK(-)处理的种子暗培养第10d时统计发芽势,第14d统计发芽率,并测量胚芽长、胚根长、胚芽鲜重、胚根鲜重。试验设3次重复。
1.2.3 幼苗生长试验 先将灭菌蛭石与双蒸水按5g∶1mL比例均匀混合,再将T1~T5、T1*~T5*溶液及双蒸水浸种后的种子各30粒,分别播种于装有灭菌蛭石的营养钵中。将其置于昼/夜温度为(25±1)/(20±1)℃的气候培养箱中培养,待双蒸水浸种的种子长至三叶一心时,用双蒸水快速冲洗掉幼苗根部蛭石,并用灭菌滤纸吸干附着水,再将幼苗分别置于相应浓度的Pro或GB溶液(300mL)中,并置于昼/夜温度为(10±1)/(6±1)℃的气候培养箱中继续培养7d的幼苗作为试验处理。双蒸水浸种并用其培养的幼苗作为对照处理,其中昼/夜温度为(25±1)/(20±1)℃的气候培养箱中培养的幼苗作为正向对照CK(+),昼/夜温度为(25±1)/(20±1)℃和(10±1)/(6±1)℃的气候培养箱中先后培养的幼苗作为负向对照CK(-)。所有幼苗培养期间,每天光照12h,光照强度600μmol/(s·m2),相对湿度60%~80%。试验设3次重复,每一处理下测定幼苗第三片叶的各项生理生化指标。
1.3 测定项目和方法
1.3.1 萌发指标测定 参照彭云玲等[19]方法,测定玉米种子各萌发性状。发芽势和发芽率按以下公式计算:发芽势(germination potential,GP)=规定时间内发芽种子数/供试种子数×100(%),发芽率(germination rate,GR)=发芽种子数/供试种子数×100(%)。直接用直尺测定各自交系的胚芽长(plumule length,PL)=胚芽基部到胚芽顶部的长度,胚根长(radical length,RL)=最长胚根的长度,并测定胚芽鲜重(shoot fresh weight,SFW)和胚根鲜重(root fresh weight,RFW)。每一处理下取长势均匀一致的种子10粒,取其平均值。
1.3.2 幼苗生理生化指标测定 参照史树德等[20]方法,测定各处理下玉米幼苗第3片叶的相对电导率(relative conductivity,RC)、丙二醛含量(malondialdehyde content,MDA)、脯氨酸含量(proline content,Pro)、可溶性糖含量(soluble sugar content,SS)、超氧化物岐化酶活性(superoxide dismutase activity,SOD)、过氧化物酶活性(peroxidase activity,POD)及过氧化氢酶活性(catalase activity,CAT)。
1.3.3 单个性状的外源调节物质低温缓解指数 为方便评价外源Pro或GB对低温胁迫的缓解效果,本试验根据低温胁迫下不同浓度外源Pro或GB处理下的各测定性状值,定义了各性状的外源Pro或GB低温缓解指数(ease index,EI),其公式为:
(1)
(2)
式中,EIiTn为第i个性状在第Tn种浓度下的外源调节物质低温缓解指数;XTn为第Tn种浓度处理下的相应性状测定值;XCK(+)为正向对照CK(+)处理下的测定值;XCK(-)为负向对照CK(-)处理下的测定值。若相应性状与耐寒性呈正相关,则采用(1)式计算,反之,则用(2)式计算。EI为正值表示相应浓度的外源Pro或GB对低温胁迫起正向缓解作用,EI为负值表示相应浓度外源Pro或GB对低温胁迫起负向缓解作用。
1.3.4 不同外源调节物质低温缓解综合评价 以各测定性状的EI值作为低温缓解评价指标,借鉴彭云玲等[21]方法,采用隶属函数法综合评价外源Pro或GB的低温缓解效果,其公式为:
(3)
(4)
式中,UiTn为第i个性状在第Tn种浓度下的外源Pro或GB低温缓解隶属值,EIimax为第i个性状在n种浓度下的最大EI值,EIimin为第i个性状在n种浓度下的最小EI值。若所测EI与外源Pro或GB的缓解效果呈正相关,则采用(3)式计算,反之,则用(4)式计算,累加各浓度外源Pro或GB的EI隶属值,并求出均值后进行比较,均值越大,外源Pro或GB的低温缓解效果越大。
1.4 数据统计分析
所有试验数据均采用Microsoft Excel 2013软件对数据进行处理和绘图,采用SPSS 19.0软件对数据进行Duncan多重比较方差分析。
2 结果与分析
2.1 低温胁迫下添加不同外源调节物质后玉米相关性状的方差分析
萌发期低温胁迫下,添加不同浓度外源Pro或GB后玉米各萌发性状进行方差分析。由表1可知,萌发期低温胁迫下,添加不同浓度外源Pro后,发芽势、发芽率、胚芽长、胚根长、胚芽鲜重、胚根鲜重等6个性状在自交系间达到1%差异水平;6个性状在Pro浓度间达到1%差异水平;除胚根鲜重外,其余5个性状在自交系与Pro浓度互作间达到5%或1%差异水平。另外,萌发期低温胁迫下,添加不同浓度外源GB后,除发芽势外,其余5个性状在自交系间达到1%差异水平;6个性状在GB浓度间达到了1%差异水平;6个性状在自交系与GB浓度互作间达到5%或1%差异水平。说明萌发期低温胁迫下,添加不同浓度的外源Pro或GB可显著影响玉米的发芽势、发芽率、胚芽长、胚根长、胚芽鲜重、胚根鲜重,且萌发期低温胁迫下,不同玉米自交系对外源Pro或GB的敏感程度不同,耐寒性越弱的玉米自交系对外源Pro或GB的敏感程度越强。
苗期低温胁迫下,添加不同浓度的外源Pro或GB后玉米幼苗各生理生化性状进行方差分析。由表2可知,苗期低温胁迫下,添加不同浓度的外源Pro或GB后,玉米幼苗的相对电导率、丙二醛含量、脯氨酸含量、可溶性糖含量、SOD、POD及CAT活性等7个生理生化性状在自交系间达到1%差异水平;7个性状在Pro或GB浓度间达到1%差异水平;除丙二醛含量、可溶性糖含量外,其余5个性状在自交系与Pro浓度互作间达到1%差异水平;另外,除可溶性糖含量外,其余6个性状在自交系与GB浓度互作间达到1%差异水平。说明苗期低温胁迫下,添加不同浓度的外源Pro或GB可显著影响玉米的生理生化特性,且苗期低温胁迫下,不同玉米自交系对外源Pro或GB的敏感程度不同,耐寒性越弱的玉米自交系对外源Pro或GB的敏感程度越强。
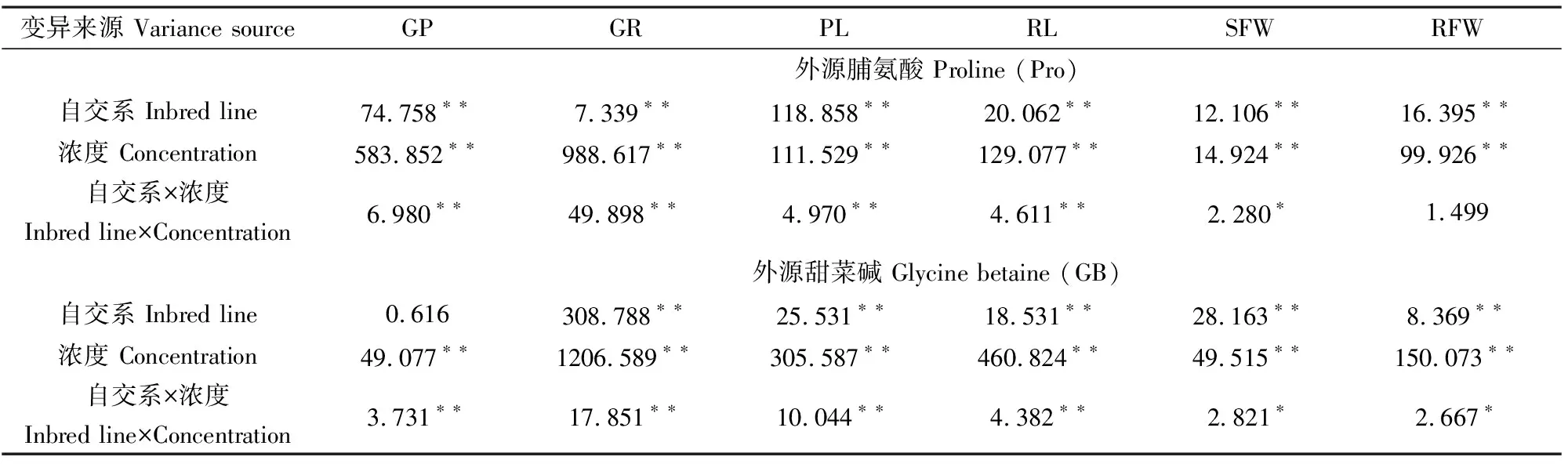
表1 低温胁迫下添加不同外源调节物质后各萌发性状的方差分析
注:“**”或“*”分别表示“1%”或“5%”水平差异显著。下同。
Note: “**”or “*” indicated significant difference at “1%” or “5%” level. The same as below.
表2低温胁迫下添加不同外源调节物质后各幼苗性状的方差分析
Table 2 Variance analysis of seedling traits with ifferent exogenous regulating substances under low temperature
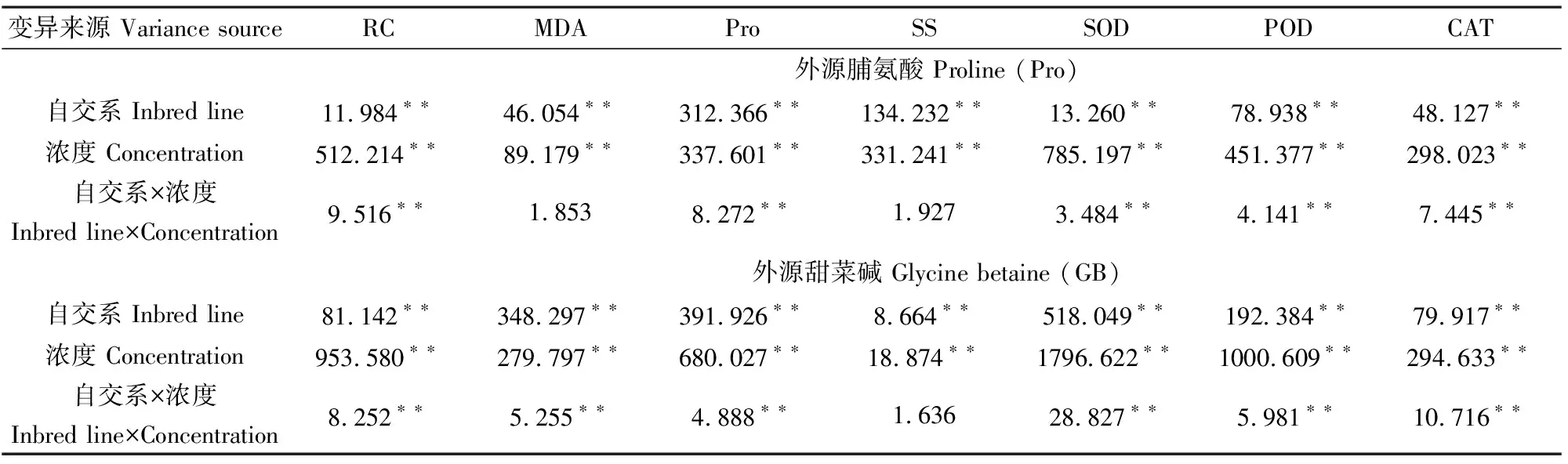
变异来源 Variance sourceRCMDAProSSSODPODCAT外源脯氨酸 Proline (Pro)自交系 Inbred line11.984∗∗46.054∗∗312.366∗∗134.232∗∗13.260∗∗78.938∗∗48.127∗∗浓度 Concentration512.214∗∗89.179∗∗337.601∗∗331.241∗∗785.197∗∗451.377∗∗298.023∗∗自交系×浓度Inbred line×Concentration 9.516∗∗1.8538.272∗∗1.9273.484∗∗4.141∗∗7.445∗∗外源甜菜碱 Glycine betaine (GB)自交系 Inbred line81.142∗∗348.297∗∗391.926∗∗8.664∗∗518.049∗∗192.384∗∗79.917∗∗浓度 Concentration953.580∗∗279.797∗∗680.027∗∗18.874∗∗1796.622∗∗1000.609∗∗294.633∗∗自交系×浓度Inbred line×Concentration 8.252∗∗5.255∗∗4.888∗∗1.63628.827∗∗5.981∗∗10.716∗∗
2.2 低温胁迫下不同外源调节物质对玉米种子萌发的影响
玉米种子萌发时对温度较为敏感,由图1可知,CK(-)低温胁迫处理明显抑制玉米种子萌发(P<0.05),与CK(+)常温处理相比,CK(-)处理下,3份玉米种子的发芽势、发芽率、胚芽长、胚根长、胚芽鲜重和胚根鲜重等6个萌发性状分别降低了76.44%、63.08%、68.09%、71.91%、54.06%和83.20%。低温胁迫下添加外源Pro或GB能有效地促进玉米种子萌发,较CK(-)处理相比,其各萌发性状都显著升高(P<0.05),但不同浓度外源Pro或GB对各萌发性状的缓解程度不同。由图1可知,就外源Pro而言,T4(800μmol·L-1)或T3(600μmol·L-1)浓度的Pro处理时,玉米的发芽势、发芽率、胚芽长或胚根长、胚芽鲜重、胚根鲜重达最大,分别是CK(-)低温胁迫处理的4.61、2.66、3.15或2.47、1.75、2.80倍,分别是CK(+)常温处理的108.69%、98.21%、100.52%或 111.32%、81.08%、46.99%;而T1(200μmol·L-1)或T5(600μmol·L-1)浓度的Pro处理时,玉米的发芽势、发芽率或胚芽长、胚根长、胚芽鲜重、胚根鲜重达最小,分别是CK(-)低温胁迫处理的2.54、1.96或2.21、1.40、1.11、1.91倍,分别是CK(+)常温处理的59.75%、72.21%或70.44%、 39.42%、51.11%、32.08%。就外源GB而言,T2*(20μmol·L-1)或T3*(30μmol·L-1)或T1*(10μmol·L-1)浓度的GB处理时,玉米的发芽势、胚芽长、胚根鲜重或发芽率或胚根长、胚芽鲜重达最大,分别是CK(-)低温胁迫处理的4.73、2.54、3.15或2.05或1.23、1.38倍,分别是CK(+)常温处理的108.69%、46.99%、100.52%或75.71%或34.64%、63.23%;T5*(50μmol·L-1)或T1*(10μmol·L-1)浓度的GB处理时,玉米的发芽势、胚芽长、胚根长、胚芽鲜重、胚根鲜重或发芽率达最小,分别是CK(-)低温胁迫处理的1.38、0.48、0.78、0.09、1.06或1.23倍,分别是CK(+)常温处理的32.62%、15.22%、21.89%、20.71%、17.79%或45.35%。
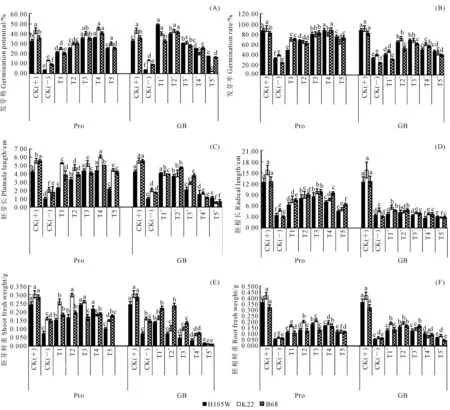
注:不同小写字母分别表示同一自交系不同处理下5%水平差异显著。下同。 Note: Different lowercase letters in the same inbred line indicated significant difference at 5% level. The same as below.图1 低温胁迫下不同外源调节物质对玉米种子萌发的影响Fig. 1 Effects of different exogenous regulating substances (Pro or GB) on maize seed germination under low temperature
2.3 低温胁迫下不同外源调节物质对玉米幼苗生理生化特性的影响
玉米幼苗遭受低温伤害时,其体内一系列生理生化代谢发生紊乱,幼苗明显受到伤害。由图2可知,CK(-)低温胁迫处理下,玉米幼苗叶片的7个生理生化性状都明显升高(P<0.05),分别是CK(+)常温处理的5.83、3.19、2.00、1.93、4.72、2.84和3.06倍。低温胁迫下添加外源Pro或GB可明显降低玉米叶片的相对电导率和丙二醛含量,可明显升高玉米叶片的脯氨酸含量、可溶性糖含量及3种保护酶(SOD、POD和CAT)活性,且不同浓度外源Pro或GB对各生理生化性状的影响程度不同。由图2可知,就外源Pro而言,T2(400μmol·L-1)或T4(800μmol·L-1)或T5(1000μmol·L-1)浓度的Pro处理时,玉米叶片的可溶性糖含量、SOD、POD及CAT活性或相对电导率、脯氨酸含量或丙二醛含量达最高,分别是CK(-)低温胁迫处理的130.30%、142.68%、128.32%、200.71%或61.55%、136.12%或59.89%,分别是CK(+)常温处理的2.51、6.73、3.65、6.13或3.59、2.72或1.91倍;T1(200μmol·L-1)或T2(400μmol·L-1)或T5(1000μmol·L-1)浓度的Pro处理时,玉米叶片的脯氨酸含量或相对电导率、丙二醛含量或可溶性糖含量、SOD、POD及CAT活性达最低,分别是CK(-)低温胁迫处理的104.48%或37.05%、35.78%或100.15%、115.32%、101.69%、113.89%,分别是CK(+)常温处理的2.09或2.15、1.14或1.93、5.44、2.89、3.48倍。就外源GB而言,T5*(50μmol·L-1)或T1*(10μmol·L-1)浓度的GB处理时,玉米叶片的相对电导率、丙二醛含量或脯氨酸含量、可溶性糖含量、SOD、POD及CAT活性达最高,分别是CK(-)低温胁迫处理的63.23%、107.89%或120.77%、129.38%、105.69%、125.34%、155.94%,分别是CK(+)常温处理的3.69、3.44或2.41、2.49、4.98、3.56、4.77倍;T1*(10μmol·L-1)或T5*(50μmol·L-1)浓度的GB处理时,玉米叶片的相对电导率、丙二醛含量或脯氨酸含量、可溶性糖含量、SOD、POD及CAT活性达最低,分别是CK(-)低温胁迫处理的39.76%、62.79%或102.89%、108.29%、89.99%、100.51%、109.41%,分别是CK(+)常温处理的2.31、2.00或2.05、2.09、4.25、2.86、3.35倍。
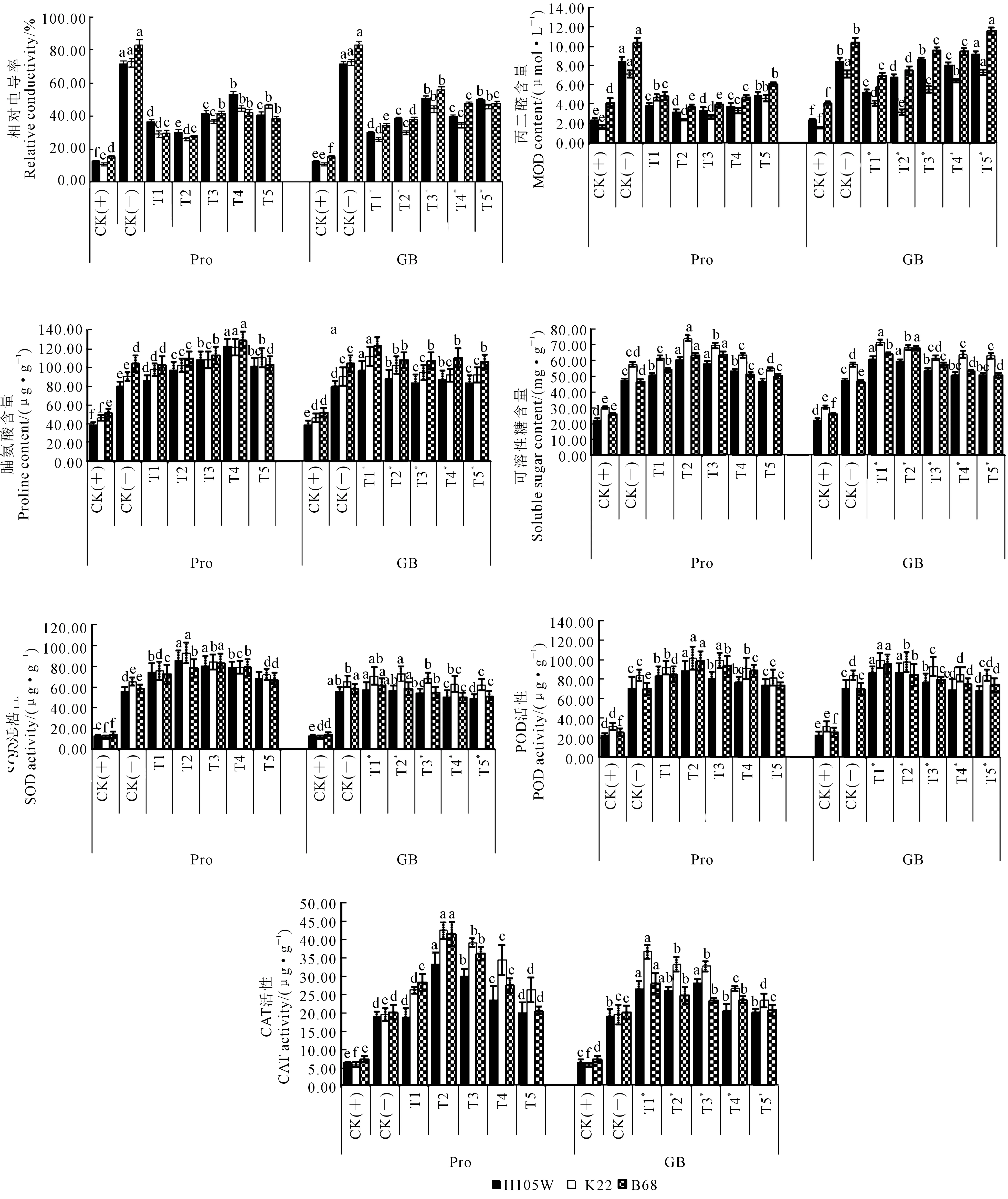
图2 低温胁迫下添加不同外源调节物质对玉米生理生化指标的影响Fig.2 Effects of different exogenous regulating substances (Pro or GB) on maize physiological and biochemical indexes under low temperature
2.4 低温胁迫下添加不同外源调节物质后玉米相关性状的低温缓解指数
由表3可知,萌发期低温胁迫下不同浓度的外源Pro或GB对玉米各萌发性状的缓解方向和大小存在差异,其EI值不尽相同(P<0.05)。就外源Pro而言,低温胁迫下T4(800μmol·L-1)浓度的外源Pro作用下玉米发芽势、发芽率、胚芽长的EI值最大,分别为1.116、0.966和1.013,T3(600μmol·L-1)浓度的外源Pro作用下玉米胚根长的EI值最大,为0.579,T2(400μmol·L-1)浓度的外源Pro作用下玉米胚芽鲜重的EI值最大,为0.620,T3(600μmol·L-1)或T4(800μmol·L-1)浓度的外源Pro作用下玉米胚根鲜重的EI值最大,都为0.365;低温胁迫下T1(200μmol·L-1)浓度的外源Pro作用下玉米发芽势、发芽率的EI值最小,分别为0.473和0.554,T5(1000μmol·L-1)浓度的外源Pro作用下玉米胚芽长、胚根长、胚芽鲜重、胚根鲜重的EI值最小,分别为0.559、0.163、0.091、0.184。就外源GB而言,低温胁迫下T2*(20μmol·L-1)浓度的外源GB作用下玉米发芽势、胚芽长和胚根鲜重的EI值最大,分别为1.151、0.723和0.362,T1*(10μmol·L-1)浓度的外源GB作用下玉米胚根长和胚芽鲜重的EI值最大,分别为0.091和0.314,T3*(30μmol·L-1)浓度的外源GB作用下玉米发芽率的EI值最大,为0.614;低温胁迫下T5*(50μmol·L-1)浓度的外源GB作用下玉米发芽势、胚芽长、胚根长、胚芽鲜重、胚根鲜重的EI值最小,分别为0.128、-0.081、-0.237、-0.794和0.005,T1*(10μmol·L-1)浓度的外源GB作用下玉米发芽率的EI值最小,为0.134。

表3 低温胁迫下添加不同外源调节物质后各萌发性状的缓解指数
注:EI1~EI6:发芽势,发芽率,胚芽长,胚根长,胚芽鲜重和胚根鲜重的缓解指数。同列测定值不同小写字母分别表示5%水平差异显著,下同。
Note: EI1~EI6: Ease index of GP, GR, PL, RL, SFW and RFW. Different lowercase letters in the same column indicated significant difference at 5% level. The same as below.
由表4可知,苗期低温胁迫下,不同浓度的外源Pro或GB对玉米各幼苗生理生化性状的缓解方向和大小存在差异,其EI值不尽相同(P<0.05)。就外源Pro而言,低温胁迫下,T2(400μmol·L-1)浓度的外源Pro作用下玉米叶片相对电导率、丙二醛含量、可溶性糖含量、SOD、POD、CAT活性的EI值最大,分别为0.757、0.931、0.639、0.544、0.445和1.492,T4(800μmol·L-1)浓度的外源Pro作用下玉米叶片脯氨酸含量的EI值最大,为0.746;低温胁迫下,T4(800μmol·L-1)浓度的外源Pro作用下玉米叶片相对电导率的EI值最小,为0.457,T1(200μmol·L-1)浓度的外源Pro作用下玉米叶片脯氨酸含量的EI值最小,为0.098,T5(1000μmol·L-1)浓度的外源Pro作用下玉米叶片丙二醛含量、可溶性糖含量、SOD、POD、CAT活性的EI值最小,分别为0.579、0.015、0.200、0.029和0.199。就外源GB而言,低温胁迫下,T1*(10μmol·L-1)浓度的外源GB作用下7个生理生化性状的EI值都最大,分别为0.727、0.542、0.420、0.627、0.069、0.399和0.820,低温胁迫下,T3*(30μmol·L-1)浓度的外源GB作用下玉米叶片相对电导率的EI值最小,为0.404,T5*(50μmol·L-1)浓度的外源GB作用下玉米叶片其余6个性状的EI值最小,分别为-0.112、0.055、0.172、-0.133、0.010和0.136。

表4 低温胁迫下添加不同外源调节物质后各幼苗性状的缓解指数
注:*EI1~EI7表示相对电导率,丙二醛含量,脯氨酸含量,可溶性糖含量,SOD活性,POD活性和CAT活性的缓解指数。
Note:*EI1~EI7 indicate ease index of RC, MDA, Pro, SS, SOD, POD and CAT.
2.5 不同外源调节物质低温缓解综合评价
以萌发或幼苗相关性状的EI值作为外源Pro或GB低温缓解综合评价指标,采用隶属函数法,对低温胁迫下不同浓度外源Pro或GB的低温缓解效果进行科学、客观、综合评价。由表5可知,就外源Pro而言,萌发期低温胁迫下,外源Pro对玉米的综合低温缓解效果随Pro浓度的增大而呈先增强后降低的趋势;T3和T4(600μmol·L-1和800μmol·L-1)浓度的外源Pro对玉米的综合低温缓解效果最佳(P<0.05),都为0.882;T5(1000μmol·L-1)浓度的外源Pro对玉米的综合低温缓解效果最小(P<0.05),为0.513。就外源GB而言,萌发期低温胁迫下,外源GB对玉米的综合低温缓解效果也随GB浓度的增大而呈先增强后降低的趋势;T2*(20μmol·L-1)浓度的外源GB对玉米的综合低温缓解效果最佳(P<0.05),为0.647;T5(50μmol·L-1)浓度的外源GB对玉米的综合低温缓解效果最小(P<0.05),仅为0.022。就外源Pro和GB比较而言,萌发期低温胁迫下,各浓度外源Pro对玉米的综合低温缓解效果远远大于外源GB对玉米的综合缓解效果,前者为后者的1.858倍。
由表6可知,就外源Pro而言,苗期低温胁迫下,外源Pro对玉米的综合低温缓解效果随Pro浓度的增大而呈先增强后降低的趋势;T2(400μmol·L-1)浓度的外源Pro对玉米的综合低温缓解效果最佳(P<0.05),为0.577;T5(1000μmol·L-1)浓度外源Pro对玉米的综合低温缓解效果最小(P<0.05),仅为0.246。就外源GB而言,苗期低温胁迫下,外源Pro对玉米的综合低温缓解效果随GB浓度的增大而呈降低的趋势;T1*(10μmol·L-1)浓度的外源GB对玉米的综合低温缓解效果最佳(P<0.05),为0.500;T4(40μmol·L-1)浓度的外源GB对玉米的综合低温缓解效果最小(P<0.05),为0.289。就外源Pro和GB比较而言,各浓度外源Pro对玉米的综合低温缓解效果与各浓度外源GB对玉米的综合低温缓解效果差异不大,前者仅为后者的1.064倍。
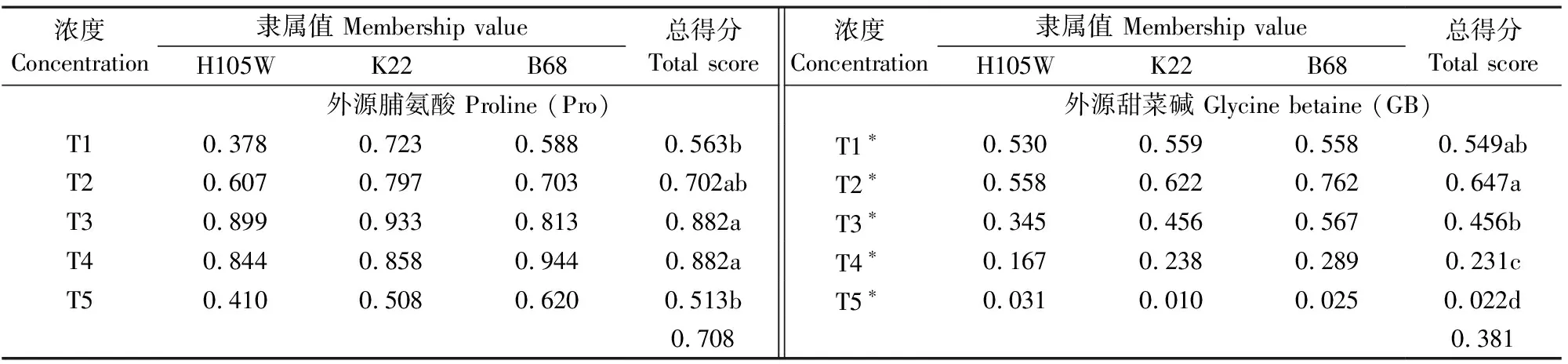
表5 萌发期低温胁迫下不同外源调节物质的缓解效果综合评价

表6 苗期低温胁迫下不同外源调节物质的缓解效果综合评价
3 结论与讨论
3.1 外源Pro或GB对低温胁迫下玉米种子萌发和幼苗生理生化特性的影响
从播种到幼苗形态建成是玉米最容易遭受低温冷害的关键时期。本试验研究表明这一阶段低温冷害能显著抑制玉米种子萌发,其发芽势、发芽率、胚芽长,胚根长、胚芽鲜重、胚根鲜重显著降低,这与陈银萍等[22]的研究结果相一致。幼苗叶片膜脂过氧化程度、活性氧清除能力及渗透调节能力均增强,其相对电导率、丙二醛含量、脯氨酸含量、可溶性糖含量显著增加,SOD、POD、CAT活性显著增强,这与前人的研究结果相一致[23-24]。植物遭受低温逆境胁迫时,外源Pro或GB可以作为渗透调节物质参与植物细胞的渗透调节,亦可作为渗透保护物质进而提高植物的抗逆能力[25-26]。本试验研究表明,外源Pro或GB对低温胁迫下玉米种子的萌发具有一定的提高,其发芽势、发芽率、胚芽长、胚根长、胚芽鲜重和胚根鲜重都显著高于对照CK(-),这与韩冬芳等[27]、刘俊英[28]的研究相一致;外源Pro或GB对低温胁迫下玉米幼苗的伤害具有一定的缓解能力,其相对电导率和丙二醛含量显著降低,脯氨酸含量、可溶性糖含量显著升高,SOD、POD和CAT活性显著增强,这与刘俊英[28]、Coughlan等[29]的研究结果一致。另外,本试验研究还表明不同浓度的外源Pro或GB显著影响玉米种子的6个萌发性状和7个幼苗生理生化性状,且不同玉米对Pro或GB的敏感程度不同,耐寒性越弱的玉米对外源Pro或GB的敏感程度越强,萌发期和苗期低温胁迫下,添加外源Pro或GB后玉米种子的6个萌发性状和7个幼苗生理生化性状在自交系间差异显著,在Pro或GB浓度间差异显著,在自交系与Pro或GB浓度间互作间差异显著。
3.2 不同玉米生育时期外源Pro或GB对低温胁迫缓解的综合评价
外源Pro或GB对逆境胁迫下植物的逆境缓解的研究已有相关报道。如马文广等[16]研究表明外源Pro浸种能显著促进烟草种子发芽,提高低温逆境下幼苗根长、苗高、幼苗干鲜重及SOD、POD、CAT和APX活性,10mg/L Pro综合效果较好,可作为提高烟草种子及幼苗抗寒性的处理方法。梁小红等[17]研究表明外源GB能够有效缓解低温胁迫下结缕草叶绿素含量的下降,减少电解质渗透率和丙二醛含量的升高,显著提高SOD、POD、CAT和APX的活性、可溶性糖含量和脯氨酸含量,外施100mmol/L GB对提高结缕草的耐低温能力的效果最为显著。刘俊英[28]研究表明盐胁迫下加入外源Pro或GB后,加工番茄的幼苗地上部鲜重、地下部鲜重、株高显著增加,幼苗叶片的丙二醛含量显著降低,脯氨酸含量、可溶性糖含量、抗坏血酸含量显著升高,SOD、POD、CAT及APX活性显著增强,且1~5mmol·L-1GB和1mmol·L-1Pro都能够很好地降低和缓解盐胁迫对加工番茄植株的伤害。沙汉景[30]研究表明15~45mmol·L-1Pro浸种能提高盐胁迫下水稻的发芽势和发芽率,15和30mmol·L-1Pro浸种显著提高盐胁迫下水稻种子的α-淀粉酶和β-淀粉酶,而适宜浓度的Pro可显著增加水稻叶片的可溶性糖含量、脯氨酸含量,并显著增强水稻叶片的SOD、POD及CAT活性。这些研究虽然揭示了外源Pro或GB对逆境胁迫下各性状的影响,或定性研究了外源Pro、GB对逆境胁迫的最佳缓解效果,但不能定量揭示外源Pro或GB对逆境胁迫的最佳缓解效果和大小。
为了揭示外源Pro或GB对低温胁迫下玉米萌发期、苗期的最佳缓解效果和大小,本试验根据各萌发性状及幼苗生理生化性状,新定义了这些性状的外源Pro或GB低温缓解指数EI,并以EI为综合低温缓解指标,采用隶属函数法,科学、客观、综合评价外源Pro或GB对玉米的低温缓解效果及大小。此方法不仅可以综合各相关性状,科学、客观、综合评价不同浓度外源Pro或GB的低温缓解效果,而且在相同的试验处理下可以比较不同外源Pro或GB的综合低温缓解效果。用此方法综合评价表明,萌发期,600和800μmol·L-1Pro或20μmol·L-1GB的综合低温缓解效果最佳为0.882或0.647,1000μmol·L-1Pro或50μmol·L-1GB的综合缓解效果最小为0.513或0.022;苗期,400μmol·L-1Pro或10μmol·L-1GB的综合低温缓解效果最佳为0.577或0.500,1000μmol·L-1Pro或40μmol·L-1GB的综合低温缓解效果最小仅为0.246或0.289。萌发期和苗期,外源Pro的综合低温缓解效果是外源GB的1.858或1.064倍。
参考文献:
[1] Saltveit M E, Morris L L. Overview on chilling injury of horticultural crops[C]∥Wang C Y. Chilling Injury of Horticultural Crops. Boca Raton, FL: CRC Press.1990:3-15.
[2] 马延华,王庆祥,陈绍江.玉米耐寒性鉴定研究进展[J].作物杂志, 2012,4:1-8.
[3] Mindy D V, Goggi A S, Kenneth J M. Determining seed performance of frost-damaged maize seed lots [J]. Crop Sci., 2007, 47:2089-2097.
[4] 郑琪,王汉宁,常宏,等. 低温冻害对玉米种子发芽特性及其内部超微结构的影响[J].甘肃农业大学学报, 2010,45(5):35-39.
[5] 马金虎,邢国芳,杨小环,等.外源EBR和NO信号对低温胁迫下玉米种胚抗氧化系统和低温响应基因表达的影响[J].应用生态学报, 2015,26(5):1411-1418.
[6] Back K H, Skinner D Z. Alteration of antioxidant enzyme gene expression during cold acclimation of near-isogonics wheat lines [J]. Plant Sci., 2003,165:1221-1227.
[7] Fryer M J, Andrews J R, Oxborough K. Relationship between CO2assimilation , photosynthetic electron transport, and active O2metabolism in leaves of maize in the field during periods of low temperature [J]. Plant Physiol, 1998,116:571-580.
[8] Shah K, Kumar R G, Verma S. Effect of cadmium on lipid peroxidation, superoxide anion generation and activities of antioxidant enzymes in growing rice seedlings [J]. Plant Science, 2001,161:1135-1144.
[9] 李晶,张丽芳,焦健,等. 低温胁迫下外源ABA对玉米幼苗生长影响[J].东北农业大学学报, 2015,46(11):1-7.
[10] 李炜君,王远皓,张雪芬,等.东北地区玉米低温冷害规律研究[J].自然灾害学报, 2011,20(6):74-80.
[11] 高灿红,胡晋,郑昀晔,等.玉米幼苗抗氧化酶活性、脯氨酸含量变化及与其耐旱性的关系[J].应用生态学报, 2006,17(6):1045-1050.
[12] 罗丹,张喜春,田硕.低温胁迫对番茄幼苗脯氨酸积累及其代谢关键酶活性的影响[J].中国农学通报, 2013, 29(16):90-95.
[13] Hasanuzzaman M, Alam M M, Rahman A, et al. Exogenous proline and glycine betaine mediated upregulation of antioxidant defense and glyoxalase systems provides better protection against salt-induced oxidative stress in two rice (OryzasativaL.) varieties [J]. Bio Med Research International,2014:757219.
[14] 马延华,王庆祥,孙德全,等.玉米自交系芽期耐寒性的鉴定与评价[J].玉米科学, 2013,21(2):88-92.
[15] 谷端银,王秀峰,杨凤娟,等.施用外源物质对园艺作物抗逆性影响研究进展[J].北方园艺, 2016,(3):195-198.
[16] 马文广,崔华威,李永平,等.不同药剂处理对低温逆境下烟草种子发芽和幼苗生长的影响[J].科技通报, 2011,27(6):873-880.
[17] 梁小红,安勐颍,宋峥,等.外源甜菜碱对低温胁迫下结缕草生理特性的影响[J].草业学报, 2015,24(9):181-188.
[18] 彭云玲,王亚昕,赵小强,等.不同玉米自交系耐寒性评价及差异分析[J].干旱地区农业研究, 2016,34(3):267-280.
[19] 彭云玲,李伟丽,王坤泽,等.NaCl胁迫对玉米耐盐系与盐敏感系萌发和幼苗生长的影响[J].草业学报, 2012,21(4):62-71.
[20] 张志良,瞿伟菁.植物生理学实验指导(第三版)[M].北京:高等教育出版社, 2003:267-269.
[21] 彭云玲,赵小强,闫慧萍,等.不同玉米自交系耐深播性评价及其遗传多样性分析[J].草业学报, 2016,25(7):73-86.
[22] 陈银萍,王晓梅,杨宗娟,等.NO对低温胁迫下玉米种子萌发及幼苗生理生化特性的影响[J].农业环境科学学报, 2012,31(2):270-277.
[23] Lyons J M. Chilling injury in plant[J]. Ann Rew Plant Physiol, 1973(24):445-466.
[24] 徐田军,董志强,兰宏亮,等.低温胁迫下聚糠萘合剂对玉米幼苗光合作用和抗氧化酶活性的影响[J].作物学报, 2012,38(2):352-359.
[25] 陈晓云,杨洪兵.外源脯氨酸对荞麦幼苗耐盐性的效应[J].中国农学通报, 2012,28(36): 92-95.
[26] 李永华,邹琦.植物体内甜菜碱合成相关酶的基因工程[J].植物生理学通讯, 2002,38(5):500-504.
[26] Li Y H, Zou Q. Genetic engineering of enzymes related to glycine betaine synthes is in plants [J]. Plant Physiology Communications, 2002,38(5):500-504.
[27] 韩冬芳,李雪萍,李军,等.甜菜碱提高植物抗寒性的几率及其应用[J].热带亚热带植物学报, 2010,18(2):210-216.
[28] 刘俊英.脯氛酸和甜菜碱对盐胁迫下加工番茄幼苗生长和生理特性的研究[D].石河子:石河子大学, 2009.
[29] Coughlan S J, Heber U. The role of glycine betaine in the protection of spinach thylakoids against freezing stress [J]. Planta, 1982,156(1):62-69.
[30] 沙汉景.外源脯氨酸对盐胁迫下水稻耐盐性的影响[D].哈尔滨:东北农业大学, 2013.

