不同根瘤菌菌株对盐胁迫下甘农9号苜蓿生长及生理特性的影响
祁 娟,王 婷,白小明,焦 婷,马国珍,杨英东,何凌峰
(甘肃农业大学草业学院/草业生态系统教育部重点实验室/甘肃省草业工程实验室/中-美草地畜牧业可持续研究中心,甘肃 兰州 730070)
土壤盐碱化在全世界广泛存在,怎样利用、恢复及改良盐碱地是目前农牧业发展亟需解决的瓶颈问题。筛选有较强耐盐碱能力且能增加土壤肥力的耐盐豆科植物,无疑是盐渍地改良利用的一项有效途径。紫花苜蓿 (MedicagosativaL.)是世界上广泛种植的较耐盐植物,它不但能为牲畜提供优质的植物蛋白,而且在盐渍地的改良中能充分发挥生物固氮的功能,减少环境污染,对大力发展畜牧业,实现农业产业结构的调整和农业可持续发展意义重大。国内外在苜蓿耐盐性方面做了大量研究并将其引入盐碱地改良[1,2],尤其是苜蓿与根瘤菌形成固氮共生体对土著菌缺乏的土壤改良效果尤为明显,所以为盐渍地紫花苜蓿选择抗逆性强的相匹配根瘤菌具有重要意义。土壤本身是一个复杂的生态系统,土壤的类型、pH值以及其它理化性质都能影响根瘤菌的接种效果。所以,对于不同地区的土壤应选择最适宜的根瘤菌作为接种剂,才能获得最佳的增产效果[3,4]。
国内外研究表明,苜蓿根瘤菌对苜蓿品种具有一定的选择性,同一菌株同时接种不同的苜蓿品种,或者同一苜蓿品种分别用几株菌株接种,都会出现不同的共生效果,而且彼此间差异较大[5]。国际上非常重视根瘤菌与苜蓿匹配优良组合的筛选研究,但是根瘤菌与豆科植物共生关系是细菌、植物及环境三方相互作用的结果,而不只是细菌与植物间的相互对话[3]。因此进行根瘤菌选种时必须针对种植的生态环境及寄主植物两方面因素来选择根瘤菌的最佳匹配,只考虑与寄主关系很可能是田间接种效果不稳定的主要原因。土壤特性对根瘤菌与宿主植物的结合及其生存与代谢活动有影响[6]。植物-土壤-根瘤之间存在复杂的关系,影响其共生体系稳定性的因素很多[7],只有筛选出与苜蓿品种相匹配且能够在土壤环境中大量繁殖、促生效果较好的优良根瘤菌株,才能达到提高苜蓿产量及品质的目的。
逆境胁迫可以影响豆科植物根瘤的形成、发育和根瘤菌的固氮效率[8]。高浓度的盐可以提高植物根部的渗透压,抑制根瘤呼吸及光合作用产物向根瘤的供应,使根瘤的固氮活性和植物的生长都受到不同程度的影响[9],从而在一定程度上抑制根瘤菌固氮并降低豆科植物的产量[10,11]。目前,关于不同根瘤菌菌株接种对苜蓿生长及耐盐性的影响研究鲜见报道。本研究选用5株前期试验中筛选出的与甘农9号苜蓿匹配较好的菌株,了解盐胁迫环境下,根瘤菌与苜蓿共生对其生长及抗逆性特性的影响,为优良菌株的进一步筛选及苜蓿耐盐性育种奠定基础。
1 材料与方法
1.1 试验材料
碘伏灭菌的甘农9号苜蓿种子(来自甘肃农业大学草业学院)和5株经初步筛选的与甘农9号苜蓿匹配较好的根瘤菌株Da99、Ga66、Wa32、DL58、QL31B(均由本课题组分离纯化自紫花苜蓿根部)。
1.2 试验方法
1.2.1 幼苗培养 试验于2016年3-6月在甘肃农业大学草业学院光照培养室进行。选用甘农9号苜蓿种子,在其中挑选出饱满均匀的种子,先对种子进行表面灭菌消毒,将苜蓿种子用清水洗净放入碘伏溶液(0.455%~0.55% w·v-1,德州消毒制品公司)中浸泡2min,然后用无菌水冲洗6~10次,最后将消毒好的种子50粒播种到盛有灭菌沙子的培养钵中(6.0cm×7.5cm,每杯中装沙400g)。种子萌发出苗后,每盆定植20株,转移至光照培养室,光照14h·d-1,光通量密度400μmol·m-2·s-1),昼夜温度分别为(25±1)℃,相对湿度60%。在播种第15天,给对照和每个处理均加无氮营养液200mL,Fahraeus无氮植物营养液配方参照韩梅等研究方法[12],为了减少干扰,无氮营养液仅加1次。
1.2.2 菌悬液制备及接菌 根据接种时间,将保存的根瘤菌加入无菌水制成菌液后接种到YMA斜面上进行活化扩大培养,然后转接到YMA液体培养基中, 置于转速180 r·min-1,温度28 ℃摇床中培养,测定根瘤菌悬浮液光密度值(OD600),OD600>0.5时,将全部供试菌株配制成光密度值一致为0.5的菌悬液,注入苜蓿幼苗根部。
1.2.3 盐胁迫处理及根瘤菌接种 待苜蓿苗长出第三片叶子时,将不同浓度的NaCl溶液(0、0.4%、0.8%、1.2%)40 mL 浇入培养钵内,3d后再浇一次,待溶液完全吸收后(6d左右),将菌液接种到苜蓿根部,每个培养钵接种20mL菌液,以不接种根瘤菌为空白对照,每个处理4次重复,共25个处理。
1.3 优良菌株组合筛选实验和指标测定
待幼苗生长种植60d后收获,分别测定形态指标、根瘤数及生理指标。
1.3.1 甘农9号苜蓿幼苗形态指标及根瘤数测定
(1)株高与根长 待幼苗种植60d后收获,收获时用水冲洗干净根部,在4个重复中随机选取10株苜蓿幼苗,从子叶痕处至离生长点最近的展开的叶顶端测定其株高,从子叶痕处至根尖测定根长。
(2)地上部分和地下部分鲜重及干重的测定 将幼苗收获后用水冲洗干净根部,再用滤纸将根部水分吸干,将每个重复中10株苜蓿幼苗地上部分与地下根部从第一片子叶叶痕处分开,自然条件放置使其自然风干至恒重,称取不同处理中每个重复所对应的地上部分干重和地下部分干重。
(3)将幼苗收获后用水冲洗干净根部,再用滤纸将根部水分吸干,分别在不同处理中随机取10株苜蓿幼苗,测定每个重复的有效根瘤数,呈粉红色、形态饱满。
1.3.2 甘农9号苜蓿幼苗生理指标的测定 脯氨酸含量(酸性茚三酮法)、丙二醛含量(硫代巴比妥酸法)、可溶性糖含量(蒽酮法)、可溶性蛋白含量(考马斯亮蓝G-250染色法)的测定参照王学奎[13]方法。
1.4 数据处理
1.4.1 隶属函数计算方法 采用下述公式计算各指标具体隶属值:当指标与抗性呈正相关时:F=(Xj-Xmin)/(Xmax-Xmin),当指标与抗性呈负相关时:F=1-[(X-Xmin)/(Xmax-Xmin)]。式中,F为测定指标的具体隶属函数;Xj表示某个指标的测定值;Xmin表示某一指标所有测定值中的最小值;Xmax表示某一指标所有测定值中的最大值;然后将每一指标的具体隶属值进行累加,求平均值得到该指标的隶属度。
1.4.2 本次试验采用Excel 2007进行数据整理,用SPSS 19.0统计软件进行方差分析。
2 结果与分析
2.1 不同盐浓度下不同根瘤菌株接菌对苜蓿株高的影响
接入不同苜蓿根瘤菌后对其幼苗株高均有一定程度影响,见图1。同一菌种随着盐浓度增大,苜蓿幼苗株高基本呈降低趋势。在0、1.2%盐浓度下,QL31B菌种处理下的幼苗株高与对照相比差异显著(P<0.05),分别较对照增长了18.2%、37.9%,其它菌种次之;在0.4%盐浓度下,Ga66、Wa32、DL58、QL31B菌种处理下的幼苗株高与对照相比差异显著(P<0.05),但菌株之间对株高的影响不显著;在0.8%盐浓度下,Da99、Ga66、Wa32、DL58、QL31B菌种处理下的幼苗株高与对照相比差异显著(P<0.05),菌株之间对株高的影响亦不显著(图1)。

图1 不同盐浓度下不同苜蓿根瘤菌对苜蓿幼苗株高的影响Fig.1 Effects of different rhizobia strains on height of alfalfa seedling under different NaCl concentrations
2.2 不同盐浓度下不同根瘤菌株接菌对苜蓿幼苗根长的影响
同一菌种随着盐浓度增大,苜蓿幼苗根长基本呈降低趋势。在同一盐浓度下,大部分菌株相对于对照,对根生长促进作用不显著。但菌株QL31B不同盐浓度处理下的幼苗根长与对照相比差异显著(P<0.05),且其根长分别较对照增长 7.5%、19.7%、16.2%、11.8%(图2)。
2.3 不同盐浓度下不同苜蓿根瘤菌株接菌对苜蓿幼苗地上部分干重的影响
从图3可以看出,同一菌种随着盐浓度增大,苜蓿幼苗地上部分干重基本呈降低趋势。在同一盐浓度下,经根瘤菌接菌处理后,在各个不同根瘤菌组合处理下的苜蓿幼苗地上部分干重较对照,大部分处理干重变化不大。在盐浓度为0条件下,QL31B菌种处理下的幼苗地上干重与对照相比差异显著(P<0.05),增长了32.2%;在1.2%盐浓度下,QL31B菌种处理下的幼苗地上干重与对照相比差异显著(P<0.05),增长了37.3%,Da99、Ga66、Wa32、DL58菌种处理下的幼苗地上部分干重与对照相比差异不显著。
2.4 不同盐浓度下不同苜蓿根瘤菌株接菌对苜蓿幼苗根干重的影响
同一菌种处理下,随着盐浓度增大,苜蓿幼苗地下部分干重基本呈降低趋势。在同一盐浓度下,经根瘤菌组合处理后,在各个不同根瘤菌组合处理下的苜蓿幼苗地下干重高低差异明显,但大多数处理地下部分干重差异不大。在盐浓度为0条件下,QL31B菌种处理下的幼苗地下干重与对照相比差异显著(P<0.05),增长了46.2%,Da99、Ga66、Wa32、DL58菌种处理下的幼苗地下干重与对照相比差异不显著;在0.4%盐浓度下,QL31B菌种处理下的幼苗地下干重与对照相比差异显著(P<0.05),增长了35.1%,Da99、Ga66、Wa32、DL58菌种处理下的幼苗地下干重与对照相比差异不显著;在0.8%盐浓度下,QL31B、DL58菌种处理下的幼苗地上干重与对照相比差异比较显著,增长了15.8%、11.2%;在1.2%盐浓度下,Da99、Ga66、Wa32、DL58、QL31B菌种处理下的幼苗株高与对照相比差异不显著(图4)。

图2 不同盐浓度下不同苜蓿根瘤菌对苜蓿幼苗根长的影响Fig.2 Effects of different rhizobia strains on root length of alfalfa seedling under different NaCl concentrations

图3 不同盐浓度下不同苜蓿根瘤菌对苜蓿幼苗地上部分干重的影响Fig.3 Effects of different rhizobia strains on above-ground dry weight of alfalfa seedling under different NaCl concentrations
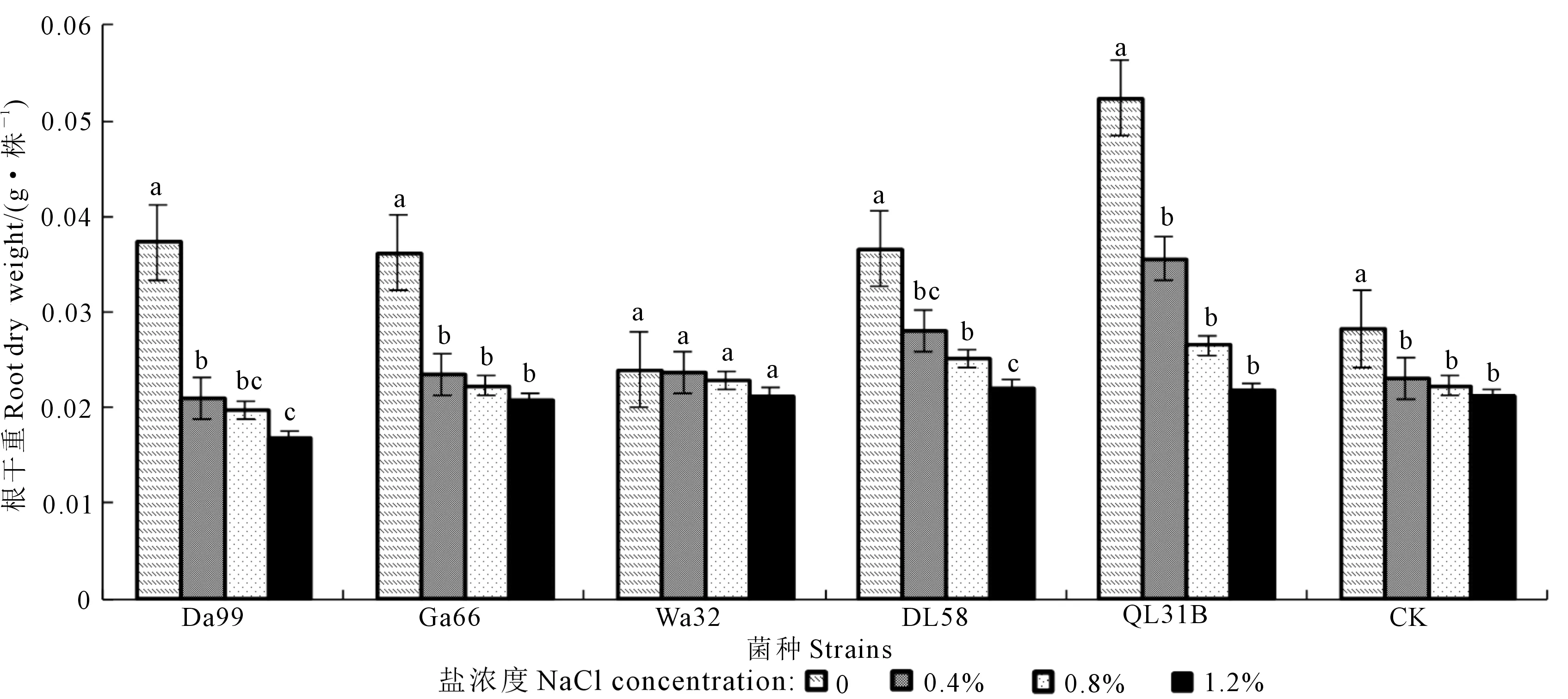
图4 不同盐浓度下不同苜蓿根瘤菌对苜蓿幼苗地下部分干重的影响Fig.4 Effects of different rhizobia strains on underground dry weight of alfalfa seedling under different NaCl concentrations
2.5 不同盐浓度下不同苜蓿根瘤菌株接菌对苜蓿幼苗结瘤数的影响
同一菌种处理下,随着盐浓度增大,苜蓿幼苗单株结瘤数基本呈降低趋势。在同一盐浓度下,各个不同根瘤菌组合处理下的苜蓿幼苗结瘤数较对照看,处理结瘤数有所增加。在盐浓度为0条件下,Da99、Ga66、QL31B菌种处理下的幼苗单株结瘤数与对照相比差异显著(P<0.05),分别增长了36.6%、44.6%、53.5%,Wa32、DL58菌种处理下的幼苗单株结瘤数与对照相比差异较显著;在0.4%盐浓度下,Ga66、QL31B菌种处理下的幼苗单株结瘤数与对照相比差异显著(P<0.05),分别增长了36.7%、52.9%,Da99、Wa32、DL58菌种处理下的幼苗单株结瘤数与对照相比差异较显著;在0.8%盐浓度下,Da99、Ga66、QL31B菌种处理下的幼苗单株结瘤数与对照相比差异显著(P<0.05),分别增长了57.5%、63%、65.8%;在1.2%盐浓度下,Da99、DL58、QL31B菌种处理下的幼苗单株结瘤数与对照相比差异显著(P<0.05),分别增长了69.8%、69.8%、81.2%,Ga66、Wa32菌种处理下的幼苗单株结瘤数与对照相比差异显著(图5)。
2.6 不同盐浓度下不同苜蓿根瘤菌株接菌对苜蓿幼苗丙二醛含量的影响
从图6可以看出,在各个不同根瘤菌组合处理下,大部分处理苜蓿幼苗丙二醛含量较对照变化不大。在盐浓度为0条件下,Da99、Wa32菌种处理下的幼苗丙二醛含量与对照相比差异显著(P<0.05),分别增长了20.8%、13.4%,DL58与对照相比丙二醛含量,下降14.6%;在0.4%盐浓度下,Da99、Wa32、DL58菌种处理下的幼苗丙二醛含量与对照相比差异显著(P<0.05),分别下降9.2%、17.7%、16.1%;在0.8%盐浓度下,Da99、Ga66、Wa32、DL58、QL31B菌种处理下的幼苗丙二醛含量与对照相比差异显著(P<0.05),分别下降18.5%、14.1%、17.5%、20.5%、5.4%;在1.2%盐浓度下,Da99、DL58菌种处理下的幼苗丙二醛含量与对照相比差异显著(P<0.05),分别增长了11.3%和5.7%。
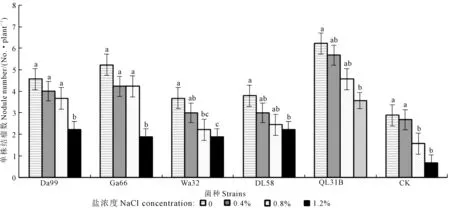
图5 不同盐浓度下不同苜蓿根瘤菌对苜蓿幼苗结瘤数的影响Fig.5 Effects of different rhizobia strains on nodule numbers of alfalfa seedling under different NaCl concentrations
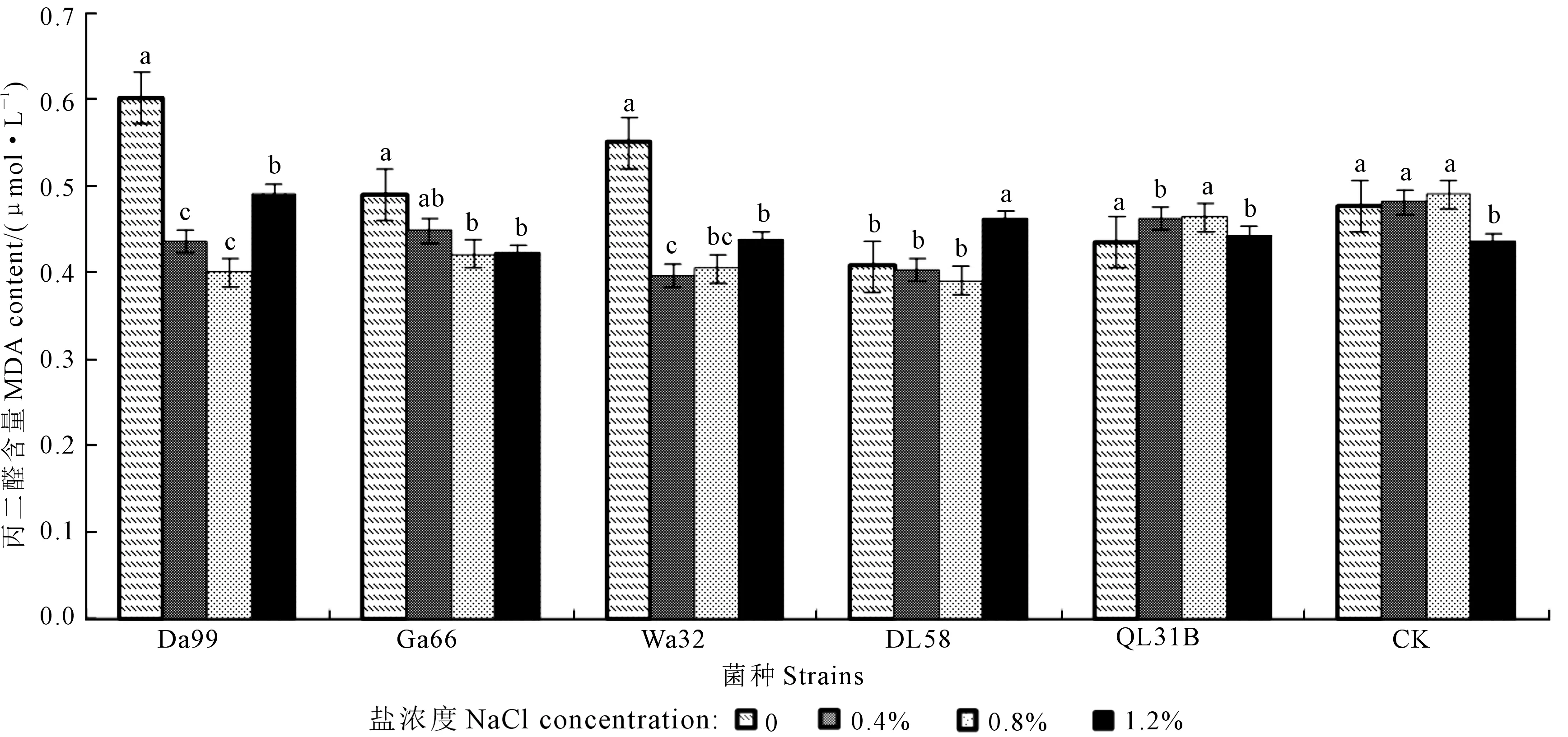
图6 不同盐浓度下不同苜蓿根瘤菌对苜蓿幼苗丙二醛含量的影响Fig.6 Effects of different rhizobia strains on MDA content of alfalfa seedling under different NaCl concentrations
2.7 不同盐浓度下不同苜蓿根瘤菌株接菌对苜蓿幼苗可溶性糖含量的影响
从图7可以看出,在各个不同组合处理下,大部分苜蓿幼苗可溶性糖含量较对照变化幅度大。在盐浓度为0条件下, Da99、Wa32菌种处理下的幼苗可溶性糖含量与对照相比差异显著(P<0.05),分别增长了38%、46.1%,DL58、QL31B与对照相比可溶性糖含量有所下降,分别下降29.5%、33.8%;在0.4%盐浓度下,Da99、Ga66、Wa32菌种处理下的幼苗可溶性糖含量与对照相比差异显著(P<0.05),分别增长了18.3%、59.2%、43.9%,DL58、QL31B与对照相比可溶性糖含量有所下降,分别下降31.3%、30.2%;在0.8%盐浓度下,Ga66菌种处理下的幼苗可溶性糖含量与对照相比差异显著(P<0.05),增长了57.5% ,Da99、Wa32、DL58、QL31B与对照相比可溶性糖含量有所下降,分别下降45.3%、20.4%、12.8%、24.5%;在1.2%盐浓度下,Da99、Wa32、DL58、QL31B菌种处理下的幼苗可溶性糖含量与对照相比有所下降(P<0.05),分别下降43%、40.4%、27.5%、36.8%。
2.8 不同盐浓度下不同苜蓿根瘤菌株接菌对苜蓿幼苗可溶性蛋白含量的影响
从图8可以看出,在各个不同组合处理下,大部分处理苜蓿幼苗可溶性蛋白含量较对照变化不大。在盐浓度为0条件下,Wa32、DL58、QL31B菌种处理下的幼苗可溶性蛋白含量与对照相比差异不显著,Da99、Ga66与对照相比可溶性蛋白含量有所下降;在0.4%盐浓度下Ga66、Wa32、DL58、QL31B菌种处理下的幼苗可溶性蛋白含量与对照相比差异显著(P<0.05),分别增长了8.5%、9.7%、7.5%、10.2%,Da99菌种处理下的幼苗可溶性蛋白含量与对照差异不显著;在0.8%盐浓度下,Da99、Ga66、Wa32、DL58、QL31B菌种处理下的幼苗可溶性蛋白含量与对照相比差异显著(P<0.05),分别增长了33.8%、36.6%、37.1%、15.8%、37.9%;在1.2%盐浓度下,Da99、Ga66、Wa32、DL58、QL31B菌种处理下的幼苗可溶性蛋白含量与对照相比差异显著(P<0.05),分别增长了29.1%、30.2%、27.1%、31.1%、33.1%。
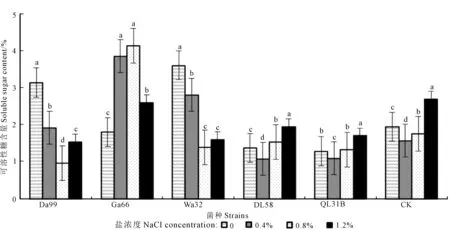
图7 不同盐浓度下不同苜蓿根瘤菌对苜蓿幼苗可溶性糖含量的影响Fig.7 Effects of different rhizobia strains on soluble sugar content of alfalfa seedling under different NaCl concentration

图8 不同盐浓度下不同苜蓿根瘤菌对苜蓿幼苗可溶性蛋白含量的影响Fig.8 Effects of different rhizobia strains on soluble protein content of alfalfa seedling under different NaCl concentrations
2.9 不同盐浓度下不同苜蓿根瘤菌株接菌对苜蓿幼苗脯氨酸含量的影响
从图9可以看出,在盐浓度为0条件下,Da99、Ga66、Wa32、DL58、QL31B菌种处理下的幼苗脯氨酸含量与对照差异显著(P<0.05),分别增长了50%、28.1%、23.9%、4.7%、15.7%;在0.4%盐浓度下Da99、Ga66、Wa32、QL31B菌种处理下的幼苗脯氨酸含量与对照相比差异显著(P<0.05),分别增长了41.2%、58.6%、8.7%、26.2%;在0.8%盐浓度下,Da99、Ga66、Wa32、DL58、QL31B菌种处理下的幼苗脯氨酸含量与对照相比差异显著(P<0.05),分别增长了35.1%、43%、37.5%、29.6%、15.8%;在1.2%盐浓度下,Da99、Ga66、Wa32、DL58、QL31B菌种处理下的幼苗脯氨酸含量与对照相比差异显著(P<0.05),分别增长了66.2%、37.5%、40.1%、15.3%、23%。
2.10 盐胁迫下不同菌株对苜蓿生长及生理特性影响的隶属函数综合分析
由表1可以看出,同一菌株在不同盐浓度处理下,所有菌株平均隶属函数值大于对照,尤其是菌株QL31B,隶属函数值较对照提高了68.76%,其次为菌株Ga66,较对照提高了63.93%。在同一含盐量水平下,所有菌株均不同程度提高了苜蓿的生长及生理特性,尤其是在盐浓度为 0.8% 及1.2% 时所有菌株都能明显促进苜蓿的生长及耐盐性的提高。
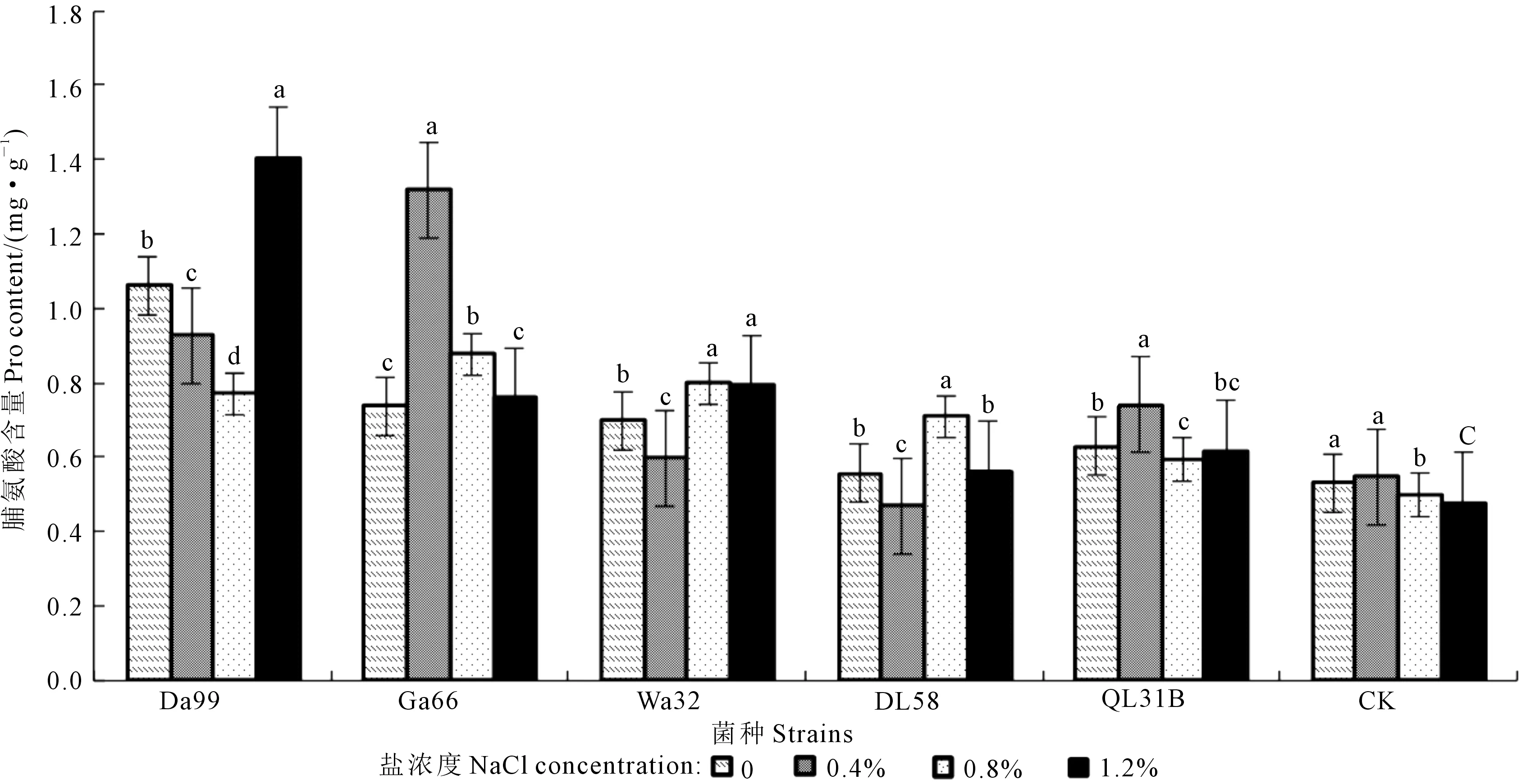
图9 不同盐浓度下不同苜蓿根瘤菌对苜蓿幼苗脯氨酸含量的影响Fig.9 Effects of different rhizobia strains on Pro content of alfalfa seedling under different NaCl concentration
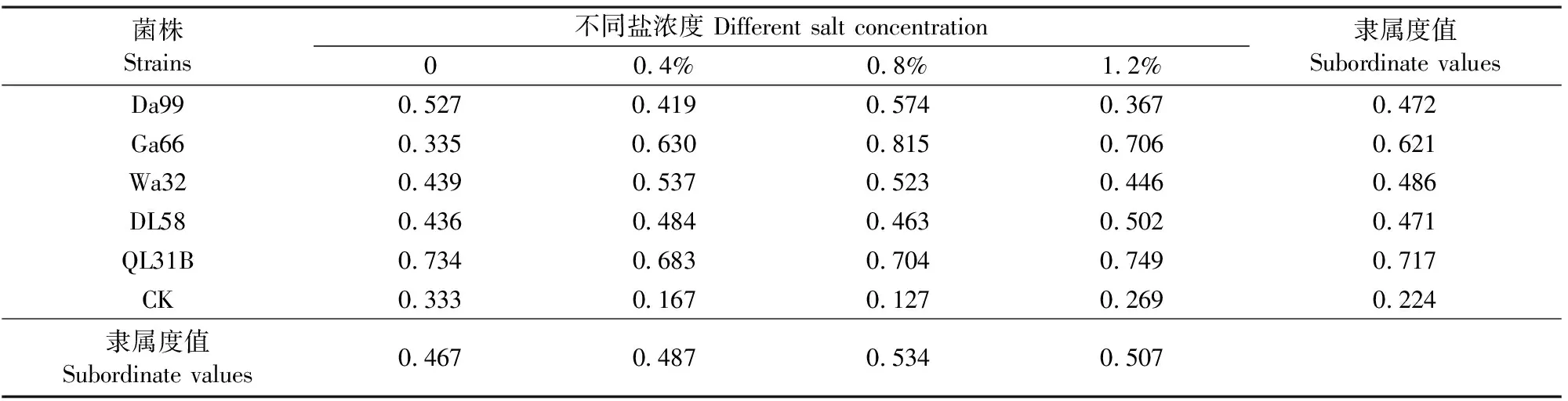
菌株Strains不同盐浓度 Different salt concentration00.4%0.8%1.2%隶属度值Subordinate valuesDa990.5270.4190.5740.3670.472Ga660.3350.6300.8150.7060.621Wa320.4390.5370.5230.4460.486DL580.4360.4840.4630.5020.471QL31B0.7340.6830.7040.7490.717CK0.3330.1670.1270.2690.224隶属度值Subordinate values0.4670.4870.5340.507
3 讨 论
3.1 不同盐浓度下不同苜蓿根瘤菌株接菌对其幼苗形态特征的影响
有研究表明,接种处理苜蓿幼苗的生长速度接近全氮处理,而且在荒漠和干旱、贫瘠的土地上人工接种根瘤菌可有效地提高幼苗成活率和生长速度[14]。本研究发现,盐胁迫下不同苜蓿根瘤菌株接菌对苜蓿的株高、根长、地上生物量、地下生物量以及单株结瘤数等指标都产生了一定的影响,较对照都有明显的提高,且不同菌株对苜蓿形态指标的影响差异显著。这说明苜蓿形态特征的变化能初步反映出胁迫环境下根瘤菌对其生长特性的影响,也就是说根瘤菌接菌能降低胁迫环境对宿主植物造成的伤害,豆科-根瘤菌共生体系在非生物胁迫环境下,根瘤菌可以通过固氮,提供给豆科植物细胞和组织的生长发育所需要的氮素营养[15],因而有效地促进豆科植物生长发育。研究亦发现植株根瘤差别较大,有的植株根瘤数目很多,但根瘤比较小。Abdel Wahab A M等[16]研究表明,高盐浓度(120mmol NaCl)对根瘤菌数量影响较大,而较低水平的盐度对根瘤菌数量影响不大,这与本研究结果一致。
3.2 不同盐浓度下不同苜蓿根瘤菌株接菌对苜蓿幼苗生理特性的影响
可溶性糖是一种渗透调节物质,在逆境胁迫下,植物可溶性糖含量积累增加,表明其抗性增强[17]。丙二醛是脂质过氧化作用的产物,含量越高,表明植物抗性越低[17]。在正常情况下,植物体内脯氨酸含量很低,在盐胁迫等逆境条件下,脯氨酸含量增加,表明其抗性增强[18]。植物体内蛋白质含量与盐浓度呈正相关,非生物胁迫环境可以引发许多植物的生理生化变化[19]。豆科植物接种根瘤菌后,改善植物生长状况的同时,还能增强植株的抗逆性。根瘤菌通过影响苜蓿植株的内在变化来影响苜蓿植株对盐胁迫的抗性[14]。根瘤菌对豆科植物在非生物胁迫下的生理反应确有积极作用。本研究发现甘农9号苜蓿接种根瘤菌后,在未进行胁迫处理下,通过固氮作用促进其生长,接菌且盐胁迫环境下,根瘤菌-苜蓿共生系统协同作用,通过对植物自身生长特性及生理应答机制的调控来达到降低胁迫的危害。在同一盐浓度下,接种根瘤菌的甘农9号苜蓿其可溶性糖、脯氨酸含量相比对照有所增加,而丙二醛含量较之对照基本都减少,可溶性蛋白含量与对照相比基本处于一个稳定的状态,说明接种根瘤菌的苜蓿能更好地维持细胞的稳定性,减少脂质过氧化作用对细胞膜的损害,提高苜蓿的抗盐性,这与杨培志[20]的研究结果一致。苜蓿接种根瘤菌后被激活,具有较强的抗氧化和渗透调节能力[21-22],因而其耐盐能力提高,而且不同菌株调节植株生理变化的能力不同,这与菌株本身及苜蓿接种根瘤菌后形成的共生体耐盐性可能发生变化有关。
3.3 盐胁迫下不同根瘤菌株对甘农9号苜蓿生长及生理特性影响的综合评价
逆境胁迫下,植物的不同性状发生不同程度的变化,凭借单一的指标有时很难准确地评价植物整体抗逆性。将模糊数学中隶属函数评判法应用到植物抗胁迫能力的综合评价中,可以准确地反映植物的抗逆性特征[23]。本研究经隶属函数综合评价发现,在未进行胁迫处理下,所有根瘤菌并不能使同一品种甘农9号苜蓿获得同样的接种效果,这说明不同根瘤菌由于本身遗传背景的不同,导致其与苜蓿匹配效果差异显著。但是在胁迫环境下,所有接菌后的苜蓿相比对照(未接菌)而言都具有较高的隶属度值,说明苜蓿接菌对促进其生长及抗性有很强的作用。尤其要提到的是QL31B菌株,和其它菌株相比,在任何盐浓度胁迫下均能明显地促进其生长及提高苜蓿的抗盐性,且随着盐浓度的增大,其作用效果越明显,这可能与该菌株本身具有优良的促生及抗性基因有关,而且也可以说明该菌株的共生基因与宿主植物有较高的相关性。这些研究结果表明对苜蓿接种根瘤菌是十分必要的,尤其在贫瘠、干旱及盐碱化区域种植紫花苜蓿并接种根瘤菌意义重大。这为下一步对该菌株与甘农9号苜蓿共生关系的进一步深入研究奠定了基础。
4 小 结
1)根瘤菌接菌对甘农9号苜蓿生长具有一定的促进作用,但是不同菌株对同一苜蓿品种促生效果明显不同。
2)盐胁迫下,所有菌株均能通过对苜蓿形态及生理特性的调控来提高苜蓿的抗盐性,但是不同菌株提高苜蓿耐盐程度不一。在不同盐浓度下,所有菌株对苜蓿抗盐性影响的能力为QL31B>Ga66>Wa32>Da99>DL58。
3)大部分菌株在低盐水平(0、0.4%)对苜蓿促生效果及耐盐性提高程度不及高盐水平(0.8%和1.2%),5个菌株(Ga66、Da99、Wa32、DL58及QL31B)在0.8%盐水平下对苜蓿生长及耐盐性都有很好的作用。经过综合评价,所有菌株中QL31B与苜蓿匹配效果最佳,其次为Ga66。
参考文献:
[1] 杨青川,韩建国.RAPD技术在苜蓿耐盐遗传育种中的应用[J].草地学报,2003,11(1):27-32.
[2] 陈利云. 盐渍地紫花苜蓿根瘤菌研究[D]. 兰州:兰州大学,2009.
[3] 陈文新,汪恩涛,陈文峰.根瘤菌-豆科植物共生多样性与地理环境的关系[J].中国农业科学,2004,37(1):81-86.
[4] 窦新田,程恒昌,李树藩,等. 大豆根瘤菌(Bradyrhizobiumjaponicuum)在黑龙江省接种效果与接种有效性的研究[J].中国农业科学,1989,22(5):62-70.
[5] 马晓彤.苜蓿根瘤菌与苜蓿品种共生匹配优良组合筛选的研究[D]. 北京:中国农业科学院,2009.
[6] Han L L,Wang E T,Han T X. Unique community structure and biogeography of soybean rhizobia in the saline-alkaline soils of Xinjiang, China [J]. Plant Soil,2009,324(1): 291-305.
[7] Moran J, Fbecana M, Iturbe-Ormaetxel, et al. Drought induces oxidative stress in pea plants [J]. Planta,1994,194 ( 3 ) : 346-352.
[8] Sprent J I. Effects of water stress on nitrogen fixation in root nodules[J]. Plant and Soil,1971,35(1): 225-228.
[9] Swaraj K, Bishnoi N R. Effect of salt stress on nodulation and nitrogen fixation in legumes [J]. Indian Journal of Experimental Biology,1999,37(9):843-848.
[10] Ashraf M,Iram A. Drought stress induced changes in some organic substances in nodules and other plant parts of two potential legumes differing in salt tolerance [J]. Flora,2005,200(6):535-546.
[11] Clement M,Lambert A,Herouart D,et al. Identification of new up-regulated genes under drought stress in soybean nodules[ J]. Gene,2008,426 ( 1-2 ) :15-22.
[12] 韩 梅,王 卓,韩晓日.1株高效花生根瘤菌的筛选与鉴定[J].微生物学杂志,2013,33(1):44-47.
[13] 王学奎.植物生理生化实验原理和技术[M].北京:高等教育出版社,2006.
[14] 王 华.沙冬青与根瘤菌和丛枝菌根真菌共生关系影响因素的研究[D].北京:北京林业大学,2008.
[15] Sprent J I. The effects of water stress on nitrogen-fixing root nodules[J]. New Phytologist,1972,70(3): 9-17.
[16] Abdel Wabab A M,Shabcb M S A,Younis M A M. Studies on the effect of salinity,drought stress and soil type on nodule activities ofLablabpurpurcus(L.) sweet(Kasbrangeeg)[J].Journal of Arid Environments,2002,5l(4):587-602.
[17] 王智明,张峰举,许 兴. 植物耐盐生理生化指标研究进展[J]. 湖北农业科学,2014,53(7):1493-1496.
[18] 陈爱萍,王玉祥,张 博. NaCl胁迫对6个苜蓿品种的部分生理指标的影响[J]. 新疆农业大学学报,2011,34(5):403-406.
[19] 刘晶,才华,刘莹,等. 两种紫花苜蓿苗期耐盐生理特性的初步研究及其耐盐性比较[J].草业学报,2013,22(2):250-256.
[20] 杨培志. 紫花苜蓿根瘤菌共生对干旱及盐胁迫的响应机制研究[D].杨凌:西北农林科技大学,2012.
[21] 王卫栋,杨培志,张 攀,等.共生根瘤菌对 NaCl 胁迫下紫花苜蓿抗氧化和渗透调节能力的影响[J].草业学报,2013,22(5):120-127.
[22] 王雪翠,马晓彤,韩 梅,等.青海箭筈豌豆根瘤菌的筛选及其共生体耐盐性研究[J].草业学报,2016,25(8):145-153.
[23] 谢贤健,兰代萍,白景文. 三种野生岩生草本植物的抗旱性综合评价[J].草业学报,2009,18(4):75-80.

