急性症状性颈动脉狭窄患者斑块特征与微栓子信号的相关性研究
杨 梅, 居克举, 仲玲玲, 孙 波, 曹 化, 丁涟沭
1990年,Spencer等人[1]在颈内动脉剥脱术患者的监测中发现相应大脑中动脉区出现微栓子信号(microemboli signal,MES),推测其可能为斑块脱落物、微小血栓或血小板聚集物,且术中MES的出现与术后卒中的发生有一定的联系,这一发现为动脉栓塞性卒中发病机制提供了现实依据,1995年第九次国际脑血流动力学研讨会共识委员会发布了MES的识别标准[2],为MES临床应用打下基础,近年的研究发现,MES阳性与不规则不均匀的斑块特征相关[3],本研究旨在分析颈动脉狭窄患者斑块的超声学特征与相应大脑中动脉区MES的联系,进一步探讨MES监测的临床应用价值。
1 研究对象和方法
1.1 研究对象 为2016年3月-2017年12月期间连续住院患者,纳入标准:症状性颈动脉狭窄(symptomatic carotid artery stenosis,SCAS)组52例:(1)发病3 d内的急性梗死或短暂性脑缺血发作患者;(2)入院前3 d或入院后3 d内对比增强磁共振血管成像(Contrast-enhanced magnetic resonance angiograph,CE-MRA)显示相应颈总动脉或颈内动脉大于等于30%狭窄,诊断急性梗死患者须有磁共振弥散加权成像(Diffusion Weighted Imaging,DWI)显示相应动脉区高信号。非症状性颈动脉狭窄(asymptomatic carotid artery stenosis,ACAS)组75例:(1)同期入院的非急性梗死及短暂性脑缺血患者;(2)入院前3 d或入院后3 d内CE-MRA显示相应颈总动脉或颈内动脉大于等于30%狭窄。排除标准:(1)CE-MRA或CTA等检查有明确的颈内动脉虹吸段或大脑中动脉狭窄大于50%;(2)有明确的脑栓塞、心房纤颤、房间隔缺损、瓣膜置换手术史等心源性栓子来源者;(3)病变同侧颞窗显示不清无法进行有效的栓子监测;(4)患者或其家属不同意不配合监测。
1.2 研究方法
1.2.1 颈动脉狭窄率的测定 所有病例在入院前后3 d内完成CE-MRA及头部T1、T2、DWI序列成像,选择CE-MRA狭窄最严重的投射角度进行测量,以(狭窄远端正常血管的内径-狭窄处的血管内径)/狭窄远端正常血管的内径)×100%计算血管的狭窄率,多处狭窄的患者以狭窄最严重的部分作为该血管的狭窄率。
1.2.2 斑块特征的判断 患者入院5 d内完成颈动脉彩超检测,颈动脉彩超采用飞利浦IE ELITE彩色超声检测仪,L9-3 MHz及C5-1 MHz探头,分别进行纵向和横向探测颈总动脉、颈动脉球部及颈内动脉起始部,根据斑块的声像学特征、表面性状是否有管腔血流进入及腔内血栓将其分为3个等级:Ⅰ等回声强回声或钙化斑块;Ⅱ混合回声及低回声斑块;Ⅲ溃疡型或合并腔内血栓的斑块,存在多个斑块的以最高级别分类。
1.2.3 微栓子监测 微栓子测定采用Viasys sonar Digital TCD检测仪(高级监护型)进行检测,在病例入组2 d内完成,先行常规颈部及颅内血管TCD检查,明确血流动力学状态,进一步排除颞窗显示不良或同侧大脑中动脉狭窄影响血流动力学状态者(收缩期血流速度>140 cm/s 或平均血流速度>80 cm/s),然后选择监护模式并勾选微栓子监测,头架固定2 MHz探头,选择50~60 mm深度的同侧大脑中动脉为目标血管,采样容积5~10 mm,以压颈试验进一步确定为同侧大脑中动脉,平静呼吸2 min,待血流频谱速度较为稳定后监测30 min,微栓子信号的判定采用计算机自动识别结合人工识别,遵循1995年国际MES专家联盟确定了微栓子信号的诊断标准[2]:(1)有别于血流声音的特征性声音;(2)与血流频谱方向相同的单相信号;(3)短时程、持续时间小于300 ms;(4)信号强度比背景信号强3 dB以上。
1.3 统计学分析 统计学分析采用SPSS 22.0软件进行,计数资料采用χ2检验,计量资料采用t检验,两种资料相关采用Pearson相关分析。
2 结 果
2.1 在一般情况的比较方面,SCAS和ACAS组患者在年龄、性别、吸烟、饮酒、合并症等方面无显著性差异,症状性颈动脉狭窄组低密度脂蛋白水平偏高,但统计学差异不明显(P>0.05,见表1)。在狭窄率和斑块特征方面,SCAS组大于70%狭窄率患者较多(P<0.05,见表2),SCAS组Ⅲ级斑块明显偏多,而Ⅰ级斑块相应较少,具有统计学差异(P<0.05,见表2)。在微栓子检测方面,SCAS组阳性率显著高于ACAS组(P<0.01),狭窄率大于70%的病例高于狭窄率小于70%的病例(P<0.05);Ⅲ级斑块患者的MES阳性率显著高于其他类型(P<0.05),且斑块的等级与MES阳性呈正相关(r=0.227,P=0.010)(见表3)。
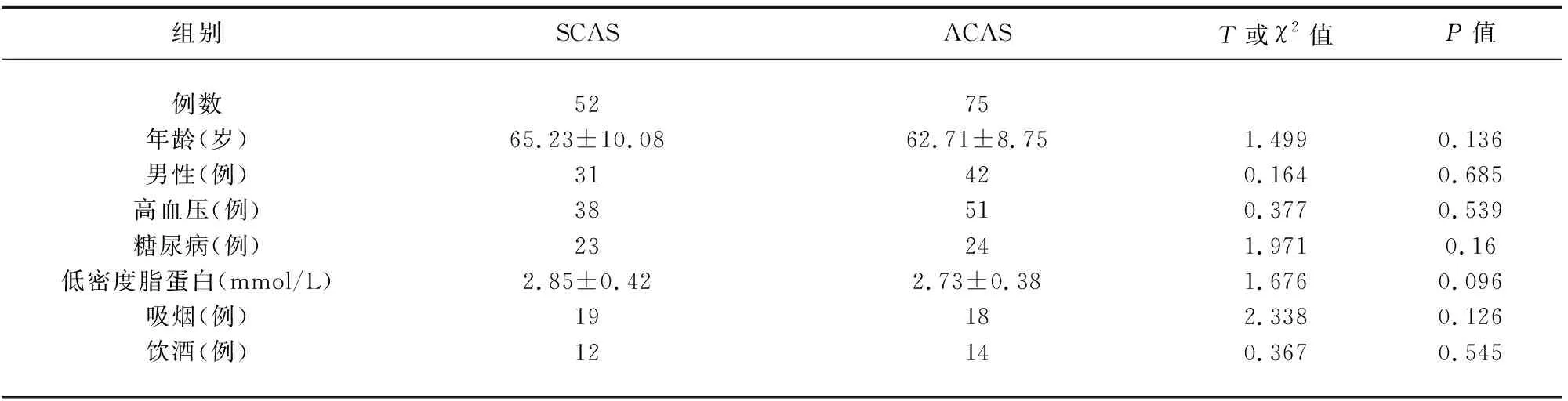
表1 两组患者的一般情况比较
3 讨 论
微栓子监测是利用血流中微栓子与红细胞对超声信号反射差异来识别混杂在血流中其他物质,这类物质可以是血液凝块、血小板聚集物、动脉粥样硬化斑块颗粒,也可以是脂肪、空气等不同于红细胞的物质。颈动脉狭窄是缺血性卒中发生的独立危险因素[4],颈动脉粥样硬化斑块形成后,一方面是由于管腔狭窄导致相应动脉区血流灌注的不足;另一方面,狭窄段斑块成分的脱落、溃疡面形成及斑块内组织的暴露导致局部形成血小板聚集物、血凝块,这些物质的脱落是发生动脉-动脉栓塞的重要机制,TCD可以有效的监测到这些物质,这些物质较小的部分可能通过毛细血管或为机体清除,或者形成远端微小血管堵塞,但由于侧支循环的代偿,并不会形成影像学的梗死灶或临床症状,较大的部分,可能形成亚临床病灶,在磁共振DWI上显示高信号改变[5],这种栓子信号的出现,与不稳定的斑块特性相吻合[6],也与卒中复发和死亡率增高显著相关[7]。

表2 两组颈动脉狭窄率及斑块特征
*P<0.05
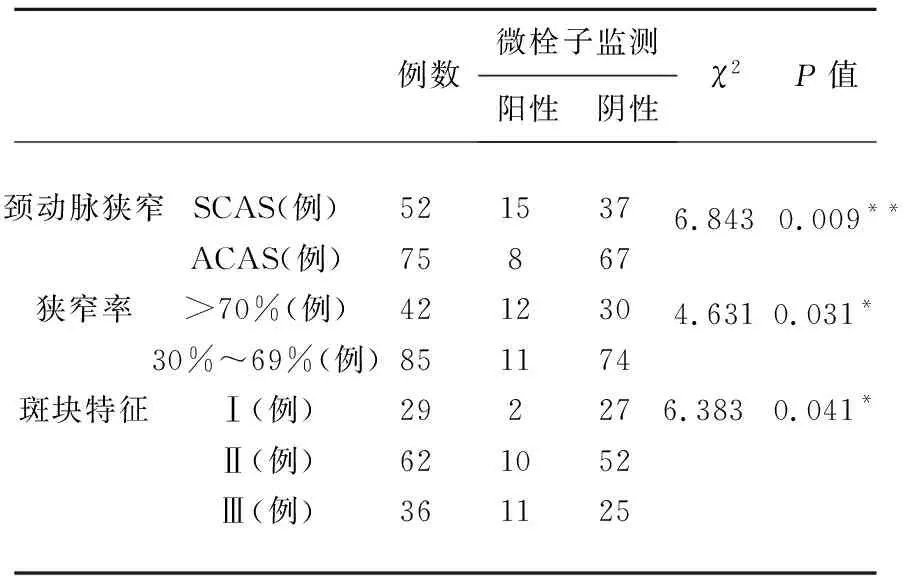
表3 MES与狭窄率及斑块特征的关系
*P<0.05,**P<0.01
本研究显示,SCAS患者的颈动脉狭窄率显著高于ACAS患者,并且其颈动脉斑块以Ⅱ、Ⅲ斑块较为多见,这类斑块又称不稳定斑块,是动脉-动脉栓塞性卒中发生的重要原因。Van等[6]通过MES监测及剥脱内膜的组织学相关性研究发现,MES的出现与不稳定的斑块组成、斑块表型及腔内血栓形成相吻合,为微栓子来源于斑块的学说提供有力的证据;Muller等[8]研究发现通过18 fdg- PET-CT检测的高危颈动脉斑块与MES具有强相关性。本研究同样发现,斑块的不稳定性与MES的出现呈正相关,溃疡型或有腔内血栓形成斑块的患者,MES阳性率显著高于其他斑块患者,高度狭窄的病例相应动脉区MES阳性率较高,一方面是因为这类患者有较高的不稳定斑块发生率;另一方面也可能和血流灌注的下降,栓子清除能力降低有关[3]。
MES监测的临床应用,为颈动脉斑块稳定性的评估提供了新的手段, 也为卒中急性期的疗效评估提供了依据。Kinsella等[9]研究表明症状性颈动脉狭窄患者早期血小板活化,其淋巴细胞血小板复合物增多,与MES相关。Forteza[10]发现微栓子阳性的平均发病时间是4 d,而阴性的是12 d,也提示MES的出现与斑块破溃后的早期局部血小板活化有关,而这种活化随着时间的延长而减弱,也与临床进展性卒中的病程相吻合。临床经验表明,即使在有效的抗血小板稳定斑块治疗的前提下,斑块的形态学或声像学特征也很难在短期内发生改变,因此动态的栓子检测对病情的评估显得尤其重要。动物模型[11]及MES的临床研究[12]均证明,MES信号的减少或消失可以作为有效抗血小板治疗的标志,其对阿司匹林抵抗的早期识别可能具有重要意义[13]。
综上所述,MES信号的出现与症状性颈动脉狭窄患者的斑块的不稳定性相关,可以作为不稳定颈动脉斑块的特征之一,应用于临床,对于抗血小板及抗动脉硬化稳定斑块的疗效评估具有重要的价值。
[参考文献]
[1]Spencer MP,Thomas GI,Nicholls SC,et al.Detection of middle cerebral artery emboli during carotid endarterectomy using transcranial Doppler ultrasonography[J].Stroke,1990,21(3):415-423.
[2]Consensus Committee of the Ninth International Cerebral Hemodynamic Symposium.Basic identification criteria of Doppler microembolic signals[J].Stroke,1995,26(6):1123.
[3]Zhang C,Qu S,Li H,et al.Microembolic signals and carotid plaque characteristics in patients with asymptomatic carotid stenosis[J].J Scand Cardiovasc,2009,43(5):345-351.
[4]Alagoz AN,Acar BA,Acar T,et al.Relationship between carotid stenosis and infarct volume in ischemic stroke patients[J].Med Sci Monit,2016,22:4954-4959.
[5]Cho JH,Kang DH,Kim YW,et al.Microembolic signal monitoring and the prediction of thromboembolic events following coil embolization of unruptured intracranial aneurysms:diffusion-weighted imaging correlation[J].Neuroradiology,2015,57(2):189-196.
[6]Van Lammeren GW,Van De Mortel RH,Visscher M,et al.Spontaneous preoperative microembolic signals detected with transcranial Doppler are associated with vulnerable carotid plaque characteristics[J].J Cardiovasc Surg (Torino),2014,55(3):375-380.
[7]Jiang J,Jiang Y,Feng S,et al.Microembolic signal monitoring of TOAST classified cerebral infarction patients[J].Mol Med Rep,2013,8(4):1135-1142.
[8]Muller HF,Viaccoz A,Fisch L,et al.18FDG-PET-CT:an imaging biomarker of high-risk carotid plaques.Correlation to symptoms and microembolic signals[J].Stroke,2014,45(12):3561-3566.
[9]Kinsella JA,Tobin WO,Tierney S,et al.Increased platelet activation in early symptomatic vs.asymptomatic carotid stenosis and relationship with microembolic status: results from the Platelets and Carotid Stenosis Study[J].J Thromb Haemost,2013,11(7):1407-1416.
[10]Forteza AM,Babikian VL,Hyde C,et al.Effect of time and cerebrovascular symptoms of the prevalence of microembolic signals in patients with cervical carotid stenosis[J].Stroke,1996,27(4):687-690.
[11]Zhou X,Kurowski S,Wu W,et al.A rabbit model of cerebral microembolic signals for translational research:preclinical validation for aspirin and clopidogrel[J].Journal of Thrombosis & Haemostasis,2016,9(14):1855-1866.
[12]Kerasnoudis A,Meves SH,Gold R,et al.Correlation between frequency of microembolic signals and efficacy of antiplatelet therapy in symptomatic carotid disease[J].J Neuroimaging,2013,23(4):484-488.
[13]Dawson J,Quinn T,Lees KR,et al.Microembolic signals and aspirin resistance in patients with carotid stenosis[J].Cardiovasc Ther,2012,30(4):234-239.

