七项自身抗体在肺癌诊断中的应用
徐思璞,乔金平,费广鹤
肺癌是世界上最常见的癌症之一,近年来患病率持续升高[1]。肺癌的诊断,从依据细胞学和组织病理检查到检测血清中的单个肿瘤标志物,再到肿瘤标志物的联合检测,敏感性和特异性得到提高[2]。对于肺癌的早期诊断,自身抗体的敏感性和特异性已引起重视。血清中抑癌基因p53(tumor protien 53,p53)和抗p53抗体与癌症风险的增加密切相关,并且可以作为恶性肿瘤早期诊断的血清学标志物[3],通过使用ELISA法检测血清p53(S-p53)基因的改变,证实S-p53基因可作为无症状、高风险群体的常规筛查标志物[4-5]。肺癌中蛋白基因产物9.5(protein gene product 9.5,PGP9.5)的表达可能在人类肺上皮细胞的致癌转化中起到一个因果作用[6]。SOX2(SRY-box containing gere 2)的表达与小细胞肺癌的分期和增殖密切相关,支持了SOX2是真正的小细胞肺癌驱动基因的设想[7]。G抗原7(G antigen 7,GAGE7)在多种癌症中广泛表达,表明其在肿瘤发生中起作用,高水平的GAGE7表达在鳞状细胞癌中更常见[8-9]。肿瘤抗原(GBU4-5)具有的免疫原性、癌症特异性的,可能为癌症的诊断和治疗提供潜在的靶标[10]。黑色素瘤抗原(melanoma antigen, MAGE)在黑素瘤、胃癌、结肠癌、肝细胞癌和非小细胞肺癌中都发现了MAGE-A1和-A3的表达;由MAGE启动子去甲基化介导的MAGE表达与非小细胞肺癌的侵袭性进展密切相关[11]。人癌抗原(cancer antigen,CAGE)能在胃癌、胰腺癌和一部分肺癌中诱导自身抗体的应答[10]。该文通过使用受试者工作特征曲线(receiver operating characteristic curve, ROC)分析评价p53、PGP9.5、SOX2、GAGE7、GBU4-5、MAGEA1、CAGE等七项自身抗体单独和联合检测对肺癌的诊断的敏感性和特异性,并对受试者进行了不同的组合分类,探讨这些自身抗体对肺癌辅助诊断的应用价值。
1 材料与方法
1.1病例资料收集2017年1~4月期间就诊于安徽医科大学第一附属医院病例122例,男59例,女63例,年龄32~85(62.8±10.6)岁。将受试者分为肺外肿瘤组、肺部良性病变组、小细胞肺癌组、非小细胞肺癌组、体检组。其中肺外肿瘤65例,男29例,女36例,年龄55~79(66.0±7.3)岁。肺部良性病变20例,男11例,女9例,年龄32~81(58.0±13.0)岁;小细胞肺癌3例,男1例,女2例,年龄58~78(67.0±10.1)岁;体检20例,男10例,女10例,年龄40~75(53.5±9.9)岁;非小细胞肺癌14例,男8例,女6例,年龄48~85(67.4±11.7)岁。
1.2标本采集与检测采集患者空腹晨血3 ml,离心后使用ELISA试剂盒(杭州凯保罗生物科技有限公司),参照说明书进行检测。七项自身抗体阳性参考值分别为:p53>13.1 U/ml, PGP9.5>11.1 U/ml,SOX2>10.3 U/ml, GAGE7>14.4 U/ml, GBU4-5>7 U/ml, MAGEA1>11.9 U/ml, CAGE>7.3 U/ml。

2 结果
2.1不同类型的受试者者血清七项自身抗体水平测定良性病变组和体检组的自身抗体浓度均较低,各癌变组的自身抗体浓度有不同程度的增高,经两两比较可得,小细胞癌组的p53、SOX2、GBU4-5、MAGEA1自身抗体:与体检组、肺外肿瘤、肺部良性病变组相比较,差异均有显著性(P<0.05)。见表1。
2.2肺癌组和其他组七项自身抗体的ROC曲线p53的AUC>0.5,且P<0.05,提示p53自身抗体对肺癌组(非小细胞肺癌组、小细胞肺癌组)和其他组(体检组、肺外肿瘤组、肺部良性病变组)差异有显著性(AUC>0.5,P<0.05)。见图1。
2.3肺部病变组和其他组七项自身抗体的ROC曲线单个自身抗体的AUC<0.5,七项联合检测的AUC稍大于0.5,诊断价值较低,即表示本组分类的差异无统计学意义,见图2。
2.4非恶性肿瘤组和肿瘤组七项自身抗体的ROC曲线GBU4-5的AUC=0.639,七项联合检测的AUC=0.635,介于0.5~0.7之间,有一定的诊断价值,故 GBU4-5及七项联合检测对本组分类的差异有统计学意义(P<0.05), 见图3。

图1 肺癌组和其他组七项自身抗体的ROC曲线

图2 肺部病变组和其他组的ROC曲线

组别p53PGP9.5SOX2GAGE7GBU4-5MAGEA1CAGE体检1.2±0.7∗4.3±1.92.9±2.8∗3.7±3.21.3±1.5∗0.9±1.0∗0.9±0.4肺外肿瘤2.9±6.3∗12.3±32.910.3±22.0∗4.0±6.84.2±8.0∗0.7±1.5∗1.6±3.3肺部良性病变0.9±1.0∗4.1±5.62.5±3.6∗3.7±5.50.7±1.1∗0.7±1.1∗1.0±1.8非小细胞肺癌2.8±3.5∗10.9±30.4∗8.0±19.1∗3.0±3.85.5±9.7∗0.5±0.6∗2.3±4.5小细胞肺癌20.3±22.337.0±52.133.2±37.28.3±10.620.9±17.89.4±14.23.5±2.4F值8.21.32.50.56.010.90.9
与小细胞肺癌组比较:*P<0.05
2.5小细胞肺癌组和其他组七项自身抗体的ROC曲线MAGEA1、CAGE、PGP9.5、SOX2、七项联合检测的AUC均>0.5,故均有诊断价值(AUC>0.5,P<0.05),其诊断价值排序为MAGEA1> CAGE>PGP9.5=SOX2>七项联合检测,见图4。
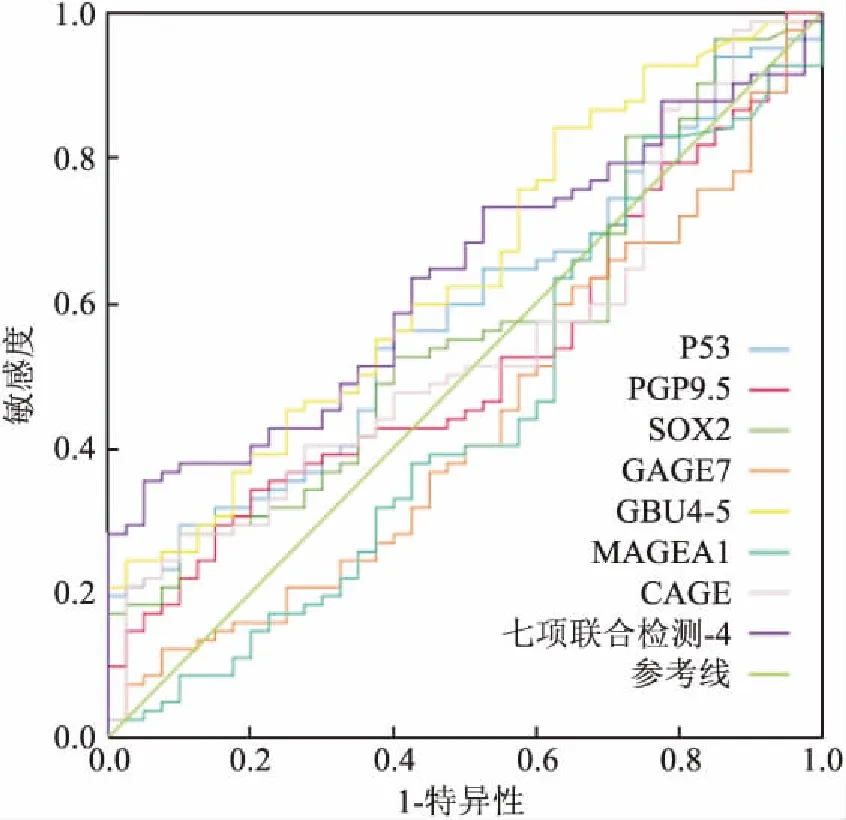
图3 非恶性肿瘤组和肿瘤组七项自身抗体的ROC曲线

图4 小细胞肺癌组和其他组七项自身抗体的ROC曲线
2.6非小细胞肺癌组和其他组七项自身抗体的ROC曲线仅p53和七项联合检测的AUC>0.5,但P>0.05,小细胞肺癌组和其他组(体检组、肺外肿瘤、肺部良性病变、非小细胞肺癌组)的七项自身抗体差异无显著性,见图5。
2.7肺外肿瘤组和其他组七项自身抗体的ROC曲线仅七项联合检测的AUC>0.5,且P<0.05,肺外肿瘤组和其他组(体检、肺部良性病变、非小细胞肺癌组、小细胞肺癌)单独检测七项自身抗体无显著差异,七项联合检测差异有显著性(AUC>0.5,P<0.05)。见图6。
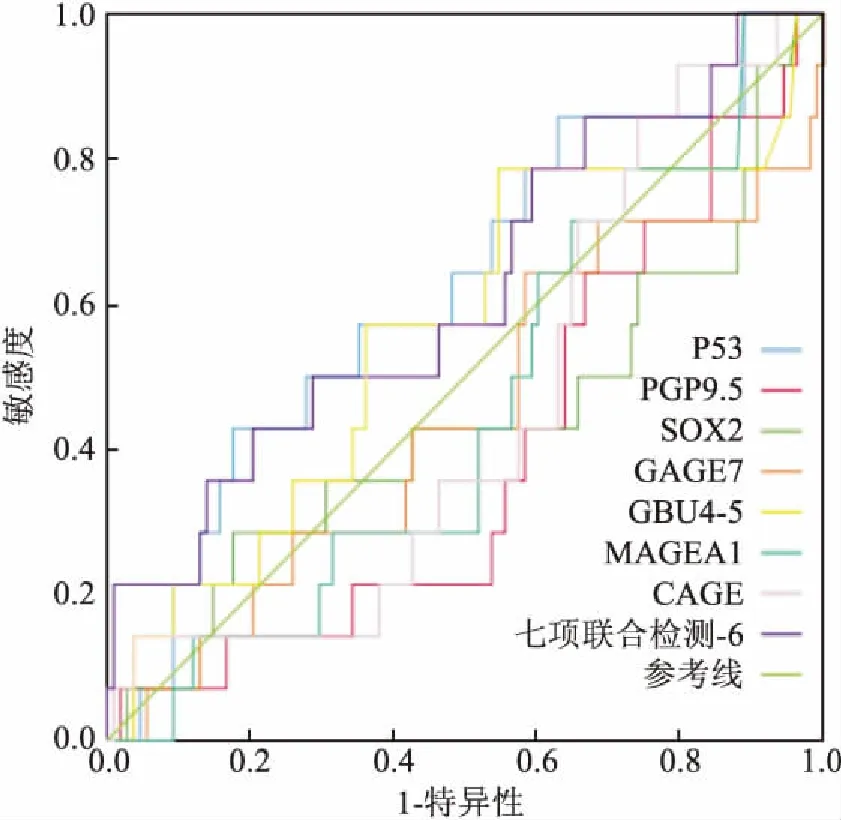
图5 非小细胞肺癌组和其他组七项自身抗体的ROC曲线

图6 肺外肿瘤组和其他组七项自身抗体的ROC曲线
2.8体检组和其他组七项自身抗体的ROC曲线仅MAGEA1的AUC=0.333,且P<0.05,体检组和其他组(肺外肿瘤、肺部良性病变、非小细胞肺癌、小细胞肺癌)MAGEA1自身抗体差异有显著性(P<0.05),见图7。
2.9肺部良性病变和其他组七项自身抗体的ROC曲线仅p53、PGP9.5、GBU4-5、CAGE、七项联合检测预测值的AUC与0.5相差较大,且P<0.05,其诊断价值排序为GBU4-5>七项联合检测预测值> p53>CAGE >PGP9.5,故p53、PGP9.5、GBU4-5、CAGE自身抗体及七项联合指标可鉴别诊断肺部良性病变和其他组(体检、肺外肿瘤组、非小细胞肺癌组、小细胞肺癌),依据其AUC大小,以GBU4-5的诊断价值最高,见图8。
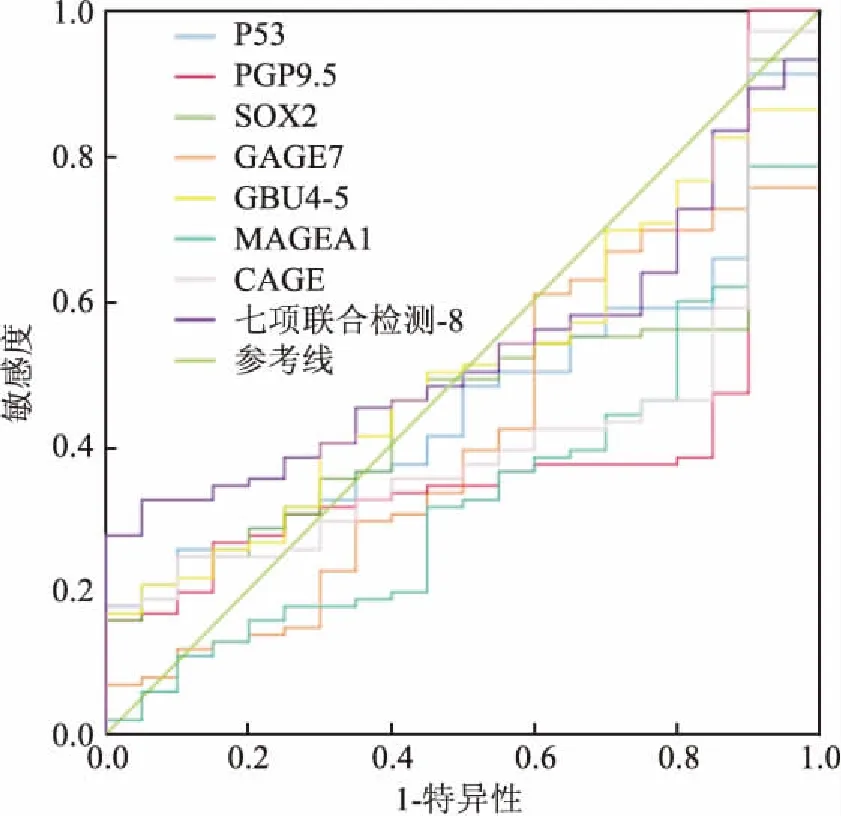
图7 体检组和其他组七项自身抗体的ROC曲线
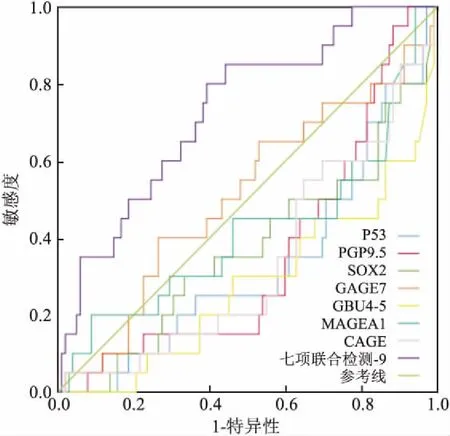
图8 肺部良性病变和其他组七项自身抗体的ROC曲线
3 讨论
与检测某一种自身抗体相比,检测一组自身抗体对疾病的诊断具有更高水平的灵敏度,6个肿瘤相关性抗原即p53,NY-ESO-1,CAGE,GBU4-5,Annexin 1和SOX2组成的血清自身抗体测试组证实了检测一组自身抗体的价值[12]。但是由于欧洲和亚洲肺癌患者的基因构成存在显著差异,因此这一组自身抗体联合检测可能不适合中国人群,近期有研究验证了另外七项自身抗体即p53、GAGE7、PGP9.5、CAGE、MAGEA1、SOX2 和GBU4-5的联合检测与低剂量CT扫描相结合对于表现为磨玻璃样结节或实性结节患者的诊断准确率更高[13]。
本实验通过统计分析122例受试者的血清七项自身抗体的水平,探讨其对肺癌的辅助诊断的应用价值。统计结果显示:相对于其他四组,p53、SOX2、GBU4-5和MAGEA1在小细胞癌组中的表达水平显著增高。但由于该组别病例数相对较少,可能会影响结果的准确性,后续研究将加大样本量。
ROC曲线是生物标志物对疾病的诊断价值的一种非常有效的评价方法。曲线下面积AUC可反映诊断试验的价值的大小。依据Swets标准[14],AUC常常取值范围在0.5~1,为0.5时完全无诊断价值;为1时是完全理想的诊断;通常认为,在0.5~0.7时有较低的准确性;在0.7~0.9时有较高的准确性;在0.9以上时准确性很高。但由于可以对数据按照公式换算后重新绘制ROC曲线旋转180度,从而使AUC大于0.5,所以在ROC分析诊断价值时主要是曲线离分隔线越远好。本实验中,体检组和其他组的ROC曲线以及肺部良性病变和其他组的ROC曲线中有几个指标均小于0.5,并且P<0.05,实际的意义是,这些自身抗体在这些组别里越低越具有诊断价值,如果对这些指标的检测值进行倒数后再进行ROC分析,即可得到数值大于0.5的AUC值。
为了更精细化地评价这些自身抗体对肺癌的诊断价值,本实验对受试者进行不同的分类,结果显示:p53(AUC=0.664,P<0.05)对肺癌组和其他组的鉴别诊断有意义。MAGEA1、CAGE、PGP9.5、SOX2、七项联合检测的对小细胞肺癌组和其他组的鉴别诊断具有较高的诊断价值(均AUC>0.8,P<0.05)。由不同的分组模式所得到的数据可见这七项自身抗体对不同的肺癌类型的诊断也是有区别的。
综上所述,依据分组的不同,本实验中的七项自身抗体及其联合检测对肺癌的鉴别诊断均具有一定的价值。
[1] Torre L A, Siegel R L , Jemal A. Lung cancer statistics[J]. Adv Exp Med Biol, 2016,893:1-19.
[2] 陈 锋, 李为民, 王冬梅, 等. 联合检测血清肿瘤标志物在肺癌诊断中的价值[J]. 四川大学学报(医学版), 2008, 39(5): 832-5.
[3] Wu M, Mao C, Chen Q, et al. Serum p53 protein and anti-p53 antibodies are associated with increased cancer risk: a case-control study of 569 patients and 879 healthy controls [J]. Mol Biol Rep, 2010, 37(1):339-43.
[4] Shimada H, Ochiai T, Nomura F, et al. Titration of serum p53 antibodies in 1,085 patients with various types of malignant tumors: a multiinstitutional analysis by the Japan p53 Antibody Research Group [J]. Cancer, 2003, 97(3):682-9.
[5] Park Y, Kim Y, Lee J H, et al. Usefulness of serum anti-p53 antibody assay for lung cancer diagnosis [J]. Arch Pathol Lab Med, 2011, 135(12):1570-5.
[6] Hibi K, Westra W H, Borges M, et al. PGP9.5 as a candidate tumor marker for non-small-cell lung cancer [J]. Am J Pathol, 1999, 155(3):711-5.
[7] Rudin C M, Durinck S, Stawiski E W, et al. Comprehensive genomic analysis identifies SOX2 as a frequently amplified gene in small-cell lung cancer [J]. Nat Genet, 2012, 44(10):1111-6.
[8] Lowe F J, Shen W, Zu J, et al. A novel autoantibody test for the detection of pre-neoplastic lung lesions [J]. Mol Cancer, 2014, 13:78.
[9] Gjerstorff M F, Pohl M, Olsen K E, et al. Analysis of GAGE, NY-ESO-1 and SP17 cancer/testis antigen expression in early stage non-small cell lung carcinoma [J]. BMC Cancer, 2013, 13:466.
[10] Chapman C J, Murray A, McElveen J E, et al. Autoantibodies in lung cancer: possibilities for early detection and subsequent cure [J]. Thorax, 2008, 63(3):228-33.
[11] Yanagawa N, Tamura G, Oizumi H, et al. MAGE expressions mediated by demethylation of MAGE promoters induce progression of non-small cell lung cancer [J]. Anticancer Res, 2011,31(1):171-5.
[12] Murray A, Chapman C J, Healey G, et al. Technical validation of an autoantibody test for lung cancer [J]. Ann Oncol, 2010, 21(8):1687-93.
[13] Ren S, Zhang S, Jiang T, et al. Early detection of lung cancer by using an autoantibody panel in Chinese population [J]. OncoImmunology, 2017:e1384108.
[14] Swets J A. Measuring the accuracy of diagnostic systems [J]. Science, 1988, 240(4857):1285-93.

