光信号对Fmr1 KO小鼠睡眠-觉醒的调控作用
李晓凤,王 媛,李 磊,许 奇,张 瑾,王烈成
昼夜节律是以24 h左右为周期的规律性变化,影响昼夜节律的因素包括光照、声音、饮食、运动和激素等,其中光照在睡眠-觉醒的调控起重要作用[1]。眼睛接收和处理周围环境中的光信号并传至大脑,通过睡眠-觉醒中枢的分析综合,进而调控睡眠和觉醒[2]。脆性X智力低下基因(Fragile X mental retardation 1,Fmr1)的功能及相关疾病的研究起始于上世纪九十年代[3]。Fmr1在基因组中跨越38 000 bp,由17个外显子和16个内含子组成[4],其转录产物mRNA编码由596个氨基酸残基组成的脆性X智力低下蛋白(Fragile X mental retardation protein,Fmrp)[5],参与调解中枢神经系统内850多种mRNA的转录和翻译[6-7]。Fmr1基因缺失或沉默,导致Fmrp蛋白合成和分泌不足,从而引起神经元结构异常和功能紊乱。研究[8]表明,脆性X综合征(Fragile X syndrome, FXS)在行为、认知和情感等方面存在异常。该研究通过改变光信号分析Fmr1 KO小鼠和WT小鼠的睡眠-觉醒变化,旨在为Fmr1 KO小鼠的研究提供参考,为治疗Fmr1相关的自闭症提供新思路。
1 材料与方法
1.1材料
1.1.1试验动物 SPF级Fmr1 KO 10周龄雄性C57BL/6J小鼠(n=11),20~25 g(北京大学生命科学院生物膜与膜生物工程国家重点实验室张晨研究员友情提供);SPF级10周龄雄性C57BL/6J小鼠(n=13),20~25 g(安徽医科大学实验动物中心提供)。实验小鼠置于独立通风笼内饲养,自由摄食和饮水。光照时间8:00 am~8:00 pm,温度22~24 ℃,湿度55%~60%。
1.1.2主要试剂与仪器 小鼠适配器、高速颅骨钻(深圳瑞沃德生命科技有限公司);造牙粉、义齿基托树脂(上海二医张江生物材料有限公司);记录排线(东莞市耀博电子有限公司);组织胶(日本Toagosei公司);MP150多导生理信号记录分析系统(美国Biopac公司);Sleepsign睡眠分析软件(日本Kissei Comtec株式会社);PCR仪(美国伯乐公司)。
1.2实验方法
1.2.1基因鉴定 小鼠出生后2周,取尾部组织50 mg左右于EP管中,剪碎并做好标记。加入80 μl NaOH(50 mmol/L),放入99 ℃金属浴中30 min,加入40 μl Tris-Hcl(1 mmol/L)。混匀后取各1 μl样品加入反应体系(ddH2O+Buffer+dNTP+TAP酶+引物),混匀后进行PCR反应(94 ℃ 5 min;94 ℃ 30 s,56 ℃ 30 s,72 ℃ 45 s,共35个循环;延伸72 ℃ 10 min)。取PCR反应产物2 μl进行1%琼脂糖凝胶电泳,与Marker作比较,条带约500 bp为WT小鼠,条带约800 bp为Fmr1 KO小鼠。选出需要的基因型雄鼠进行单独饲养。引物序列见表1。

表1 WT and Fmr1 KO 小鼠的PCR验证引物
1.2.2动物手术
1.2.2.1 小鼠麻醉和固定 采用4%戊巴比妥钠对小鼠行腹腔麻醉,麻醉剂量为0.04 ml/g。待小鼠痛觉反射消失后,将其固定于小鼠脑立体定位适配器上。
1.2.2.2 颅骨暴露和埋置脑电电极 剪去小鼠头顶毛发,并用75%酒精消毒皮肤,沿露骨正中线切开皮肤,分离皮下组织使颅骨充分暴露。分别于冠状缝前1.0 mm及人字缝前1.0 mm与颅骨中线两侧旁开1.5 mm处用颅骨钻钻通颅骨(注意不要弄破硬脑膜),先后用组织胶和牙科水泥将脑电电极固定于颅骨上,脑电电极下端触碰硬脑膜为度,用于记录皮层脑电活动。
1.2.2.3 固定肌电电极并缝合伤口 将两根肌电电极分别插入小鼠颈背部两侧的斜方肌内,用于记录肌电活动。然后将电极底座用组织胶和牙科水泥于颅骨上。伤口处给予青霉素粉末并缝合伤口。将小鼠侧卧位放于预先加热好的电热毯上,待小鼠恢复清醒后放入恒温、恒湿、隔音和静电屏蔽功能的屏蔽箱内单独饲养,屏蔽箱内正常光照时间设置为:8:00 am~8:00 pm。
1.2.2.4 连线适应 术后1周,将记录脑电和肌电的排线与小鼠头部的电极连接适应5 d,屏蔽箱内光照8:00 am ~ 8:00 pm。
1.2.3记录方法 为了尽可能减小对小鼠睡眠-觉醒周期的影响,适应结束后采取连续记录的方式。记录12 h : 12 h明暗条件下的睡眠-觉醒情况;记录9:00 am ~ 11:00 am关灯2 h条件的睡眠-觉醒情况。小鼠的睡眠-觉醒情况包括:觉醒(wake,W)、慢波睡眠(slow wave sleep,SWS)和快波睡眠(fast wave sleep,FWS)。

2 结果
2.1小鼠基因鉴定结果手术前,采用PCR技术鉴定Fmr1 KO和WT小鼠,选取Fmr1 KO纯合子(-/-)和WT纯合子(+/+),PCR扩增结果见图1。Fmr1 KO纯合子小鼠扩增出约400 bp的DNA片段,WT纯合子小鼠扩增出约131 bp的DNA片段。经过PCR技术鉴定,确保了实验动物品种正确。
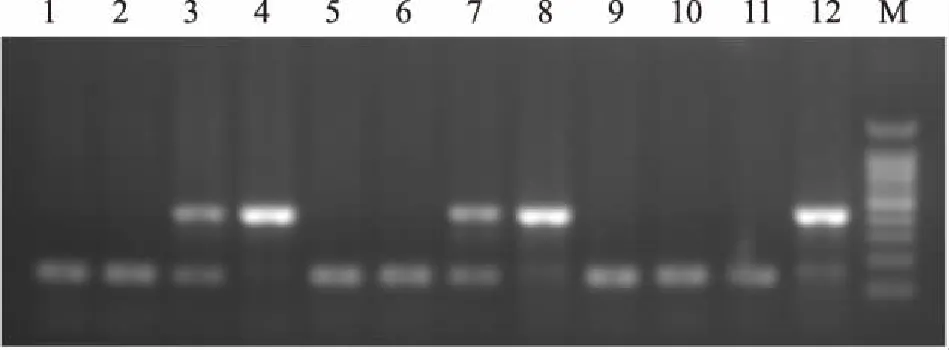
图1 小鼠基因型鉴定结果
M:Marker;1、2、5、6、9、10、11:WT(+/+);4、8、12:KO(-/-);3、7:KO(+/-)
2.2正常光照条件下WT和Fmr1KO小鼠的睡眠-觉醒成一致的昼夜节律现象12 h ∶12 h明暗(8:00 am开灯和8:00 pm关灯)交替中的光授时信号对Fmr1 KO(n=4)和WT小鼠(n=6)的总睡眠时间(total sleep time,TST)和觉醒时间的影响具有一致的昼夜节律变化,二者之间的差异无统计学意义(图2)。
2.3光授时信号对WT和Fmr1KO小鼠在9:00am~11:00am期间觉醒量的影响与正常12 h ∶12 h明暗(8:00 am开灯和8:00 pm关灯)交替的时段相比,WT小鼠(n=6)在关灯2 h(9:00 am~11:00 am)时的觉醒量发生明显变化,尤其是在关灯后的第1小时觉醒量显著增加(P<0.01)。具体表现为:关灯后的第一个阶段(9:00 am~9:20 am)小鼠的觉醒量由(17.66±4.92)%增长至(85.86±8.78)%(t=-11.60,P<0.01),第二个阶段(9:20 am~9:40 am)由(10.21±4.21)%增长至(61.53±7.93)%(t=-14.01,P<0.01),第三个阶段(9:40 am~10:00 am)由(35.92±8.27)%增长至(63.62±9.46)%(t=-5.40,P<0.01)。见图3B。

图2 WT和Fmr1 KO小鼠在12 L/12 D条件下的总睡眠时间和觉醒时间的分布
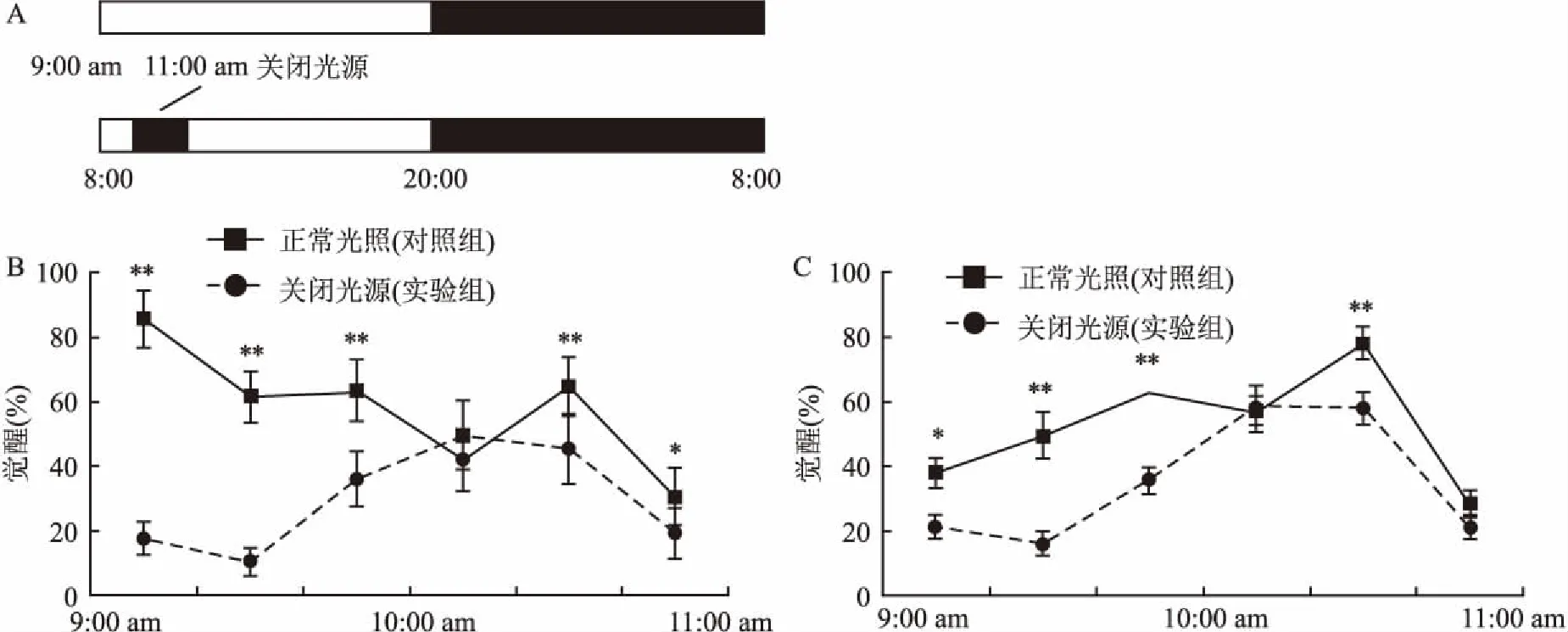
图3 Fmr1 KO和WT小鼠在9:00 am~11:00 am关灯前后觉醒情况分布图
相比于WT小鼠相同时间段关灯前后的变化,Fmr1 KO小鼠(n=6)觉醒量的增加幅度显著降低(P<0.01)。具体表现为:关灯后的第一个阶段(9:00 am~9:20 am)小鼠的觉醒量由(21.39±8.90)%增长至(37.91±11.11)%(t=-2.84,P<0.05),关灯后的第二个阶段(9:20 am ~ 9:40 am)由(16.20±8.63)%增长至(49.41±17.15)%(t=-4.24,P<0.01),关灯后的第三个阶段(9:40 am~10:00 am)由(35.38±10.10)%增长至(62.47±11.77)%(t=-4.28,P<0.01)。见图3C。
2.4光授时信号对WT和Fmr1KO小鼠在9:00am~11:00am期间时相转换的影响与正常光照(8:00 am开灯和8:00 pm关灯)的相同时段相比,WT和Fmr1 KO小鼠关灯2 h期间(9:00 am~11:00 am)的SWS、FWS和W时相的转换数也发生明显的变化(P<0.05)。
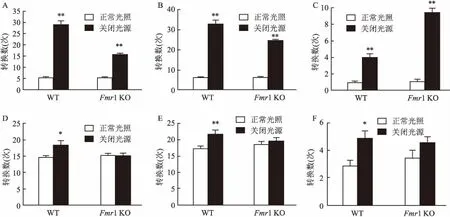
图4 WT和Fmr1 KO小鼠9:00 am~11:00 am关灯期间的时相转换数
A、 B、C:9:00 am~10:00 am;D、E、F:10:00 am~11:00 am;其中A、D:SWS-W、B、E:W-SWS;C、F:FWS-W;与正常光照比较:*P<0.05,**P<0.01
9:00 am~10:00 am关灯期间WT小鼠的SWS-W、W-SWS和FWS-W时相的转换数依次由(5.14±0.51)增加至(28.86±1.77)(t=-12.91,P<0.01)、(6.00±0.31)增加至(32.86±1.65)(t=-15.97,P<0.01)和(0.86±0.26)增加至(4.00±0.44)(t=-6.18,P<0.01);与自身正常光照相同时段相比,10:00 am~11:00 am关灯期间WT小鼠的SWS-W、W-SWS和FWS-W时相的转换数的变化差异无统计学意义(P>0.05)。见图4。
9:00 am~10:00 am关灯期间Fmr1 KO小鼠的SWS-W、W-SWS和FWS-W时相的转换数依次由(5.29±0.36)增加至(15.71±0.57)(t=-15.56,P<0.01)、(6.29±0.42)增加至(24.71±0.68)(t=-23.05,P<0.01)和(1.00±0.31)增加至(9.43±0.48)(t=-14.75,P<0.01);与自身正常光照相同时段相比,10:00 am~11:00 am关灯期间Fmr1 KO小鼠的SWS-W、W-SWS和FWS-W时相转换数的变化较前一个小时明显减弱,但差异有统计学意义(P<0.05)。见图4。
3 讨论
本试验是在基因鉴定的基础上,选用Fmr1 KO纯合子雄性小鼠为试验动物,以光授时信号为试验因子,探究Fmr1 KO小鼠在睡眠-觉醒方面存在的异常。在本研究中,正常光照条件下Fmr1 KO小鼠和WT小鼠的睡眠-觉醒都具有一致的昼夜节律现象;改变9:00 am~11:00 am期间的光授时条件,Fmr1 KO在觉醒量和睡眠-觉醒时相转换数方面与WT小鼠存在差异,由此推测与WT小鼠相比较,Fmr1 KO小鼠受光授时信号的影响有所减弱。而说明光信号如何通过视网膜上的感光细胞对Fmr1 KO小鼠的睡眠-觉醒产生影响,将有助于为患有与Fmr1基因有关的自闭症人群改善睡眠质量提供理论指导。
需要注意的是,小鼠是夜行性动物,而人类是昼行性动物,因此试验中在白天改变光授时信号。基因敲除的方法制造的动物模型,与真正意义上的FXS在分子基础上有着一定上的区别。最近研究[9]表明,新型转基因小鼠有待进一步的开发。另外,由于Fmr1基因位于X染色体上,而男性患者只有一条X染色体,当Fmr1基因突变之后,不能像女性患者那样有一个补偿性的Fmr1基因,故男性FXS的智力和行为缺陷较女性患者更重一些,因此性别因素成为不可忽略的重要方面。故在本研究中选择雄性Fmr1 KO小鼠作为实验动物。
自闭症的病因包括遗传和非遗传因素,FXS是遗传因素中最常见的类型。关于自闭症睡眠问题的报道日益增多。目前以Fmr1 KO小鼠为模型动物研究FXS睡眠问题的报道较少,特别是通过埋置脑电和肌电电极全程监测Fmr1 KO小鼠睡眠-觉醒情况的研究鲜有报道,该方法的优点在于实时监控和精确统计。
光信号对Fmr1 KO小鼠的睡眠-觉醒具有调控作用,相比于WT小鼠,Fmr1 KO小鼠的睡眠-觉醒受光信号改变的影响有所减弱。
[1] 朱大年, 王庭槐.生理学[M].北京:人民卫生出版社, 2013:356-7.
[2] Rusak B, Zucker I. Neural regulation of circadian rhythms[J]. Physiol Rev, 1979, 59(3): 449-526.
[3] Verheij C, Bakker C E, Graaff E, et al. Characterization and localization of the FMR-1 gene product associated with fragile X syndrome[J]. Nature, 1993, 363(6431): 722-4.
[4] Ashley C T, Wilkinson K D, Reines D, et al. FMR1 protein:conserved RNP family domains and selective RNA binding[J]. Science, 1993, 262(5133):563.
[5] Siomi H, Siomi M C, Nussbaum R L, et al. The protein product of the fragile X gene,FMR1,has characteristics of an RNA-binding protein[J].Cell,1993,74(2): 291-8.
[6] Ascano M J, Mukherjee N, Bandaru P, et al. FMRP targets distinct mRNA sequence elements to regulate protein expression[J]. Nature, 2012, 492(7429): 382-6.
[7] Monaghan K G, Lyon E, Spector E B. ACMG Standards and Guidelines for fragile X testing: a revision to the disease specific supplements to the standards and guidelines for clinical genetics laboratories of the American college of medical genetics and genomics[J]. Genet Med,2013, 15(7): 575-86.
[8] Fu Y H, Kuhl D P, Pizzuti A, et al. Variation of the CGG repeat at the fragile X site results in genetic instability: resolution of the Sherman paradox[J]. Cell, 1991, 67(6): 1047-58.
[9] Sellier C, Buijsen R A, He F, et al. Translation of expanded cgg repeats into fmrpolyg is pathogenic and may contribute to fragile x tremor ataxia syndrome[J]. Neuron, 2017, 93(2): 331-47.

