实时定量PCR技术在本科实验教学中的应用
李 欣, 赵玉红, 赵立青, 张金红, 李小菊, 张伟英, 石建党
(南开大学 生命科学学院 生物实验教学中心, 天津 300071)
实时定量PCR技术(real-time quantitative polymerase chain reaction,Real-time PCR)是在定性PCR技术基础上发展起来的核酸定量技术[1-2],该技术是在常规PCR反应体系中加入荧光染料(染料法)或荧光标记的探针(探针法),利用荧光信号积累实时监测PCR扩增反应并对模板初始量进行定量分析[3-4],可用于检测和比较多种样本中的微量核酸,包括基因定量、基因分型和扩增特异性分析等,广泛应用于医学诊断、检验检疫和环境微生物检测等诸多领域[5-6],同时也是分子生物学、遗传学、细胞生物学等基础学科研究中不可或缺的实验技能。
近年来,如何在实验教学中让学生掌握科研工作中常用的基本实验技术,培养学生的综合能力和科研素养,促进教学与科研的相互融合已经成为实验教学改革的重要课题[7]。为此,分子生物学实验课程组设计了综合性实验“实时定量PCR分析不同浓度IPTG对启动子活性的调节作用”,将实时定量PCR这一科研常用技术手段引入本科实验教学。实验首先对大肠杆菌进行不同浓度IPTG诱导培养,随后分别提取细菌总RNA,经过反转录PCR后获得cDNA,再以此为模板,选择更具普适性的染料法(SYBR GreenⅠ)进行实时定量PCR。最后采用绝对定量分析模式计算出不同浓度IPTG诱导下目的基因mRNA水平的增加倍数,进而推算出相应启动子利用效率的变化情况。
1 主要实验仪器
NanoDrop 2000C超微量分光光度计、高速冷冻离心机、常规PCR仪;Roche LightCycler 480实时定量PCR仪、恒温振荡培养箱、DNA水平电泳设备,凝胶成像系统等。
2 主要实验材料与试剂
含pGEX-4T-2/GAPDH质粒的大肠杆菌DH5α,RNAprep Pure细菌总RNA提取试剂盒,RevertAid First Strand cDNA Synthesis Kit,LightCycler 480 SYBR GreenⅠMaster,实时定量PCR引物(上游:5’-GCCAGTGAGCTTCCCGTTCAG-3’;下游:5’-CTGGAAAGCTGTGGCGTGATG-3’ ),TE Buffer(pH 8.0),DNase/RNase-Free Deionized Water等。
3 实验方法
3.1 大肠杆菌的诱导培养
将含pGEX-4T-2/GAPDH质粒的大肠杆菌DH5α接种于20 mL含有80 μg/ml氨苄青霉素的LB培养基中,37 ℃,200 r/min振荡培养,至OD600达0.6~0.8 h,分装菌液至细菌培养管中,每管4 mL,共分4管,其中1管作为对照,不加IPTG诱导,另外3管加入IPTG至终浓度分别为0.1 mM、0.5 mM和1 mM。37 ℃,200r/min振荡培养30 min。
3.2 大肠杆菌总RNA的提取
详细操作步骤以RNAprep Pure细菌总RNA提取试剂盒说明书为准。
(1) 4支培养管各取1.5 mL菌液,4 ℃,12 000r/min,离心2 min收集菌体,弃掉上清;
(2) 重复上步操作一次,每种菌液共收集3 mL菌体;
(3) 用含有400 μg/mL溶菌酶的100 μL TE buffer重悬菌体,室温孵育5 min;
(4) 加入350 μL裂解液,旋涡振荡混匀;
(5) 加入250 μL无水乙醇,混匀后转移至吸附柱(放于收集管中),12 000 r/min,离心1 min,倒掉废弃液;
(6) 吸附柱中加入350 μL去蛋白液,12 000r/min,离心1 min,倒掉废弃液;
(7) 吸附柱中加入80 μL DNaseⅠ工作液,室温静置15 min;
(8) 重复步骤6;
(9) 吸附柱中加入500 μL漂洗液,室温放置2 min,12 000 r/min,离心1 min,倒掉废弃液;
(10) 重复上步操作一次;
(11) 12 000 r/min,离心2 min,倒掉废弃液,将吸附柱置于室温晾干;
(12) 将吸附柱转入新的RNase-free离心管中,向吸附膜加入60 μL RNase-Free Deionized Water,室温静置2 min,12 000 r/min,离心2 min,即得到RNA溶液。
3.3 RNA的检测
使用NanoDrop 2000C超微量分光光度计对提取的4份RNA进行定量。随后分别上样4 μg进行1%的琼脂糖凝胶电泳,80 V,30 min。用凝胶成像系统进行观察拍照。
3.4 反转录合成cDNA
3.4.1 反应体系
每种RNA样品分别取2 μg进行反转录,用Nuclease-free Water补足体积至10 μL。按表1配制5份2×反转录反应体系的混合液,充分混匀后短暂离心,分装于4个RNase-free的PCR管中,每管10 μL。再分别加入4种不同的RNA(2 μg/10μL),充分混匀,最终配制完成4份20 μL 1×反转录反应体系。

表1 2×反转录反应体系
3.4.2 反应条件
将上述4份反应体系置于常规PCR仪上,设定反应条件为:25 ℃,10 min;42 ℃,60 min;80 ℃,10 min;4 ℃,forever。
3.5 实时定量PCR
3.5.1 准备不同浓度的标准品
用NanoDrop 2000C超微量分光光度计测定pGEX-4T-2/GAPDH质粒浓度,按如下公式换算成拷贝数:
拷贝数/μL=质粒浓度(ng/μL)×10-9×6.02×1 023/质粒碱基对数目总和×碱基对平均相对分子质量。本质粒的碱基对数目总和为5955,碱基对平均相对分子质量为660。
将质粒进行梯度稀释,分别配制为5×104 拷贝/μL、5×105 拷贝/μL、5×106 拷贝/μL和5×107 拷贝/μL 4个浓度的标准品。
3.5.2 反应体系
反应样品包括4个反转录产物、4个标准品和1个阴性对照,共9种,且每种样品均需要做3个重复,共计27份反应体系。因此,先配制除表2中组分1以外的其他几种组分的混合液(按30份计算),充分混匀后短暂离心,分装为9份,63 μL/份,以对应9种样品。在每份中分别加入7 μL的相应组分1,再次混匀,短暂离心,分装至Roche 8连管中,20 μL/管,短暂离心。

表2 实时定量PCR反应体系
3.5.3 反应条件
将Roche 8连管放置于LightCycler 480实时定量PCR仪中。设置4步反应程序,具体参数如表3所示。
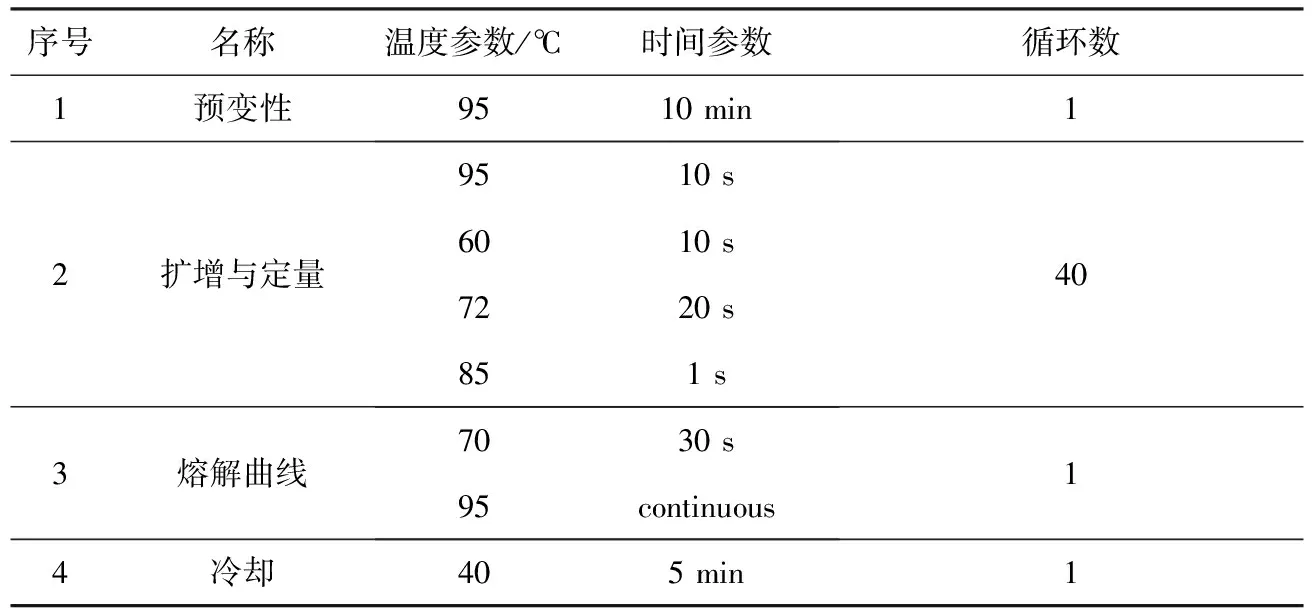
表3 实时定量PCR反应程序
反应结束后,选择绝对定量分析模式对实验结果进行处理。
4 实验结果与分析
4.1 大肠杆菌总RNA的检测
4.1.1 定量检测
使用NanoDrop 2000C超微量分光光度计对提取的RNA进行定量检测。图1是未经诱导的RNA样品检测结果。0.1 mM IPTG诱导、0.5 mM IPTG诱导和1 mM IPTG诱导的RNA样品浓度分别为:281.4 ng/μL、366.1 ng/μL和316.8 ng/μL。
理论上,纯RNA的A260/A280比值应该在2.0左右,比值较高可能是试剂残留或RNA部分降解造成的,因此还须进一步通过琼脂糖凝胶电泳对RNA的提取质量进行检测。
4.1.2 琼脂糖凝胶电泳检测
生物体内一般含有3种主要的RNA,即核糖体RNA(rRNA)、信使RNA(mRNA)和转运RNA(tRNA),其中rRNA含量最多,提取细胞或组织总RNA所得最多的就是rRNA。大肠杆菌属于原核生物,将其总RNA进行琼脂糖凝胶电泳,理论上应该看到3条带23S、16S和5S rRNA。本实验RNA样品的电泳结果如图2所示。

图2 RNA琼脂糖凝胶电泳结果
4份RNA样品电泳结果都可以看到较为明显的3条RNA 带,从上到下依次为大肠杆菌的23S、16S和5S rRNA,根据各条带的带型和亮度,说明总RNA的提取质量较好。
4.2 实时定量PCR
4.2.1 PCR产物的熔解曲线
本实验选用SYBR GreenⅠ染料法,相比探针法,染料法的反应特异性差,因此需要在实时定量PCR反应结束后,用Tm Calling分析方法观察各扩增产物的熔解曲线,以考察产物的特异性,如图3所示。

图3 熔解曲线
从图3中结果可以看出,扩增产物的熔解曲线只有单一峰,PCR过程中没有非特异性扩增产物。由于扩增中可能产生的非特异性产物(如引物二聚体)的Tm值一般低于74 ℃,当将反应条件中的读板温度设置为85 ℃时,就可以有效避免这些非特异性产物对结果判定的影响。
4.2.2 扩增曲线与标准曲线
反应完毕后,所有样品的扩增曲线如图4所示。

图4 扩增曲线
扩增曲线光滑平稳,“S”形完好,符合定量检测要求。在此基础上选择绝对定量分析模式,软件会根据标准品扩增曲线自动绘制出标准曲线,如图5所示。

图5 标准曲线
标准曲线中浓度Log值与阈值循环数CP(crossing point)线性关系良好,可以作为待测样品定量分析的依据。
4.2.3 通过标准曲线得到的待测样品拷贝数
根据标准曲线,软件会自动给出各样品中目的片段的起始浓度(拷贝数),见图6。
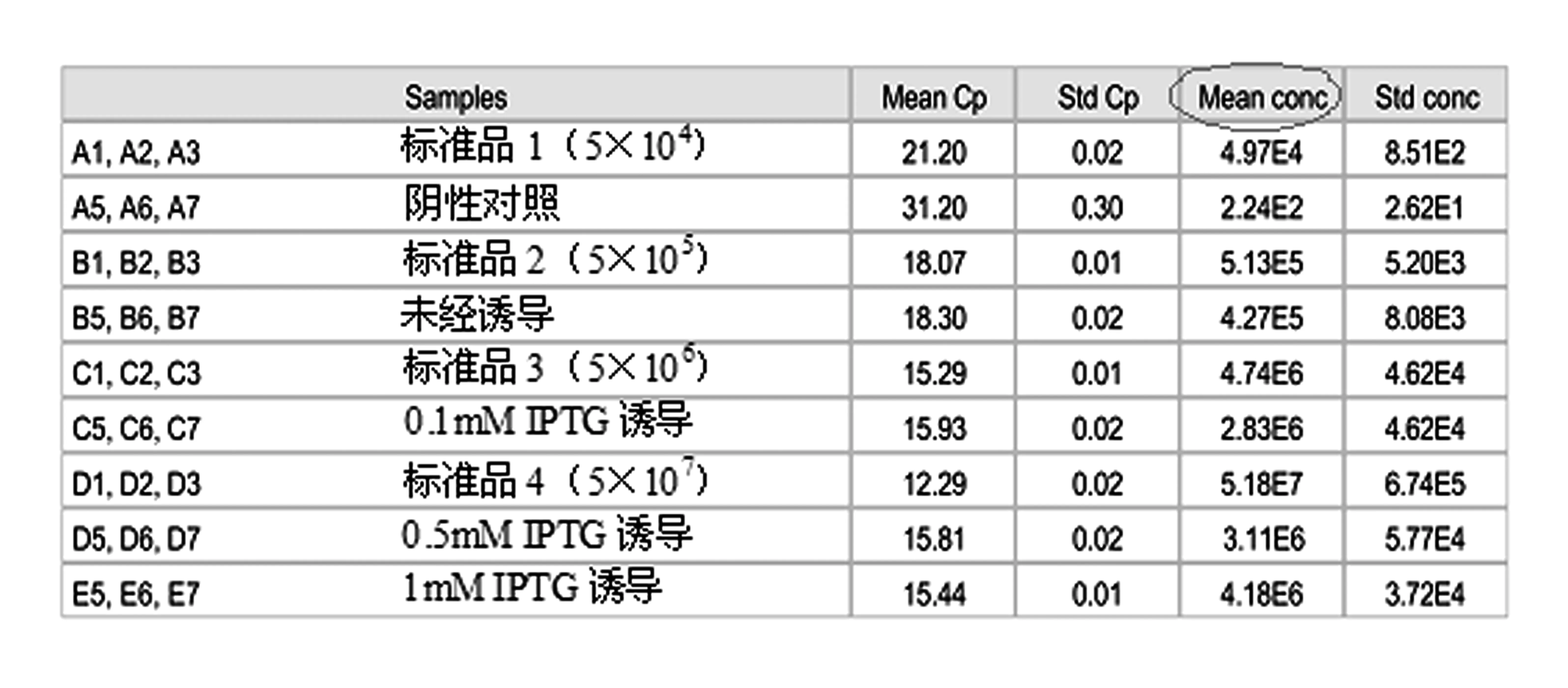
图6 绝对定量分析结果
根据图6中“Mean conc”(平均浓度)一栏的数据可知,未经诱导的样品目的片段起始浓度为4.27×105 拷贝/μL,经0.1 mM、0.5 mM和1 mM IPTG诱导后的样品目的片段起始浓度分别为2.83×106 拷贝/μL,3.11×106 拷贝/μL和4.18×106 拷贝/μL。分别与对照组(未经诱导)相比,即可获得不同浓度IPTG诱导下目的基因mRNA水平的增加倍数,进而推算出启动子利用效率的变化情况。通过计算,经0.1 mM、0.5 mM和1mM IPTG诱导后,mRNA水平或启动子利用效率分别是未经诱导时的6.6倍、7.3倍和9.8倍。即经过IPTG诱导,启动子利用效率明显提高。
5 注意事项
5.1 避免RNase污染
由于RNase基本上无处不在且很难灭活,因此在RNA提取时最好隔离出一个独立的空间进行RNA提取实验,且配备专用的移液器、离心机等设备,相关耗材如枪头、离心管等也需选用RNase-free的。另外,在实验中,操作人员应佩戴一次性口罩、帽子、手套,实验过程中手套要勤加更换。
5.2 配制溶液必须充分混匀
实验体系中频繁涉及到溶液的配制和分装,因此溶液的混匀操作对于整个实验的精准度甚至成败而言至关重要。如在进行梯度稀释时,务必将上一浓度溶液混合均匀后再进行下一浓度稀释;涉及多管反应配制混合液时,务必充分将各组分混合均匀后再分装,既可以提高反应精度,还可以减少重复性操作和污染的可能。
5.3 对PCR污染的控制
从图6的结果列表中可以发现,阴性对照中也出现了200多个目的片段拷贝,这说明反应体系中很可能存在一定程度的污染。由于实时定量PCR反应灵敏度很高,极微量的污染都会被放大,因此,在进行PCR时要注意以下几点:
(1) PCR的不同处理步骤应尽量在相对独立的区域进行,如模板处理区(进行模板的制备和加入)、溶液配制区(进行反应体系的配制)、PCR扩增区(进行PCR扩增)以及产物分析区(进行凝胶电泳分析和结果拍照),各工作区要有一定的隔离,且操作器材专用;
(2) 枪头、离心管等耗材以及相关试剂不要长时间暴露于空气中,避免气溶胶的污染;
(3) PCR扩增所需要的试剂(如双蒸水、引物等)均应在装有紫外灯的超净工作台或负压工作台配制和分装,每次实验最好取用新打开的独立小包装;
(4) 反应体系中最后加入反应模板,加入后盖紧反应管;
(5) 操作过程中避免反应液飞溅,若不小心溅到手套或桌面上,应立刻更换手套并用稀酸擦拭桌面等。
5.4 注意试剂和产物的存放条件
该实验过程所用试剂以试剂盒为主,在使用前应认真阅读试剂盒使用说明书,并严格按照说明书上的要求存放相关试剂,如酶类需要分装避免反复冻融、LightCycler 480 SYBR GreenⅠMaster需要避光等。另外,由于在教学过程中整个实验需要分解在几天中进行,若中间产物保存不当,必然会影响下一步乃至最终的实验结果。对于离心收集的菌体,如暂时不提取RNA可以冻存于-70 ℃;对于提取获得的RNA最好直接进行反转录,也可以存放于-20 ℃短时间保存。如果需要较长时间保存RNA,则可以在其中加入2.5倍体积的无水乙醇,混匀后保存于-70 ℃;对于反转录产物,最多可以在-20 ℃保存1周,如需保存更久,则需要放置于-70 ℃。
6 教学设计
该实验项目具有较强的连贯性和综合性,且实验成本较高,对学生的理论知识和操作技能也都有较为严格的要求,而传统的基础实验课程受众面广,学生水平参差不齐,且一定程度上受到课时和经费的限制,若在基础实验中开设这一项目,势必会增加师生的教学负担,影响实验教学效果[8]。因此,课程组拟将该项目作为一个独立的综合性实验,首先面向已具有分子生物学基础的大三年级生物伯苓班开设。
生物伯苓班是南开大学入选国家“基础学科拔尖学生培养试验计划”的生物学科人才培养试点班。伯苓班学生都是本着优中选优的原则层层选拔而来,无论是理论和操作基础,还是学习的主动性和积极性等方面都有着明显的优势[9]。另外,伯苓班一直秉承着小班授课的独立培养模式,且拥有学校划拨的专项实验课程经费作为保障,这些都为面向伯苓班开设本实验项目创造了良好的条件。
不同于基础验证性实验,综合性实验是模拟一个小型研究课题,教学模式是以学生为主体,教师为主导,给予学生更多的自主空间,以充分激发学生的主观能动性[10-11]。实验从细菌诱导培养开始,到最终推断出启动子的利用效率变化都由学生自行安排完成,教师只在这个过程中进行必要的讲解、引导以及答疑解惑。实验结束后,师生一起对实验过程中出现的问题及实验结果进行讨论与点评,让每个学生做到“知其然,且知其所以然”。最终的实验报告要求以科研论文的形式提交。这一教学设计不但使学生能够深入、全面、系统地掌握科研中常用的实时定量PCR技术及绝对定量分析方法,对于培养学生的科研思维、提高科研能力和科研素养更具有重要的实践意义。
7 结语
将科研领域中的常用实验技术改造成适合本科生实验教学的实验内容,一直是高等教育教学改革的研究热点之一[12]。课程组开设“实时定量PCR分析不同浓度IPTG对启动子活性的调节作用”这一综合性实验,旨在将实时定量PCR技术引入本科实验教学。通过优化的实验条件和合理的教学设计,不但可以让本科生掌握该项技术的原理和操作要点、提高学生的实践能力,更能够在环环相扣的教学内容中训练学生系统的科研思维以及严谨的科研素养,为提高本科实验教学水平和人才培养质量、促进教学与科研相互融合奠定了良好的基础。
[1] 杨怡姝,孙晓娜,王小利,等.实时荧光定量PCR技术的操作实践[J].实验室研究与探索,2011,30(7):16-19.
[2] 靳溪,薛秀花,李洁,等.实时荧光定量PCR技术在发育生物学实验[J].实验室研究与探索,2014,33(7):214-217.
[3] 徐丽华,刘春雷,常玉梅,等.双标准曲线相对定量PCR试验原理与方法[J].生物技术通报,2011(1):70-75.
[4] 李丽,赵成萍,李宏,等.质粒制备绝对定量PCR标准曲线方法的建立[J].农业生物技术学报,2011,19(6):1157-1162.
[5] 裘劼人,许颖,喻富根.利用SYBR Green实时定量PCR法检测转基因植物外源基因的拷贝数[J].安徽农业科学, 2011,39(21):12655-12657.
[6] 婷婷,杨延磊,筎金,等.关于定量PCR技术中模板使用浓度的研究[J].昆明医科大学学报,2013(3):15-17.
[7] 盖颖,陆海.基于能力培养的分子生物学实验改革[J].中国现代教育装备,2012(1):96-97.
[8] 王威,龙志强,辛华.构建实践性教学环节,加强研究生实践能力培养[J].高等教育研究学报,2009(32):43-45.
[9] 吴强,曹学伟,刘智波,等.国内短期访学对本科生培养的重要性:以南开大学物理“伯苓班”为例[J].物理与工程,2015,25(1):68-70.
[10] 阎晓菲,童婷,代培红,等.《生物技术综合实验》教学体系改革及效果评价[J].广州化工,2013,41(21):147-158.
[11] 李丽萍,彭少丹,杨艳琼,等.分子生物学综合实验教学改革探索[J].实验科学与技术,2012,10(1):104-106.
[12] 廖晓燕,邱国福,肖玉秀,等.药学综合实验教学的实践与思考[J].药学教育,2010, 26(4):57.

