“从茶叶中提取咖啡因”综合性有机化学实验设计
王 虹, 王 军
(江苏警官学院 刑事科学技术系, 江苏 南京 210031)
“从茶叶中提取咖啡因”是本科有机化学实验中开设的经典实验之一[1-3],已有文献对Soxhlet提取装置进行了改进,用缩合双套管分离装置代替索氏提取器,溶剂依靠液位差将热的纯溶剂连续向下流动作用于茶叶上,可缩短50%提取时间,溶剂用量减少1/3[4];也有用100 mL恒压漏斗代替Soxhlet提取装置,使得萃取时间从3 h缩短为1.5 h[5]。有文献对升华装置进行改进[6],很好地解决了控温问题,这些实验装置的改进或工艺条件的优化提高了实验的成功率。由于仪器资源的限制,将咖啡因提取实验与仪器分析中的结构鉴定、定量检验相结合的教学改革的探索还比较少[7],本实验教学方案依托刑事科学技术专业(法化学方向)的专业实验室综合训练教学平台的大型仪器资源,对经典实验教学内容升级改革,在“从茶叶中提取咖啡因”的实验教学中,除了熔点测定外,引入红外光谱仪[8]、可见-紫外光谱仪[9]和荧光光谱仪[10]对提取产品进行光谱测定,使用1HNMR、GC-MS[11]对提取产品进行鉴定,这样就得到了一个有机物的基本谱图,对确定有机物的结构提供依据。
1 咖啡因提取实验
1.1 实验装置
如图1所示,实验装置由加热套、圆底烧瓶、底部装有一片砂芯的恒压滴液漏斗和球形冷凝管组成,样品直接装入定制的恒压漏斗中。在恒压漏斗中装入一片砂芯,防止学生在底部塞入棉花时因不易控制棉花量而造成堵塞。
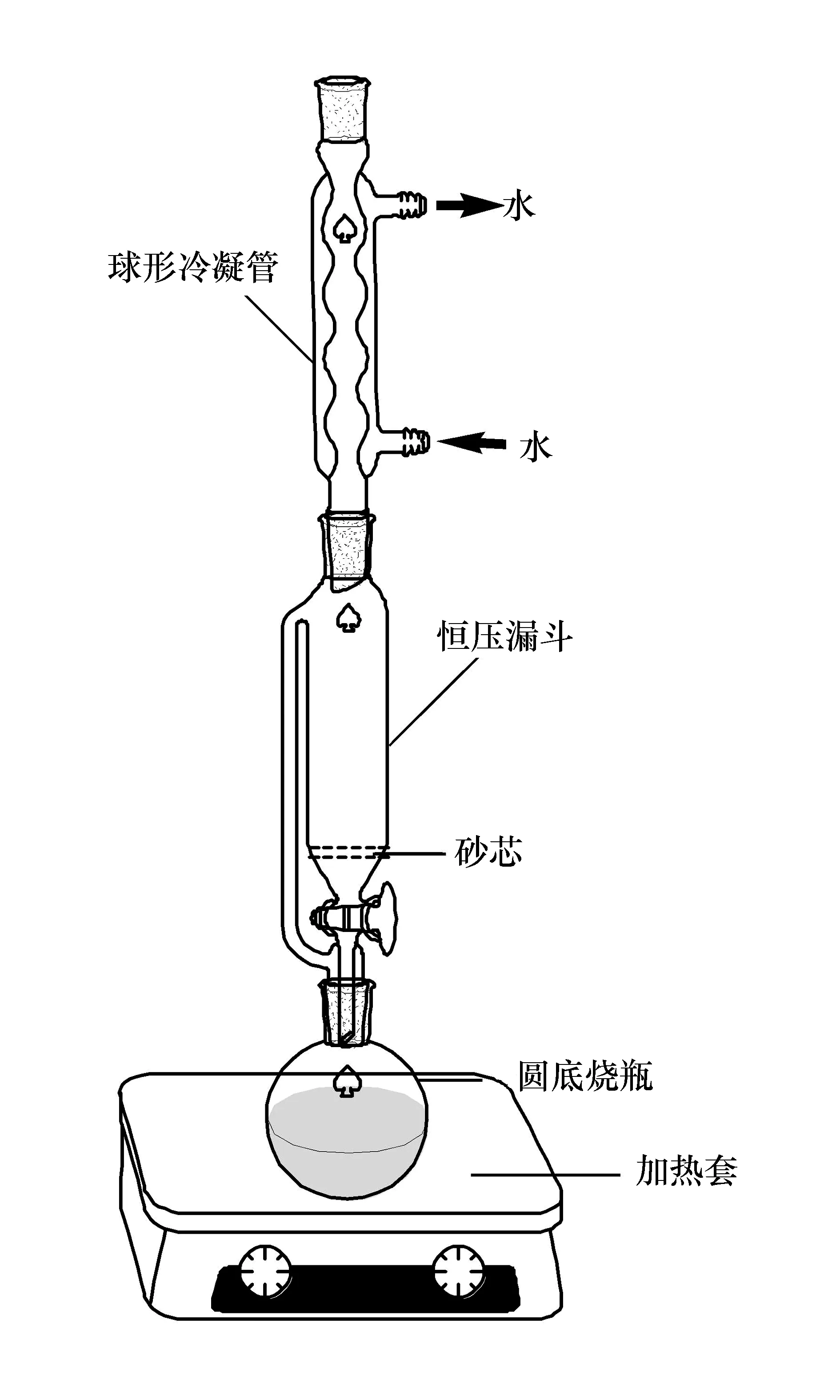
图1 改进的咖啡因提取装置
1.2 提取方法
称取10 g茶叶末装入定制的恒压滴液漏斗中,盖上一片定性滤纸,防止茶叶末从恒压漏斗侧管流入烧瓶中,在250 mL圆底烧瓶内加入几粒沸石,如图1安装好后,将 100 mL 95%的乙醇从球形冷凝管中注入,将茶叶浸泡15 min后,将液体缓缓放入圆底烧瓶中。通冷凝水,电热套加热(电热套放在升降台上,以便控制温度),当95%的乙醇被加热沸腾后,控制电热套温度在90 ℃,乙醇蒸气从恒压漏斗侧管上升,被球形冷凝管冷凝为液体并直接滴到茶叶上面。当恒压漏斗内乙醇液面超出茶叶约0.5 cm时,调节恒压漏斗活塞,使乙醇冷凝的滴速度与恒压漏斗的放液速度一致,提取大约1 h,恒压漏斗中提取液颜色变浅,停止加热,降低升降台,使电热套远离圆底烧瓶。将恒压漏斗中乙醇提取物都放入圆底烧瓶中,冷却约10 min,将恒压漏斗从圆底烧瓶上取下,改成蒸馏装置,进行乙醇回收步骤,当圆底烧瓶中液体浓缩至15~20 mL时,停止加热,将圆底烧瓶中剩余液体倒入蒸发皿中,进行升华提纯步骤,向蒸发皿中加入4 g研细的中和沉淀剂NaAc+Na2CO3(质量比3∶1)[12],搅拌成糊状。将蒸发皿置于水浴锅上用玻璃棒不断搅拌并将其压成粉状。将蒸发皿置于铺有一层厚约2 cm细砂的石棉网上,代替将蒸发皿直接置于石棉网上加热,使样品受热均匀,不易使产品碳化变色。咖啡因在100 ℃时可失去结晶水并开始升华,120 ℃时显著升华,在178 ℃时迅速升华为针状晶体,因此通过测量控制沙浴的温度在190 ℃。将一张刺有许多小孔且孔刺向上的滤纸盖在蒸发皿上,再在滤纸上罩一个大小合适的颈部塞一小团疏松棉花的漏斗,至产生棕色烟雾止。冷却后,轻轻揭开漏斗和滤纸,仔细用小刀将附在滤纸上的白色针状晶体刮下,搅拌蒸发皿内的残渣,重新放好滤纸和漏斗,再加热片刻,使升华完全,合并产物,称重。
2 咖啡因结构鉴定
2.1 紫外光谱分析
将咖啡因配制成10 μg/mL的三氯甲烷溶液,用可见紫外分光光度计(珀金埃尔默Lambda 45)在200—400 nm范围内进行扫描,得到紫外光谱图。
2.2 荧光光谱分析
根据所得的紫外最大吸收波长,将10 μg/mL的咖啡因三氯甲烷溶液置于荧光分光光度计(安捷伦Cary Eclipse)内,激发狭缝和发射狭缝均为5 nm,在200—800 nm范围内进行激发和发射波长扫描。
2.3 红外光谱分析
取少量样品研磨成粉末状,将样品放置在傅里叶变换显微红外成像仪(Nicolet iN10 MX,赛默飞世尔科技有限公司,美国)的金刚石晶体上,使用单点衰减全反射OMNI采样器固定钮将样品压紧进行扫描,获得样品的红外吸收光谱。
2.4 核磁共振分析
称取约10 mg白色针状晶体于核磁共振测样管中,加入约0.5 mL的氘代氯仿作为溶剂,振荡后用Bruker AVANCE Ⅲ 400 MHz的核磁共振仪进行1HNMR检测。
2.5 质谱分析
将咖啡因配制成50 μg/L乙醇溶液,振荡,微滤膜过滤,滤液用HPLC-QTOF-MS液质联用仪(液相色谱仪1290 Infinity,Agilent公司;质谱仪TripleTOF 5600,AB SCIEX公司)进行质谱分析。
3 结果与讨论
3.1 提取实验
在实际教学过程中,通过对该实验提取装置的改进,简化了实验操作方法,咖啡因的提取成功率高,产率一般能够达到1.5%以上。实验过程中,采用恒压滴液漏斗代替索氏提取器,简化提取实验的操作难度;采用电热套替代原实验指导书中酒精灯加热方式,避免潜在的实验危险,并易于调控加热温度;采用混合中和沉淀剂NaAc+Na2CO3(质量比3∶1)代替氧化钙,提高咖啡因提取率。提取实验结果见表1。
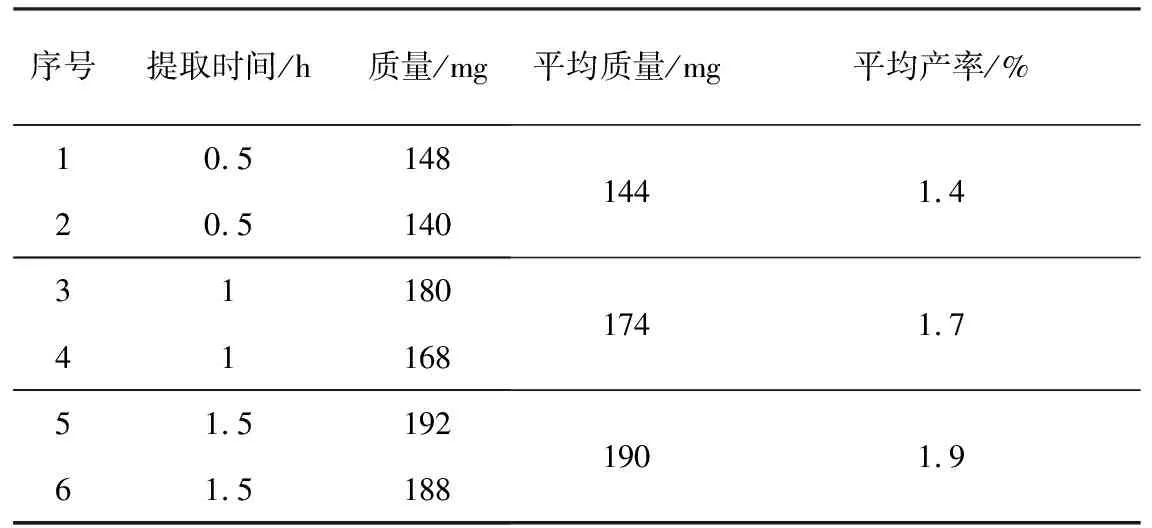
表1 提取时间对咖啡因收率的影响
3.2 结构鉴定
原实验指导书中没有结构鉴定的实验内容,为了让学生进一步了解咖啡因的性质以及掌握有机物结构确定的常用方法,增加了目标物结构鉴定内容。
3.2.1 咖啡因熔点测定
将提取的白色针状咖啡因晶体置于显微数字熔点仪(WRX-4型)上进行检测,熔点为235.5~236.8℃,与文献值相符[13],这说明得到的产物是咖啡因纯品。
3.2.2 紫外光谱
将紫外可见分光光度计的扫描波长定为200~400 nm,取2 份三氯甲烷样进行基线扫描,待基线平稳后,取所合成样品三氯甲烷溶液进行扫描,由图2可以看出,在276.18 nm处有最大吸收峰,这是羰基n→π*的R带跃迁。

图2 咖啡因紫外吸收谱图
3.2.3 荧光光谱
在276.18 nm激发波长下,扫描发射波长,再以发射波长测定激发波长。如此反复,选择最佳的激发波长和发射波长(见图3)。
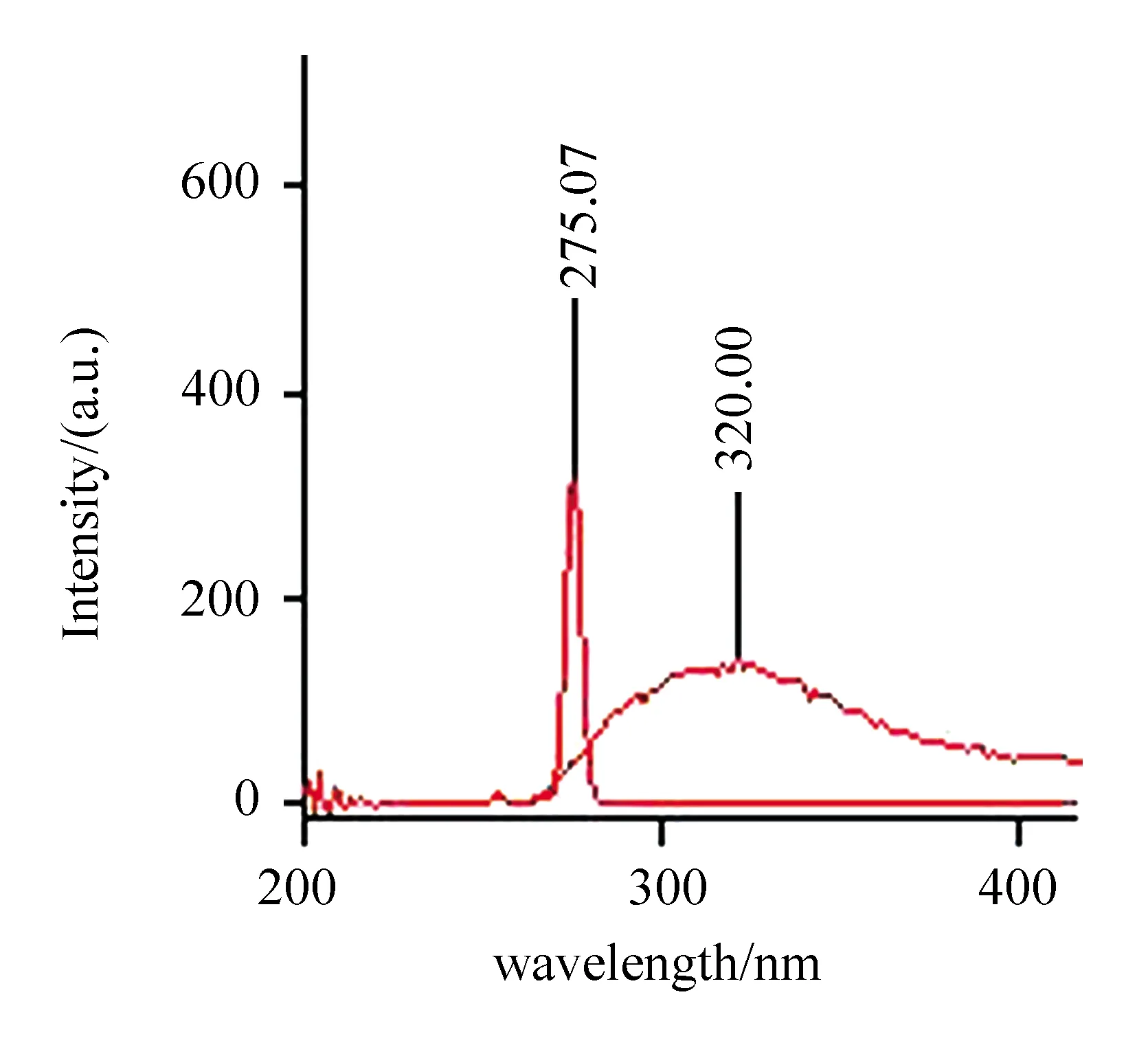
图3 咖啡因荧光激发和发射光谱图
咖啡因的激发波长为275.07 nm,发射波长为320 nm,它主要是由嘌呤环吸收光后进入激发态,然后又回到基态发射荧光所产生的谱带。
3.2.4 核磁共振
将所合成咖啡因经乙醇重结晶后,利用核磁共振仪(400 MHz),以氘代氯仿为溶剂进行1HNMR测定。图4中可见5类质子单峰,分别对应δ3.41(3H,s,N7—CH3)、δ3.59(3H,s,N3—CH3)、δ3.90(3H,s,N1—CH3)、δ7.53(1H,s,C8—H)峰面积之比为3∶3∶3∶1,以及溶剂氘代氯仿δ7.28(1H,s,C—H),与咖啡因各位置的氢质子数相一致。通过对1HNMR谱图分析氢的归属,使学生进一步了解咖啡因结构。

图4 咖啡因核磁共振谱图
3.2.5 红外光谱
红外光谱采用单点衰减全反射OMNI采样器;扫描次数16次;光谱分辨率4 cm-1;测量范围为4 000~700 cm-1。
从图5中可以看出:3 114cm-1是C8—H键的伸缩振动;2 955.14 cm-1为—CH3的C—H伸缩振动,1 485.18 cm-1、1 455.21 cm-1、1 401.60 cm-1为C—H变角振动;1 701.75 cm-1为2号碳原子上的羰基—CO键伸缩振动;1 656.81 cm-1为6位碳原子上—CλO键伸缩振动;1 549.45 cm-1为8、9位CN键的伸缩振动;1 358.26 cm-1和1 237.70 cm-1为OC—N中C—N的伸缩振动;1 025.97 cm-1为N3—C4的伸缩振动;973.49 cm-1为 —C—N键对称振动吸收峰。
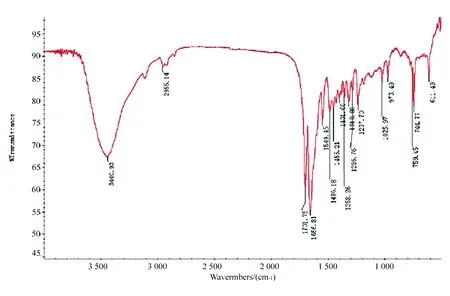
图5 咖啡因红外光谱图
3.2.6 质谱
利用Agilent 7890B/5977A气质联用仪对实验提取的咖啡因样品进行检测,得到质谱图(见图6)。由图6可知,咖啡因有很强的分子离子峰m/z 194和较强的碎片离子峰m/z 109。
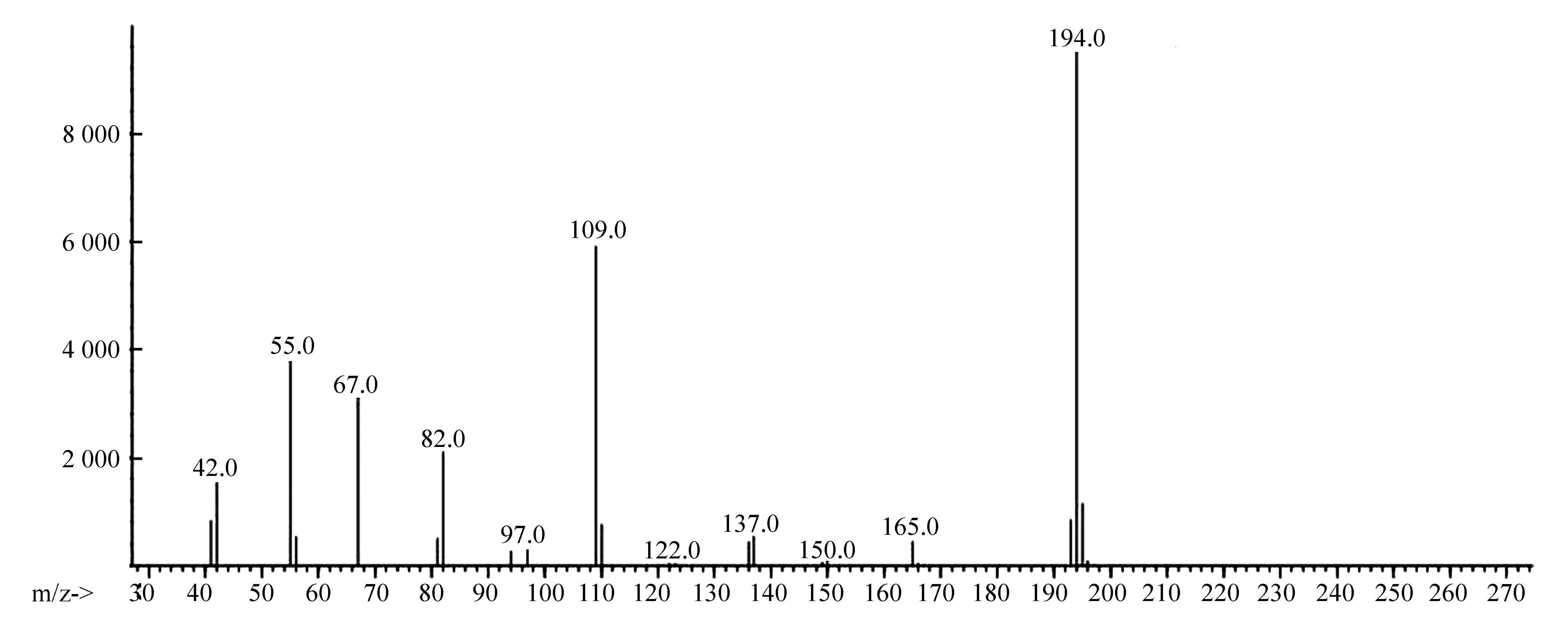
图6 咖啡因质谱图
4 结语
将“咖啡因的提取”实验教学和仪器分析教学相结合,能使学生掌握对于有机物进行结构和性能测试的常用仪器,将有机化学实验与仪器分析实验2门课程相互融合,既能够给学生一个系统的、完整的实验过程,又能体现学科之间的相互交叉。通过对紫外、荧光、红外、核磁、质谱等谱图的认识,使学生不仅了解仪器结构和工作原理,同时也提高学生运用各种谱图进行数据分析、推断有机化合物结构和性质的能力。通过综合设计实验教学内容,培养了学生多角度、综合考虑问题的能力,提高了学生的学习兴趣,可以让学生尽早掌握科学研究思维过程,为学生接下来的大学生创新训练项目研究以及今后从事科研工作创造条件。
[1] 李静,王惠泽,刘艳红,等.茶叶中提取咖啡因实验教学改革探索与实践[J].实验技术与管理,2015,32(1):54-60.
[2] Murray,Scott D,Hansen P J.The Extraction of Caffeine from Tea: An Old Undergraduate Experiment Revisited[J].Journal of Chemical Education,1995,72(9):851-852.
[3] Switzer S T. Clair A.The Effect of Caffeine on Experimental Extinction of Conditioned Reactions[J].The Journal of General Psychology,1935,12(1):78-94.
[4] 王莉贤,王红,金东元,等.双套管分离装置在咖啡因提取实验中的应用[J].实验室研究与探索,2004,23(9):32-33.
[5] 杨祖幸,汤洁,孙群,等.从茶叶中提取咖啡因实验方法及装置的改进[J].实验室研究与探索,2008,27(3):43-44.
[6] 吕守茂,祝巨,俞远志,等.茶叶中提取咖啡因实验装置的改进[J].实验室研究与探索,2009,28(5):32-33.
[7] Mizuno K,Fujimura T,CrozierA . Purification and Characterization of Caffeine Synthase from Tea Leaves[J].Plant Physiology,1999,120(2):579-586.
[8] Paradkar M M,Irudayaraj J.Rapid determination of caffeine content in soft drinks using FTIR-ATR spectroscopy[J].Food Chemistry,2002,78(2):261-266.
[9] Muszalska I,Zajac M,Wróbel G, et al.UV/VIS spectrophotometric methods for determination of caffeine and phenylephrine hydrochloride in complex pharmaceutical preparations. Validation of the methods[J].Acta Poloniae Pharmaceutica, 2000 , 57 (4) :247-252.
[10] Belay A,Kim H K,Hwang Y H .Binding of caffeine with caffeic acid and chlorogenic acid using fluorescence quenching, UV/vis and FTIR spectroscopic techniques[J]. Luminescence,2016,31(2):565-572.
[11] Pawliszyn J.Quantitative determination of caffeine in beverages using a combined SPME-GC/MS method[J].Journal of Chemical Education,1997,74(9):1130-1132.
[12] 刘晓庚,朱珊,李佩昕.茶叶中咖啡因提取方法的比较[J].中国食品添加剂,2010,21(4)83-87.
[13] 朱婧,肖咏梅,马丽.有机化学实验[M].北京:化学工业出版社,2011:116-117.

