响应面法优化樟芝胞外多糖的发酵条件
王正齐,张薄博,陈 磊,*,关 锋,2,*
(1.江南大学生物工程学院,糖化学与生物技术教育部重点实验室,江苏无锡 214122; 2.西北大学生命科学学院,陕西西安 710069)
樟芝(Antrodiacinnamomea,A.cinnamomea)又名牛樟芝、牛樟菇等,是台湾特有的珍稀药食两用真菌,隶属于担子菌门、担子菌亚门、同担子菌纲、无摺菌目、多孔菌科、薄孔菌属[1],素有“神芝”、“森林中的红宝石”之称。樟芝主要生长于幽暗、潮湿且温度稍低的海拔450~2000 m的台湾东海岸山脉阔叶林地区,适宜于中性偏酸的环境。近年来,随着越来越多的人关注真菌多糖,作为一种药食两用真菌的活性产物,樟芝胞外多糖也受到了青睐[2]。研究表明樟芝胞外多糖具有抗炎症[3-5]、抗肿瘤[6-7]、抗氧化[8]等多种作用。然而由于樟芝的生长对环境要求苛刻,因此樟芝多糖的来源及产量成为限制其开发的重要因素。
目前樟芝的人工培育方式主要有三种:段木栽培法、液态发酵法以及固态发酵法。相比而言,液态发酵法具有周期短且易于工厂放大培养的优点,适合大规模生产[2]。但在实际发酵过程中,培养基的营养组成及发酵条件都会影响到胞外多糖产量。已有研究发现麦芽糖和葡萄糖是适宜的碳源,在4%的麦芽糖和4%的葡萄糖培养10 d的发酵液中胞外多糖产量达到最大[9],且当碳氮比为40∶1时既有利于菌丝生长又能提高胞外多糖产量[10]。pH对樟芝生长及其多糖的产生都有重要影响,研究表明樟芝细胞生长的最适pH为4.0,而合成胞外多糖的最适pH为5.0[11]。Lin等优化出樟芝液态发酵合成胞外多糖的最适条件为28 ℃,培养14 d,5%(w/v)葡萄糖,0.5% Ca(NO3)2,0.1% FeSO4和0.1%烟酸能使多糖产量达到最大(0.49 g/L)[12]。本文在前期的研究基础上首先对碳氮源进行筛选,然后应用响应面法(Response Surface Methodology,RSM)优化了樟芝液态发酵产胞外多糖的条件,在提高产量的同时合理的解决了培养基本身所含大分子物质对后期樟芝自身合成多糖的分离纯化所造成的干扰这一问题,为樟芝液态发酵产胞外多糖的工业生产提供一定的基础。
1 材料与方法
1.1 材料与仪器
樟芝 上海福茂食用菌有限公司;葡萄糖标品 美国Sigma公司;酵母浸粉 安琪酵母股份有限公司;其他试剂 国药集团化学试剂有限公司。
电热恒温水浴锅 广州越秀医疗器械厂;电热恒温培养箱 连云港医疗器械设备厂;高速台式冷冻离心机 湖南湘仪实验室仪器开发有限公司;全温摇床柜 太仓市实验设备厂;电子天平 上海舜宇恒平科学仪器有限公司;高压蒸汽灭菌锅 上海申安医疗器械厂;电热鼓风干燥箱 上海博讯医疗设备厂;超净工作台 苏州净化设备有限公司;可见分光光度计 上海光谱仪器有限公司;循环水式真空泵 巩义市予华仪器有限公司;超声波清洗器 昆山市超声仪器有限公司。
1.2 实验方法
1.2.1 培养基条件 樟芝接种于加富PDA斜面,28 ℃避光培养7 d,4 ℃保藏。
孢子悬浮液制备:利用无菌水将加富PDA斜面表层的孢子洗下,玻璃珠打散后镜检,使孢子数达到1×106个/mL。
液态种子培养基:葡萄糖50 g/L,酵母浸粉10 g/L,MgSO4·7H2O 1.0 g/L,K2HPO40.5 g/L,柠檬酸0.5 g/L,pH自然。装液量120 mL/500 mL三角瓶,接种量10 mL,28 ℃,3 d,130 r/min。
1.2.2 单因素实验设计
1.2.2.1 主要营养物质对樟芝液态发酵合成胞外多糖的影响 a.氮源种类及添加量:控制樟芝液态发酵培养基为葡萄糖50 g/L,维生素B10.5 g/L,KH2PO40.5 g/L,MgSO4·7H2O 0.5 g/L,分别加入10 g/L的蛋白胨、酵母浸粉、玉米浆粉、牛肉浸膏、大豆水解液、硫酸铵、柠檬酸铵、酒石酸铵、硝酸钠、硝酸钾和硝酸钙作为氮源,初始pH自然。装液量100 mL/500 mL,接种量10%,28 ℃,130 r/min培养10 d,筛选出最适宜樟芝液态发酵产胞外多糖的氮源后,并对其添加量进行优化,添加量设定为5、10、15、20和25 g/L,每组重复三次。
b.碳源种类及添加量:控制樟芝液态发酵培养基为酵母浸粉15 g/L,维生素B10.5 g/L,KH2PO40.5 g/L,MgSO4·7H2O 0.5 g/L,分别加入50 g/L的葡萄糖、果糖、麦芽糖、蔗糖和乳糖作为碳源,初始pH自然。装液量100 mL/500 mL,接种量10%,28 ℃,130 r/min培养10 d,筛选出最适宜樟芝液态发酵产胞外多糖的碳源后,并对其添加量进行优化,添加量设定为30、40、50、60和70 g/L,每组重复三次。
c.KH2PO4添加量:控制樟芝液态发酵培养基为葡萄糖50 g/L,酵母浸粉15 g/L,维生素B10.5 g/L,MgSO4·7H2O 0.5 g/L,KH2PO4添加量设定为0.2、0.5、0.8、1.1和1.4 g/L,初始pH自然。装液量100 mL/500 mL,接种量10%,28 ℃,130 r/min培养10 d,测定樟芝液态发酵生物量和胞外多糖产量,每组重复三次。
d.MgSO4·7H2O添加量:控制樟芝液态发酵培养基为葡萄糖50 g/L,酵母浸粉15 g/L,维生素B10.5 g/L,KH2PO40.5 g/L,MgSO4·7H2O添加量设定为0.2、0.5、0.8、1.1和1.4 g/L,初始pH自然。装液量100 mL/500 mL,接种量10%,28 ℃,130 r/min培养10 d,测定樟芝液态发酵生物量和胞外多糖产量,每组重复三次。
1.2.2.2 发酵条件对樟芝液态发酵合成胞外多糖的影响 a.接种量:控制樟芝液态发酵培养基为葡萄糖50 g/L,酵母浸粉15 g/L,维生素B10.5 g/L,KH2PO40.5 g/L,MgSO4·7H2O 0.5 g/L,初始pH自然。装液量100 mL/500 mL,接种量设定为5%、10%、15%、20%、25%,28 ℃,130 r/min培养10 d,测定樟芝液态发酵生物量和胞外多糖产量,每组重复三次。
b.初始pH:控制樟芝液态发酵培养基为葡萄糖50 g/L,酵母浸粉15 g/L,维生素B10.5 g/L,KH2PO40.5 g/L,MgSO4·7H2O 0.5 g/L,初始pH设定为3、4、5、6、7、8。装液量100 mL/500 mL,接种量10%,28 ℃,130 r/min培养10 d,测定樟芝液态发酵生物量和胞外多糖产量,每组重复三次。
c.培养温度:控制樟芝液态发酵培养基为葡萄糖50 g/L,酵母浸粉15 g/L,维生素B10.5 g/L,KH2PO40.5 g/L,MgSO4·7H2O 0.5 g/L,初始pH自然。装液量100 mL/500 mL,接种量10%,培养温度设定为22、25、28、31、34 ℃,130 r/min培养10 d,测定樟芝液态发酵生物量和胞外多糖产量,每组重复三次。
d.摇床转速:控制樟芝液态发酵培养基为葡萄糖50 g/L,酵母浸粉15 g/L,维生素B10.5 g/L,KH2PO40.5 g/L,MgSO4·7H2O 0.5 g/L,初始pH自然。装液量100 mL/500 mL,接种量10%,28 ℃,摇床转速设定为70、100、130、160、190 r/min培养10 d,测定樟芝液态发酵生物量和胞外多糖产量,每组重复三次。
e.装液量:控制樟芝液态发酵培养基为葡萄糖50 g/L,酵母浸粉15 g/L,维生素B10.5 g/L,KH2PO40.5 g/L,MgSO4·7H2O 0.5 g/L,初始pH自然。装液量设定为50、100、150、200、250 mL/500 mL,接种量10%,28 ℃,摇床转速设定为130 r/min培养10 d,测定樟芝液态发酵生物量和胞外多糖产量,每组重复三次。
1.2.3 Plackett-Burman实验设计 本实验中使用Design-Expert 8.0软件,设计了包含10个待筛选因素的12组Plackett-Burman实验。根据单因素实验的结果,每个待筛选因素设定一个高水平(+1)和低水平(-1),同时结合Plackett-Burman实验中因子水平越接近最优值越有代表性[13]及某些因素高低水平的差值不能过大,以防掩盖其他因素重要性的原则[14]。具体Plackett-Burman实验水平设计如表1所示(每组实验均重复三次)。

表1 Plackett-Burman实验因素和水平编码表Table 1 Plackett-Burman experiment factors and coded value of variance
1.2.4 Box-Behnken实验设计 根据Plackett-Burman实验的结果,选择发酵液的初始pH、KH2PO4添加量、温度和MgSO4·7H2O添加量为自变量,胞外多糖产量为响应值,对发酵条件进行Box-Behnken优化实验,设计因素水平见表2。每个不同变量X1,X2,X3,X4表示不同的参数,其中每个参数的低、中和高水平分别为-1,0,+1,具体算法如下[15]:

表2 Box-Behnken实验因素和水平编码表Table 2 Box-Behnken experiment factors and coded value of variance

1.2.5 检测与分析方法
1.2.5.1 樟芝液态发酵生物量的测定 樟芝发酵液经纱布过滤,去离子水洗涤菌体至无色后,50 ℃烘干至恒重并称重。
1.2.5.2 樟芝液态发酵胞外多糖的测定 取经抽滤的樟芝发酵液浓缩后,加入3倍体积的无水乙醇,4 ℃静置24 h,6000 r/min离心15 min,重复醇沉一次后利用苯酚-硫酸法测定多糖含量。
1.2.6 数据处理 Plackett-Burman设计响应值按照一次多项式回归方程模型进行回归分析[16]
Box-Behnken设计响应值按照二次多项式回归方程模型进行回归分析[16]
式中:Y为响应预测值,xi为自变量,β0为截距,βi为线性系数,βii为平方系数,βij为交互作用系数[17]。方差分析采用Design-Expert 8.06和SPSS 18.0统计分析软件进行,作图采用Orign 9.0软件处理。
2 结果与讨论
2.1 单因素实验
2.1.1 主要营养物质对樟芝液态发酵合成胞外多糖的影响
2.1.1.1 氮源种类及添加量对樟芝液态发酵合成胞外多糖的影响 由图1可知,在不同氮源添加量统一在10 g/L的条件下,樟芝液态发酵生物量与胞外多糖产量均有较大差异。在大豆水解液、玉米浆粉、蛋白胨、牛肉浸膏和酵母浸粉等有机氮源培养条件下,樟芝液态发酵生物量和胞外多糖产量明显高于硫酸铵和柠檬酸铵等无机氮源;而无机氮源中硫酸铵、柠檬酸铵、酒石酸铵等铵态氮中胞外多糖的产量明显高于硝酸钠、硝酸钾、硝酸钙等硝态氮,这说明铵态氮比硝态氮更有利于促进胞外多糖的合成。据此我们可以得出氮源对樟芝液态发酵合成胞外多糖的影响效果为:有机氮>铵态氮>硝态氮。几种有机氮源对樟芝液态发酵菌丝体生长促进作用影响不明显,其中玉米浆粉对樟芝液态发酵菌丝体生长的效果最好,菌体量可以达到9.53 g/L。然而就樟芝液态发酵合成胞外多糖而言,酵母浸粉是最佳氮源,多糖产量可以达到0.72 g/L。此外,考虑到培养基本身所含多糖会对樟芝液态发酵合成的胞外多糖的计算造成干扰,我们对比了酵母浸粉和玉米浆粉本身多糖含量,发现二次醇沉后酵母浸粉不含多糖,而玉米浆粉中多糖含量为2%。综上可得樟芝液态发酵产胞外多糖培养基的最佳氮源为酵母浸粉。
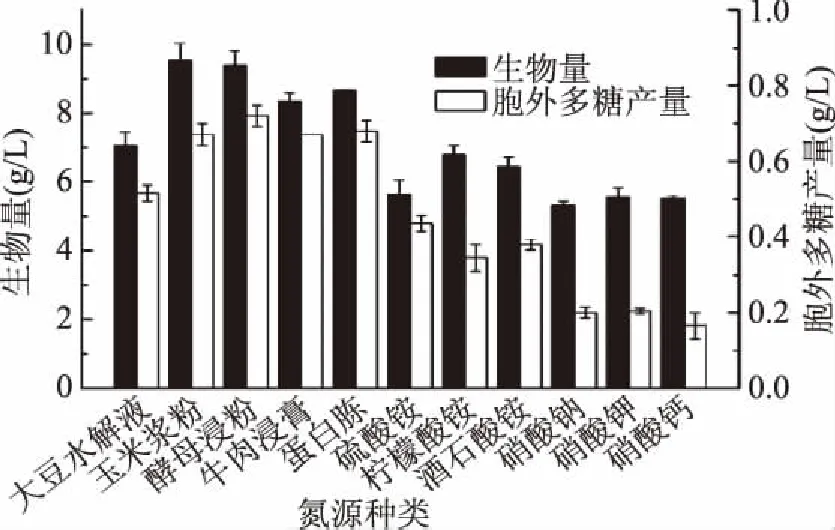
图1 氮源对樟芝液态发酵生物量和胞外多糖产量的影响Fig.1 Effect of various nitrogen sources on the biomass and production of exopolysaccharide in submerged fermentation of A. cinnamomea
确定最佳氮源后,对氮源添加量进行优化,结果如图2所示。由图可知,酵母浸粉的添加量对樟芝液态发酵的生物量有一定影响,随着酵母浸粉含量的增加,生物量先增加后趋于稳定,而胞外多糖则呈现先增后减的趋势。当酵母浸粉的含量达到20 g/L时,胞外多糖的产量最大达到1.00 g/L。因此,以酵母浸粉添加量20 g/L为中心点进行显著因素筛选实验。
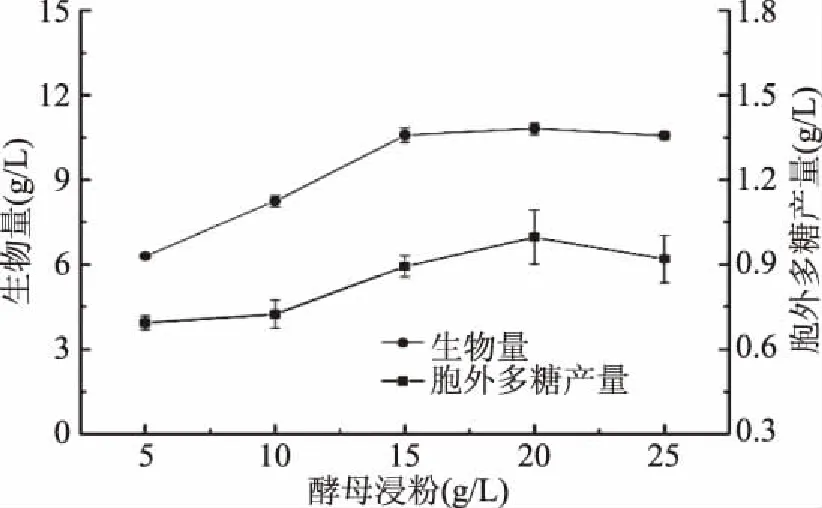
图2 酵母浸粉添加量对樟芝液态发酵 生物量和胞外多糖产量的影响Fig.2 Effect of different concentrations of yeast extract on the biomass and production of exopolysaccharide in submerged fermentation of A. cinnamomea
2.1.1.2 碳源种类及添加量对樟芝液态发酵合成胞外多糖的影响 由图3可知,碳源的种类对樟芝液态发酵的生物量和胞外多糖产量均有非常明显的影响。以葡萄糖、果糖等单糖为碳源的生物量和胞外多糖产量明显高于蔗糖和乳糖等二糖,说明樟芝液态发酵对单糖的利用效率比二糖好。单糖中以葡萄糖为碳源对樟芝液态发酵的胞外多糖产量略高于果糖,分别为0.80和0.77 g/L。因此樟芝液态发酵最优碳源为葡萄糖。

图3 碳源种类对樟芝液态发酵 生物量和胞外多糖产量的影响Fig.3 Effect of various carbon sources on the biomass and production of exopolysaccharide in submerged fermentation of A. cinnamomea
如图4所示,培养基中葡萄糖的添加量对樟芝液态发酵的生物量和胞外多糖的产量都有一定的影响。在30~50 g/L之间生物量和胞外多糖的产量随葡萄糖添加量的增加而增加,此后生物量趋于稳定,但胞外多糖却表现出下降的趋势。当葡萄糖含量为50 g/L时,胞外多糖的产量最高可达到0.90 g/L。因此选择葡萄糖添加量50 g/L为中心点进行显著因素筛选实验。

图4 葡萄糖添加量对樟芝液态发酵 生物量和胞外多糖产量的影响Fig.4 Effect of different concentrations of glucose on the biomass and production of exopolysaccharide in submerged fermentation of A. cinnamomea
2.1.1.3 无机盐添加量对樟芝液态发酵合成胞外多糖的影响 确定了樟芝液态发酵产胞外多糖的最适碳氮源之后,对KH2PO4和MgSO4·7H2O两种无机盐的添加量进行了优化,结果如图5和图6所示。由图可知,两种无机盐对樟芝液态发酵产胞外多糖均有明显影响,且趋势一致,均先增加后减少,在添加量为0.8 g/L时,多糖产量最大分别为0.85和0.76 g/L。结果表明K、P、Mg等微量元素在樟芝液态发酵合成胞外多糖中起着重要作用,这与王丽星等[18]人研究结果一致。因此,在后续的显著因素筛选实验中KH2PO4和MgSO4·7H2O添加量均以0.8 g/L为中心点。
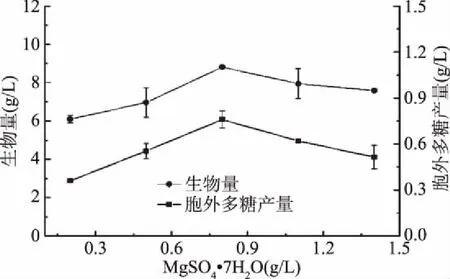
图5 MgSO4·7H2O添加量对樟芝液态发酵 生物量和胞外多糖产量的影响Fig.5 Effect of different concentrations of MgSO4·7H2O on the biomass and production of exopolysaccharide in submerged fermentation of A. cinnamomea

图6 KH2PO4添加量对樟芝液态发酵 生物量和胞外多糖产量的影响Fig.6 Effect of different concentrations of KH2PO4 on the biomass and production of exopolysaccharide in submerged fermentation of A. cinnamomea
2.1.2 发酵条件对樟芝液态发酵合成胞外多糖的影响
2.1.2.1 接种量对樟芝液态发酵合成胞外多糖的影响 由图7可知,随着接种量的加大,樟芝液态发酵的生物量呈现不断上升的趋势,而胞外多糖的产量却先升高后下降,当接种量为15%时,胞外多糖的产量最高(0.93 g/L)。增大接种量可使延滞期缩短,但营养物质也会被过快消耗,导致合成胞外多糖的前体物质减少,反而会使产量降低;接种量过小,生长延滞期过长,提高了实验成本。因此,选择接种量15%为中心点进行下一步实验。
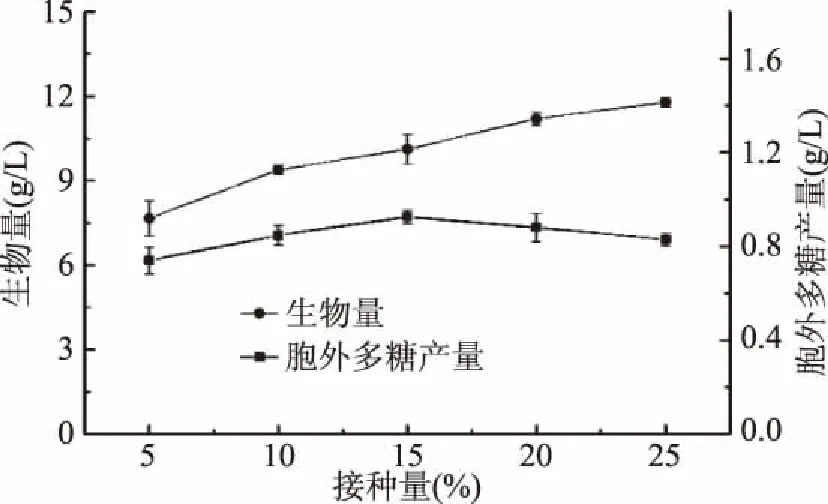
图7 接种量对樟芝液态发酵 生物量和胞外多糖产量的影响Fig.7 Effect of different inoculum concentrations on the biomass and production of exopolysaccharide in submerged fermentation of A. cinnamomea
2.1.2.2 初始pH对樟芝液态发酵合成胞外多糖的影响 由图8可知,樟芝液态发酵的生物量和胞外多糖的产量随着发酵液初始pH的增加呈现先升后降的趋势,初始pH为自然(此时测得发酵液pH为5.37)时最利于菌丝体的生长,此时胞外多糖的产量也达到最大值1.00 g/L。表明樟芝液态发酵合成胞外多糖的最适pH为弱酸性环境,这与已有的结果相一致[11]。考虑到后续试验的可操作性,选择初始pH=5为中心点进行下一步实验。
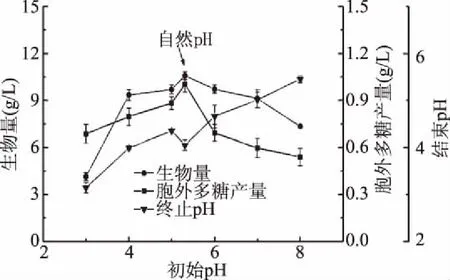
图8 初始pH对樟芝液态发酵 生物量和胞外多糖产量的影响Fig.8 Effect of different initial pH values on the biomass and production of exopolysaccharide in submerged fermentation of A. cinnamomea
2.1.2.3 发酵温度对樟芝液态发酵合成胞外多糖的影响 由图9可知,生物量和胞外多糖的产量随着培养温度的提高均呈现先升后降的趋势,当发酵温度为28 ℃时樟芝液态发酵生物量与胞外多糖产量同步达到最大值,此时胞外多糖的产量可以达到0.86 g/L。因此,选择发酵温度为28 ℃作为中心点进行下一步实验。
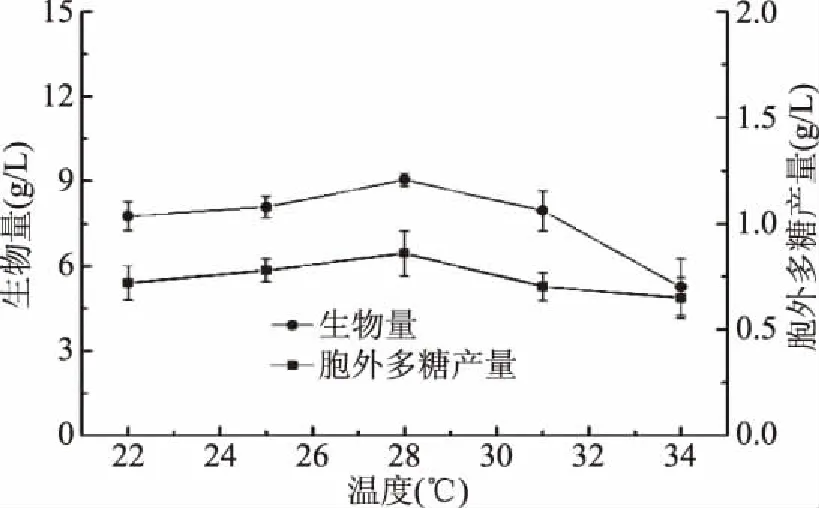
图9 温度对樟芝液态发酵生物量和胞外多糖产量的影响Fig.9 Effect of different temperatures on the biomassand production of exopolysaccharide in submerged fermentation of A. cinnamomea
2.1.2.4 摇床转速对樟芝液态发酵合成胞外多糖的影响 由图10可知,随着摇床转速的增大,胞外多糖的产量上升,但当摇床转速超过一定的范围,胞外多糖的产量随着摇床转速的增大而逐渐降低。这可能是由于随着转速的进一步增大,菌体所受的剪切力也随之增大,影响了菌体的正常生长进而影响胞外多糖的合成。当摇床转速为100 r/min时最有利于胞外多糖的合成,此时产量为1.02 g/L。同时测量不同转速下菌球的直径发现,在100 r/min时,菌球直径达到最大(d=2.92 mm),并且随着转速的继续增加呈现递减的趋势。而当转速过低(70 r/min)时发现菌体出现结块现象,影响了生物量和胞外多糖产量,导致二者产量急剧下降。这可能跟低转速下溶氧不足有关,而樟芝为好氧真菌,对溶氧有一定要求[19]。因此,在显著因素筛选实验中直接以100 r/min作为低水平值。
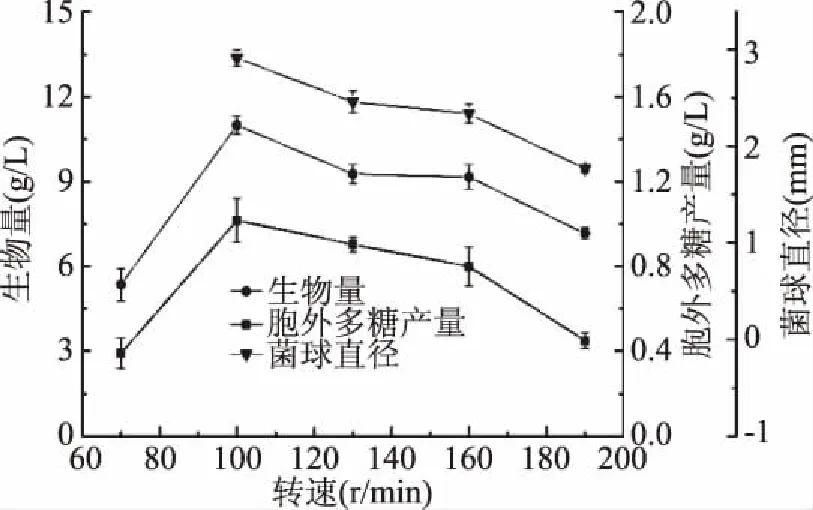
图10 转速对樟芝液态发酵生物量和胞外多糖产量的影响Fig.10 Effect of different rotation speed on the biomass and production of exopolysaccharide in submerged fermentation of A. cinnamomea
2.1.2.5 装液量对樟芝液态发酵合成胞外多糖的影响 由图11可知,不同装液量对樟芝液态发酵生物量和胞外多糖产量的影响存在一定差异,当装液量为150 mL/500 mL时生物量达到最大值9.49 g/L;而当装液量为100 mL/500 mL时,胞外多糖产量达到最大值0.80 g/L。在摇瓶实验阶段,装液量主要通过影响发酵液中溶氧水平来影响生物量及其代谢产物的含量,当装液量过低或过高时均不利于樟芝生长和合成胞外多糖。因此,选择装液量100 mL/500 mL作为中心点进行下一步实验。
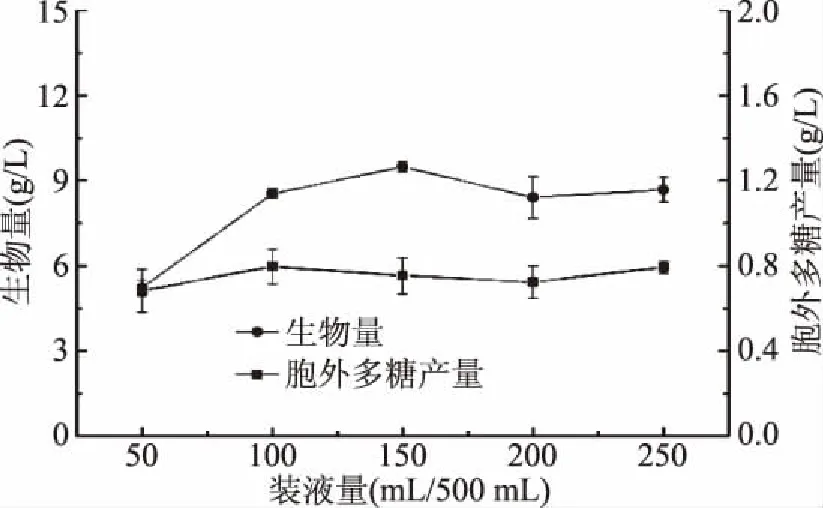
图11 装液量对樟芝液态发酵 生物量和胞外多糖产量的影响Fig.11 Effect of different capacity on the biomass and production of exopolysaccharide in submerged fermentation of A. cinnamomea
2.2 Plackett-Burman实验设计结果及分析
根据单因素实验结果,设计了10因素的Plackett-Burman实验,实验设计及实验结果如表3所示,每组实验的响应值取三次重复实验的平均值。
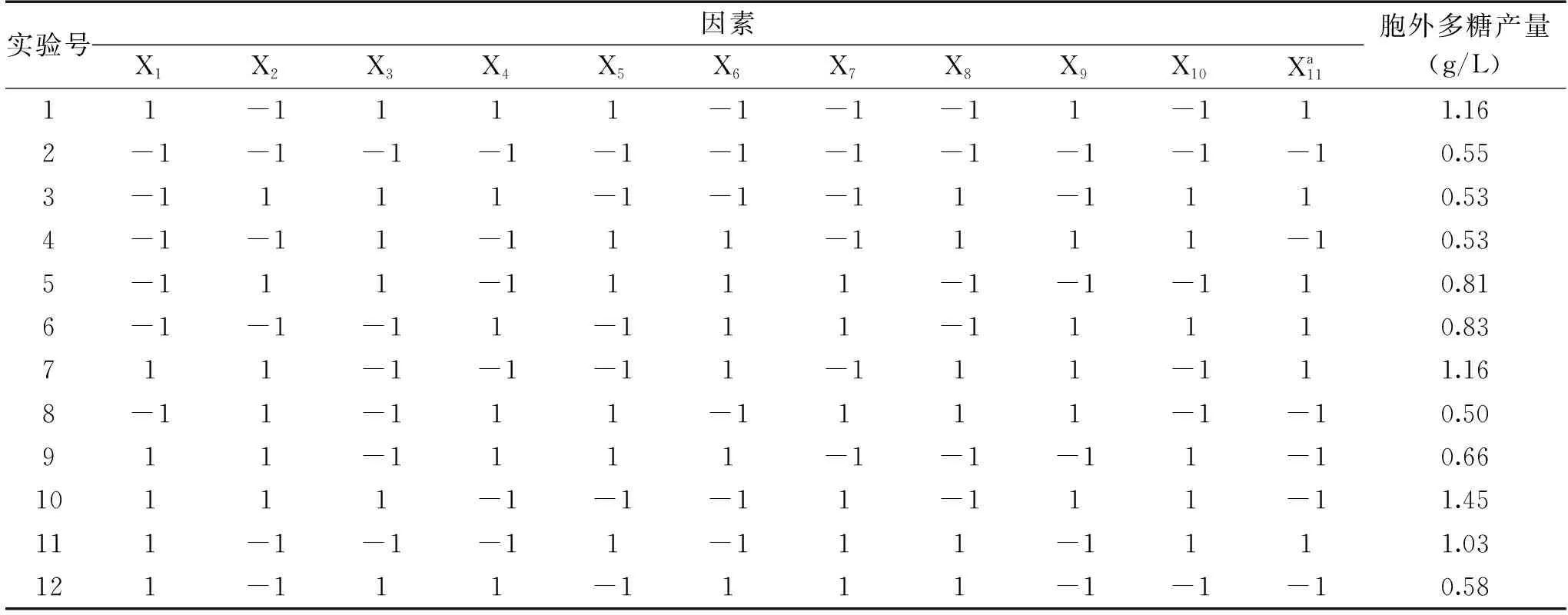
表3 Plackett-Burman实验设计和实验结果 表3 Plackett-Burman design and results
通过分析结果可得最优回归方程为:
Y=0.8156+0.0467X1-0.0106X2-0.0861X3+0.0761X4+0.0278X5+0.0356X6-0.0817X7-0.2556X8-0.0028X9+0.0344X10


表4 胞外多糖产量回归方程方差分析Table 4 Analysis of variance for the exopolysaccharide regression model
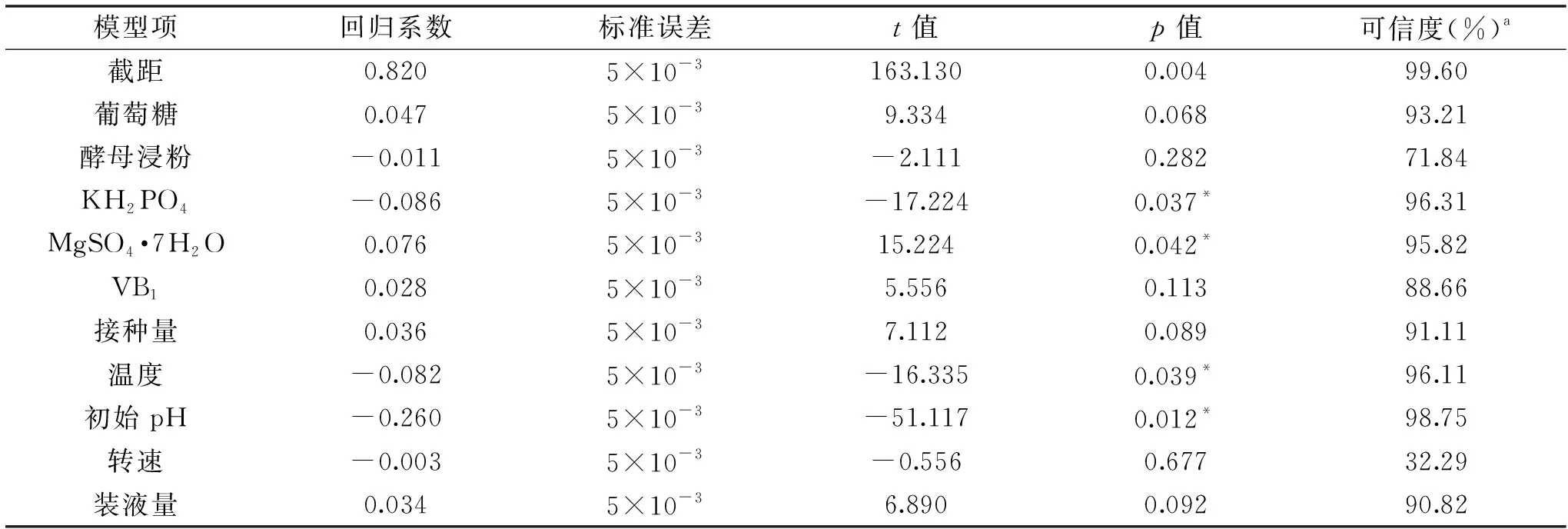
表5 模型偏回归系数与显著性检验Table 5 Regression coefficients and significance for the model
2.3 Box-Behnken实验设计结果及分析
根据4因素3水平的响应面实验设计,共设立29个实验点,Box-Behnken实验设计及响应值见表6。
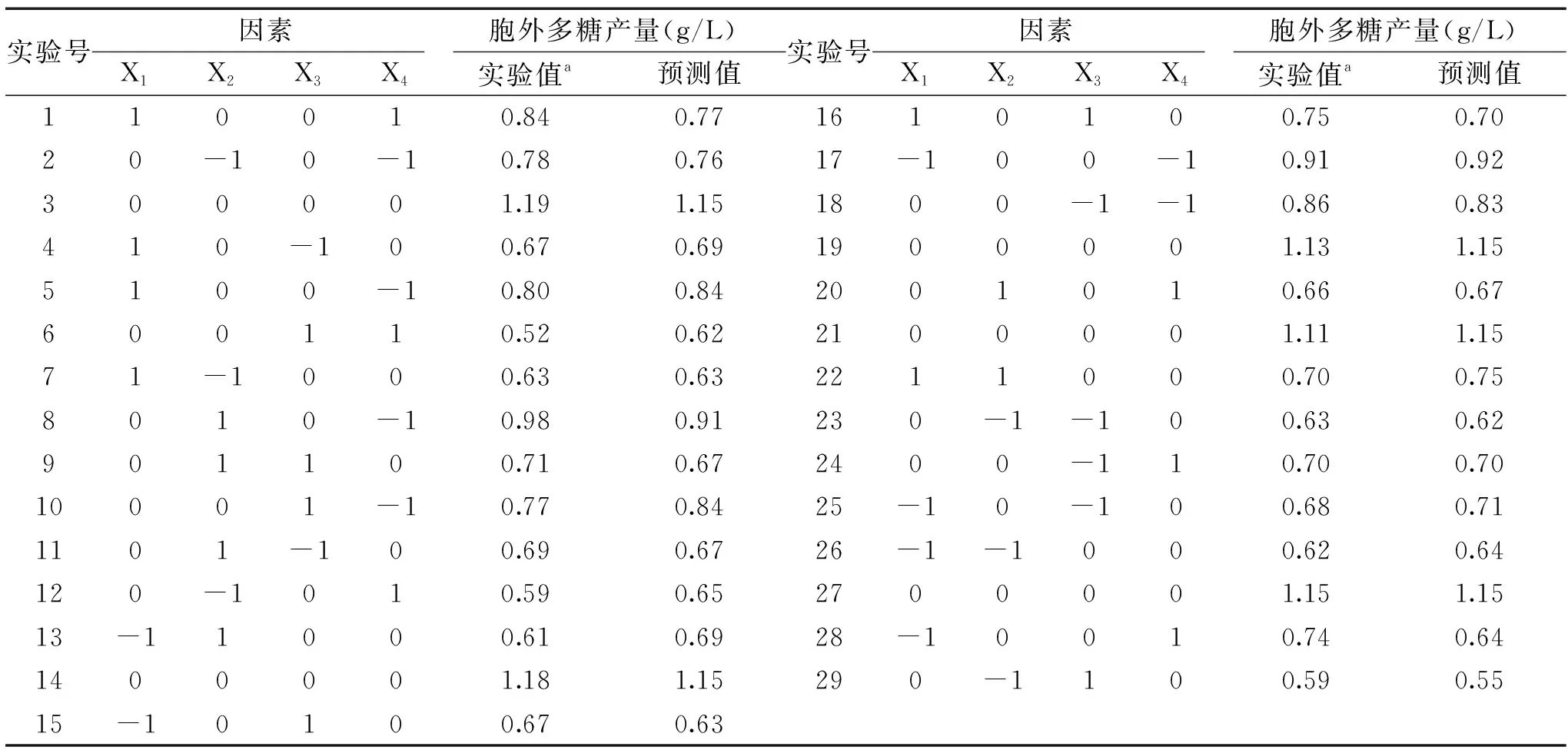
表6 Box-Behnken实验设计和实验结果Table 6 Box-Behnken design and results
运用Design-Expert 8.0对表6的数据进行完全二次回归拟合,Box-Behnken实验设计回归分析结果见表7。回归方程如下:
回归方程的决定系数R2=0.9412,说明回归方程的拟合程度很好,预测值与实测值之间具有高度的相关性,偏差较小。p值常用来反映每个变量的显著性以及变量间的交互作用强弱[22],在α=0.01水平上回归模型高度显著(p<0.0001),而失拟项在α=0.05水平上不显著(p>0.05),表明可以利用该模型预测最优的樟芝液态发酵产胞外多糖条件。

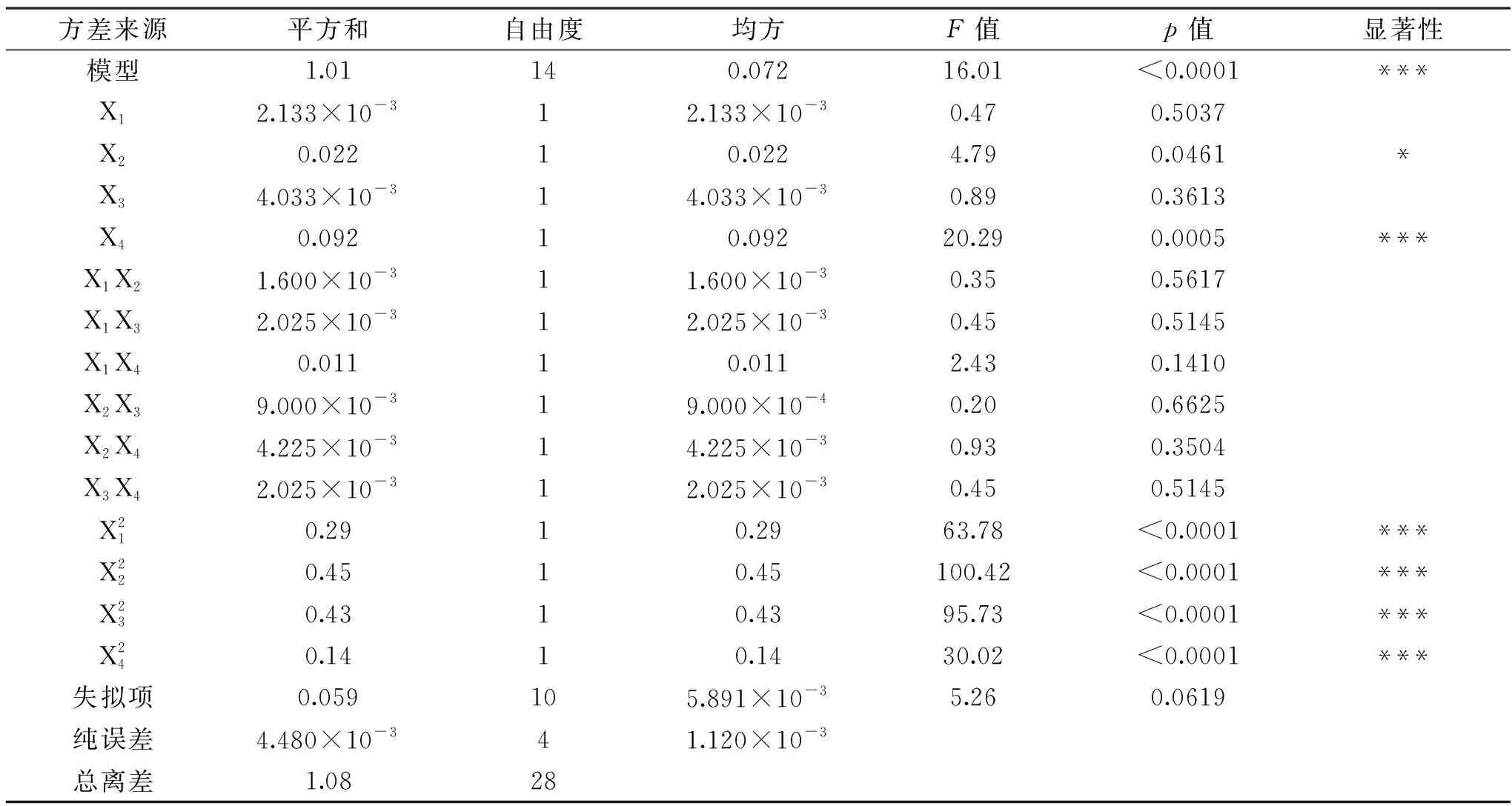
表7 胞外多糖产量回归方程方差分析Table 7 Analysis of variance for the exopolysaccharide regression model
由图12c、e及f可以看出培养温度与其他三种因素之间均有比较明显的交互作用,其交互作用的强弱顺序为:X1X4>X2X4>X3X4。拟合曲面均为凸形有最大值,通过Design Expert 8.06软件求解方程,得出预测的最优条件为KH2PO40.75 g/L,MgSO4·7H2O 0.77 g/L,初始pH=4.95,培养温度27.06 ℃,在该条件下樟芝液态发酵胞外多糖产量最高,预测产量为1.17 g/L。考虑实际操作,将拟合的最优条件修正为pH=5.0,培养温度27 ℃,KH2PO40.75 g/L,MgSO4·7H2O 0.77 g/L。为检验结果的可信度,采用修正后的条件进行验证实验,测得胞外多糖产量为1.23 g/L(结果为3次重复实验平均值),与模型预测值偏差-4.9%,二者基本吻合,具有良好的拟合性,优化模型可靠。该优化结果比优化前(0.72 g/L)提升了71%,比已有研究结果(0.49 g/L)[12]高出1.51倍,在摇瓶阶段达到一个相对较高产量。同时相比麦芽膏、玉米浆粉等[11,24-25]常规碳氮源,本文以葡萄糖和酵母浸粉为碳氮源,不仅产量上有大幅提升,而且发酵液本身不含多糖,保证了最终发酵液中所含多糖为樟芝真菌本身合成所得,结果更为准确。并且对胞外多糖的单糖组成分析发现优化前后单糖组成一致,没有差异,这也说明了该工艺方法可靠可行,同时也可为其他菌株液态发酵法合成胞外多糖的研究提供参考。
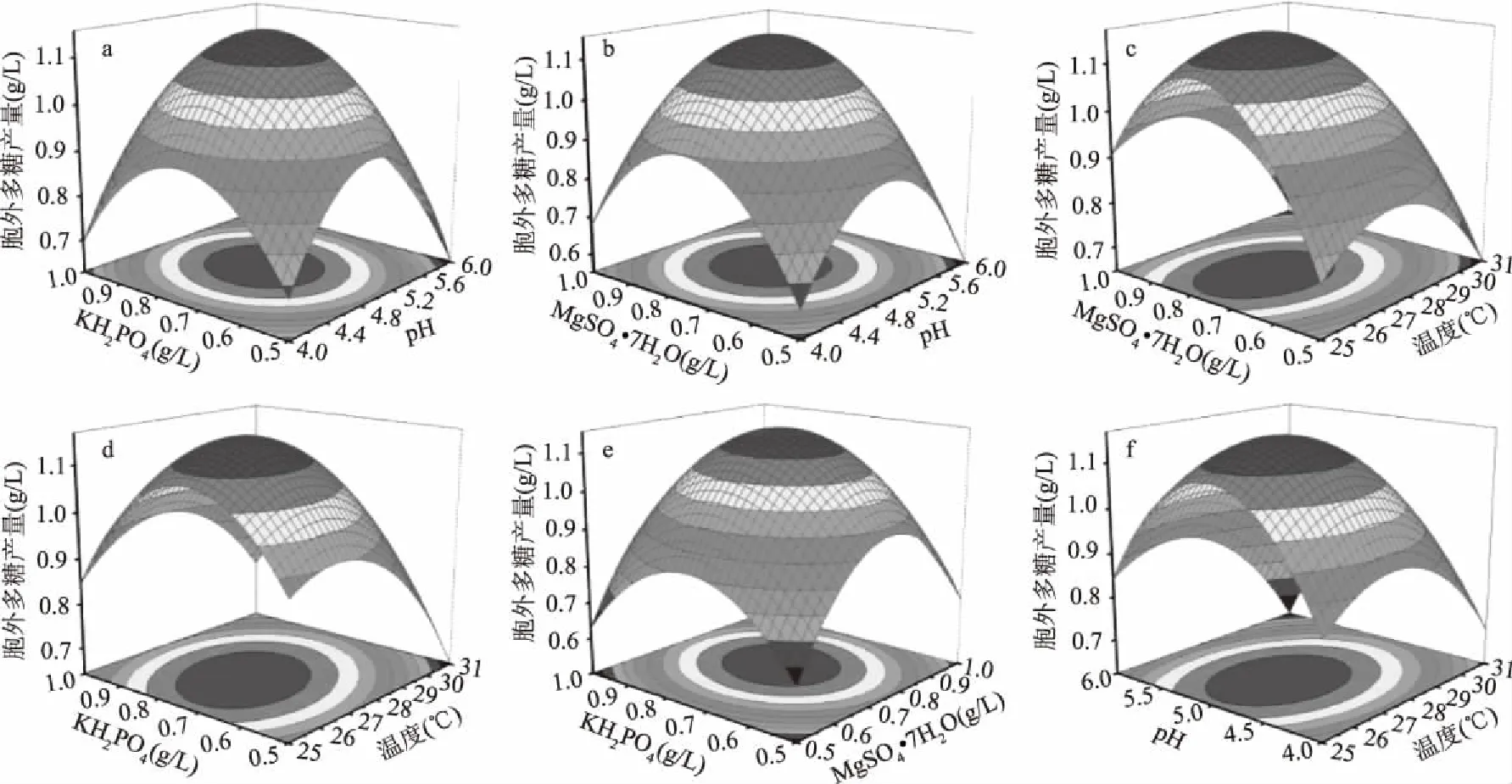
图12 各因素间交互作用影响胞外多糖产量的响应曲面及其等高线图Fig.12 Response surface and respective contour plot of the mutual functions among the yield factors of A. camphorate exopolysaccharide注:a~f分别为KH2PO4与pH,MgSO4·7H2O与pH,MgSO4·7H2O与温度,KH2PO4与MgSO4·7H2O,KH2PO4与温度,pH与温度。
3 结论
为提高樟芝胞外多糖的产量,同时利于胞外多糖的分离纯化,本文对樟芝的液态发酵条件进行了深入探索。首先对碳氮源进行了初选,发现葡萄糖和酵母浸粉最好,并且酵母浸粉作为最为适合樟芝液态发酵胞产外多糖的氮源的同时,其本身不含多糖,避免了培养基所含多糖对发酵所产胞外多糖含量及进一步分离纯化的影响。其次,在单因素实验的基础上,设计了Plackett-Burman实验,结果表明初始pH、KH2PO4浓度、温度、MgSO4·7H2O浓度对胞外多糖产量影响显著(p<0.05)。结合上述结果进一步采用四因素三水平的Box-Behnken设计模型进行响应面实验,得到最佳发酵条件为:葡萄糖60 g/L、酵母浸粉16 g/L、维生素B11 g/L、KH2PO40.75 g/L、MgSO4·7H2O 0.77 g/L、初始pH=5.0、装液量120 mL/500 mL、接种量18%、27 ℃、10 d、100 r/min。该条件下培养胞外多糖产量为1.23 g/L,较优化前有大幅提升,可为樟芝液态发酵产胞外多糖的工业化应用提供一定的参考。
[1]Chiu HH. Phylogenetic analysis ofAntrodiaspeciesandAntrodiacamphoratainferred from internal transcribed spacer region[J]. Antonie van Leeuwenhoek,2007,91(3):267-76.
[2]邢宏博,胡永丹,吕俊,等. 樟芝活性代谢产物的研究进展[J]. 生物加工过程,2017,15(4):1-8.
[3]Cheng PC,Hsu CY,Chen CC,et al.Invivoimmunomodulatory effects ofAntrodiacamphoratapolysaccharides in a T1/T2 doubly transgenic mouse model for inhibiting infection ofSchistosomamansoni[J]. Toxicology and Applied Pharmacology,2008,227(2):291-8.
[4]Chen YJ,Cheng PC,Lin CN,et al. Polysaccharides fromAntrodiacamphoratamycelia extracts possess immunomodulatory activity and inhibits infection ofSchistosomamansoni[J]. International Immunopharmacology,2008,8(3):458-67.
[5]Han HF,Nakamura N,Zuo F,et al. Protective Effects of a neutral polysaccharide isolated from the mycelium ofAntrodiacinnamomeaon propionibacterium acnes and lipopolysaccharide induced hepatic injury in mice[J]. Chemical and Pharmaceutical Bulletin,2006,50(4):496-500.
[6]Liu JJ,Huang TS,Hsu ML,et al. Antitumor effects of the partially purified polysaccharides fromAntrodiacamphorataand the mechanism of its action[J]. Toxicology and Applied Pharmacology,2004,201(2):186-93.
[7]Yang CM,Zhou YJ,Wang RJ,et al. Anti-angiogenic effects and mechanisms of polysaccharides fromAntrodiacinnamomeawith different molecular weights[J]. Journal of Ethnopharmacology,2009,123(3):407-12.
[8]Lu MK,Lin TY,Hu CH,et al. Characterization of a sulfated galactoglucan fromAntrodiacinnamomeaand its anticancer mechanism via TGFβ/FAK/Slug axis suppression[J]. Carbohydrate Polymers,2017,167(2):229-39.
[9]Shih IL,Pan K,Hsieh C. Influence of nutritional components and oxygen supply on the mycelial growth and bioactive metabolites production in submerged culture ofAntrodiacinnamomea[J]. Process Biochemistry,2006,41(5):1129-35.
[10]Lin ES,Chen YH. Factors affecting mycelial biomass and exopolysaccharide production in submerged cultivation ofAntrodiacinnamomeausing complex media[J]. Bioresource Technology,2007,98(13):2511-7.
[11]Shu CH,Lung MY. Effect of pH on the production and molecular weight distribution of exopolysaccharide byAntrodiacamphoratain batch cultures[J]. Process Biochemistry,2004,39(8):931-7.
[12]Lin ES,Sung SC. Cultivating conditions influence
exopolysaccharide production by the edible basidiomyceteAntrodiacinnamomeain submerged culture[J]. International Journal of Food Microbiology,2006,108(2):182-7.
[13]Singh SP,Bharali P,Konwar BK. Optimization of nutrient requirements and culture conditions for the production of rhamnolipid fromPseudomonasaeruginosa(MTCC 7815)using mesua ferrea seed oil[J]. Indian Journal of Microbiology,2013,53(4):467-76.
[14]Ravanfar R,Tamaddon AM,Niakousari M,et al. Preservation of anthocyanins in solid lipid nanoparticles:Optimization of a microemulsion dilution method using the Placket-Burman and Box-Behnken designs[J]. Food Chem,2016,199(6):573-80.
[15]Banik RM,Santhiagu A,Upadhyay SN. Optimization of nutrients for gellan gum production bySphingomonaspaucimobilisATCC-31461 in molasses based medium using response surface methodology[J]. Bioresource Technology,2007,98(4):792-7.
[16]botz DW. Experimental design for fermentation media development:Statistical design or global random search[J]. Journal of Bioscience and Bioengineering,2000,90(5):473-83.
[17]Rashid SS,Alam MZ,Karim MA,et al. Optimization of the nutrient supplients for cellulase production with the basal medium palm oil mill effluent[J]. World Academy of Science,Engineering and Technology,2009,60(6):809-15.
[18]王丽星,黄志伟,郑亚,等. 樟芝适宜的液体发酵培养基配方研究[J]. 江苏农业科学,2016,44(7):236-9.
[19]Chiang CC,Chiang BH. Processing characteristics of submerged fermentation ofAntrodiacinnamomeain airlift bioreactor[J]. Biochemical Engineering Journal,2013,73(2013):65-71.
[20]李莉,张赛,何强,等. 响应面法在实验设计与优化中的应用[J].实验室研究与探索,2015,34(8):41-5.
[21]冯美琴. 植物乳杆菌胞外多糖发酵、结构鉴定及其功能特性研究[D].南京:南京农业大学,2012.
[22]Liu JZ,Weng LP,Zhang QL,et al. Optimization of glucose oxidase production byAspergillusnigerin a benchtop bioreactor using response surface methodology[J]. World Journal of Microbiology & Biotechnology,2003,19(3):317-23.
[23]Tanyildizi MS,Özer D,Elibol M. Optimization ofα-amylase production byBacillussp. using response surface methodology[J]. Process Biochemistry,2005,40(7):2291-6.
[24]Yang FC,Huang HC,Yang MJ. The influence of environmental conditions on the mycelial growth ofAntrodiacinnamomeain submerged cultures[J]. Enzyme and Microbial Technology,2003,33(4):395-402.
[25]Lung MY,Lee CY,Chen WX,et al. Production of bioactive exopolysaccharides from bitter medicinal mushroom,Antrodiacamphorata(M. Zang et C.H. Su)Sh.H. Wu et al.(Aphyllophoromycetideae)in submerged cultivation[J]. Int J Med Mushrooms,2011,13(1):51-60.

