菱茎多酚的提取工艺及其抗氧化、抑菌活性研究
申 凯,张 辉,严碧云,王清章,王洪斌,陈 佳
(武昌工学院食品与环境工程学院,湖北武汉 430065)
多酚是高等植物重要的次级代谢产物,广泛分布于植物的各组织部位[1]。多酚因具有多种生物活性如抗氧化、抑菌、抗肿瘤、抗糖尿病和抗炎活性,而受到广泛关注[2-6]。近年来,从食品加工副产物或废弃物中获取天然多酚并将其开发成新的药物资源,引发了人们的强烈兴趣[7-10]。多酚常见的提取方法主要有亚临界水萃取[11]、超临界流体萃取[12]、加压流体萃取或加速溶剂萃取[13-14],而超声波辅助提取技术因其设备要求简单、成本低、效率高、对多酚的破坏程度低,而被广泛地运用于各种植物材料(叶、茎、果实和种子)的多酚提取[15]。
菱(TrapabispinosaRoxb.),一年生水生草本植物,其果实菱角兼具营养与药用保健价值,受到人们的喜爱,是我国著名的水生蔬菜[16]。大量的菱壳和菱茎通常被作为废弃物处理,仅有少量的用作肥料或燃料。研究表明,菱壳多酚表现出显著的抑菌、降血糖、抗炎、抗氧化和抗癌活性[17]。最新研究表明,菱茎多糖也具良好的抗氧化活性[18]。然而,关于菱茎多酚的提取和生物活性方面的研究尚未见报道。
本研究以菱茎为实验材料,以超声波为辅助提取手段,采用正交实验优化多酚的提取工艺,并测定菱茎多酚体外抗氧化和抑菌能力,以期为菱茎多酚的有效开发利用提供理论依据。
1 材料与方法
1.1 材料与仪器
菱茎 采自湖北洪湖,整理洗净,切成约5 cm长度,冷冻干燥后粉碎至60 目,置于-20 ℃下保存备用;供试微生物金黄色葡萄球菌、蜡样芽胞杆菌、大肠杆菌、腐败希瓦氏菌、青霉和酿酒酵母 中国典型培养物保藏中心;没食子酸(Gallic acid)、维生素E(VE)、L-抗坏血酸(VC)、Folin-Ciocalteu试剂、1,1-二苯基-2-三硝基苯肼(DPPH)、2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS)、2,4,6-三吡啶基三嗪(TPTZ) Sigma试剂有限公司;氨苄青霉素、两性霉素B标准品 美国Amresco公司;乙醇、醋酸钠、过硫酸钾、三氯化铁、乙酸 均为分析纯,国药集团化学试剂有限公司;营养肉汤、马铃薯葡萄糖琼脂(PDA)培养基 北京陆桥技术有限公司。
LGJ-30F冷冻干燥机 北京松源华兴科技发展有限公司;SPX-250B型生化培养箱 天津市泰斯特仪器有限公司;SB-5200DNT超声波清洗仪 宁波新芝生物科技股份有限公司;PHS-25型pH计 上海虹益仪器仪表有限公司;UV-1800紫外-可见分光光度计 日本岛津有限公司;ME104电子天平 梅特勒-托利多仪器上海有限公司;SHB-Ⅲ循环水式多用真空泵 郑州长城科工贸有限公司;RE52型旋转蒸发仪 上海亚荣生化仪器厂。
1.2 实验方法
1.2.1 单因素实验 多酚提取工艺流程:准确称取菱茎粉末1.0 g于100 mL三角瓶中,加入已调节pH的乙醇水溶液,置于一定温度超声波清洗仪(500 W,40 kHz,由预实验得)中水浴超声提取,提取结束后迅速抽滤,滤液用相应的乙醇溶液定容至50 mL,吸取1.0 mL提取滤液,稀释适宜倍数后用于多酚含量的测定。按照该工艺流程依次考察乙醇浓度(v/v)、pH、提取温度、提取时间、料液比(g/mL)对菱茎多酚提取得率的影响。单因素实验设计如表1所示:

表1 菱茎多酚单因素实验设计Table 1 Single-factor experiment for extraction of polyphenols from stems of Trapa bispinosa Roxb
1.2.2 正交实验 根据单因素实验结果,以多酚提取得率为评价指标,按表2所示正交表 L16(45)设计正交实验。
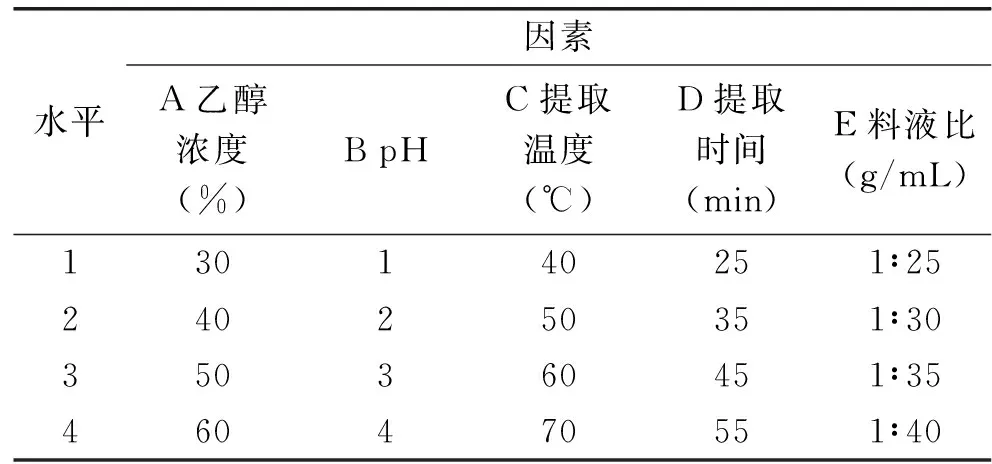
表2 菱茎多酚提取正交实验因素水平表Table 2 Factors and levelsTable of orthogonal array design for extraction of polyphenols from stems of Trapa bispinosa Roxb
1.2.3 多酚含量的测定 多酚含量测定采用Folin-Ciocalteu法[19]。准确吸取50 μL多酚提取液,加入450 μL蒸馏水和2.5 mL浓度为0.2 mol/L的Folin-Ciocalteu试剂,摇匀后反应5 min,加入2 mL饱和碳酸钠溶液(75 g/L),摇匀后在30 ℃下反应1.5 h,在765 nm处测定吸光值。以80%甲醇溶液配置浓度为0~500 μg/mL的没食子酸标准溶液,按同样方法建立多酚含量测定的标准曲线(y=0.001x+0.0217,R2=0.9992),根据标准曲线计算提取液中多酚的含量,多酚提取得率以每克菱茎干粉末中所含相当于没食子酸量的毫克数表示(mg GAE/g DW)。
1.2.4 菱茎多酚的抗氧化活性测定
1.2.4.1 对DPPH自由基清除力的测定 参考文献方法[20]:准确吸取0.1 mL待测液,加入3.0 mL的 0.004%DPPH甲醇溶液,摇匀后避光反应30 min,在517 nm处测定吸光值。空白对照为甲醇,阳性对照为VC和VE溶液。样品液对DPPH自由基的清除率按公式(1)计算,同时计算样品液对DPPH自由基的半清除浓度(IC50)。
自由基清除率(%)=(1-A实验组/A空白对照)×100
式(1)
1.2.4.2 对ABTS自由基清除力的测定 参考文献方法[21]:分别将0.0384 g的ABTS与0.0134 g的过硫酸钾溶于10 mL蒸馏水,将两者按体积比1∶1混合均匀,避光反应16 h得到ABTS自由基母液,使用之前以80%乙醇稀释至在波长734 nm处吸光值为0.700±0.050,得到ABTS自由基工作液;准确吸取0.1 mL待测样品液,加入3.9 mL ABTS自由基工作液,摇匀后静置反应6 min,在734 nm处测定吸光值。空白对照为80%乙醇水溶液,阳性对照为VC和Ve溶液。按(1)式计算样品液对ABTS自由基的清除率,并计算半清除浓度(IC50)。
1.2.4.3 对Fe3+还原力的测定 还原力的测定采用FRAP法[22]:将300 mmol/L、pH3.6的NaAc-HAc缓冲液,10 mmol/L的TPTZ溶液和20 mmol/L的FeCl3溶液按体积比10∶1∶1混匀得到FRAP试剂;准确吸取0.1 mL待测样品液,加入3.0 mL现配的FRAP试剂,混匀后在25 ℃水浴下反应5 min,在 593 nm处测定吸光值,空白样为蒸馏水,阳性对照为VC和Ve溶液。使593 nm处吸光值达到0.5时的样品液浓度为菱茎多酚还原力的IC50值[23]。
1.2.5 菱茎多酚的抑菌活性测定 金黄色葡萄球菌、蜡样芽孢杆菌、大肠杆菌、腐败希瓦氏菌于营养肉汤培养基中37 ℃下培养24 h,使用前在相同培养条件下在试管斜面上活化培养24 h,青霉、酿酒酵母于PDA培养基中28 ℃下培养48 h,使用前在相同培养条件下在试管斜面活上化培养48 h,抑菌实验前调节菌悬液浓度为106~107CFU/mL。
抑菌实验采用滤纸片扩散法[24-25]。用DMSO 溶解样品,采用二倍稀释法配制系列质量浓度的菱茎多酚样品液。准确吸取100 μL菌悬液均匀涂布于平皿培养基上,在培养基上等间距平铺4片已灭菌直径为6 mm的滤纸片,其中3片滴加10 μL经0.22 μm无菌滤头处理的样品液,另1片滴加等量的DMSO或阳性对照液;阳性对照为10.0 μg/mL的氨苄青霉素和1.0 mg/mL的两性霉素B。细菌于37 ℃下培养24 h,真菌于28 ℃下培养48 h,采用十字交叉法量取抑菌圈直径(包括滤纸片直径)。观察菌落生长情况,存在抑菌圈的最低样品液浓度即为最低抑菌浓度MIC(mg/mL)。
1.3 数据处理与统计分析
采用Excel进行初步数据处理,采用Origin 8.0软件进行显著性分析和图表制作。实验均重复3次。
2 结果与分析
2.1 单因素实验
2.1.1 乙醇浓度对菱茎多酚提取的影响 多酚物质是一类极性较大的化合物,在乙醇中加入一定的水有利于多酚的溶出。如图1所示,随着乙醇浓度的增大,多酚提取得率呈现先增大后减小趋势;当乙醇浓度由20%增加到50%,多酚提取得率显著(p<0.05)增加,在乙醇浓度为50%时,多酚提取得率达到最大值37.17 mg GAE/g DW;随着乙醇浓度的继续增加,多酚提取得率显著(p<0.05)下降,当乙醇浓度增加到80%,多酚提取得率降低至26.97 mg GAE/g DW。这是由于乙醇浓度达到50%,继续增加乙醇浓度,菱茎中其他醇溶性杂质的浸出效率也随之增加,杂质与多酚物质的竞争加强,从而使多酚物质的提取得率下降。故后续实验的乙醇浓度选定为50%。

图1 乙醇浓度对菱茎多酚提取得率的影响Fig.1 Effects of ethanol concentration on extraction yield of polyphenols from stems of Trapa bispinosa Roxb.注:不同小写英文字母表示提取得率 在0.05水平具有显著差异(p<0.05);图2~图5同。
2.1.2 pH对菱茎多酚提取的影响 植物组织内多酚物质一部分以游离形式存在于液泡中,一部分与蛋白质及多糖通过氢键或疏水键结合于细胞壁中,而酸性条件有利于结合酚的释放[26]。如图2所示,随着pH的增加,多酚提取得率呈现先增加后下降的趋势,当pH为2时,提取得率达到最大值35.82 mg GAE/g DW,显著(p<0.05)高于pH为1时的提取得率;随着pH的继续增加,多酚提取得率明显(p<0.05)下降,当pH为6时,多酚提取得率下降至最小值25.77 mg GAE/g DW,表明pH为2最有利于菱茎多酚的溶出。因此,后续提取液pH选定为2。
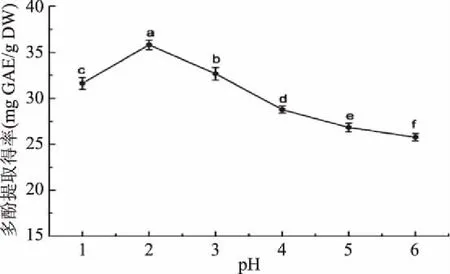
图2 提取剂pH对菱茎多酚提取得率的影响Fig.2 Effects of pH value on extraction yield of polyphenols from stems of Trapa bispinosa Roxb.
2.1.3 提取温度对菱茎多酚提取的影响 由图3可知,随着温度的升高,菱茎多酚提取得率几乎呈线性增加,当提取温度达到60 ℃时,提取得率达到最大值47.07 mg GAE/g DW,说明菱茎多酚具有较好的耐高温性,当提取温度升至70 ℃,多酚提取得率显著(p<0.05)下降,但仍显著(p<0.05)高于20 ℃时的提取得率34.62 mg GAE/g DW。原因在于升高温度虽然可促进分子的热运动,增大菱茎多酚的溶出率,但提取温度过高也会导致菱茎多酚的氧化与降解[27]。因此,后续实验的提取温度选定为60 ℃。

图3 提取温度对菱茎多酚提取得率的影响Fig.3 Effects of temperature on extraction yield of polyphenols from stems of Trapa bispinosa Roxb.
2.1.4 提取时间对菱茎多酚提取的影响 如图4所示,随提取时间的增加,多酚提取得率呈先增加后减小的变化趋势,当提取时间为25 min时,提取得率达到最大值46.02 mg GAE/g DW;超过25 min,多酚提取得率显著(p<0.05)下降,提取时间延长至55 min时,提取得率降至最低值27.42 mg GAE/g DW。分析认为,提取时间较短时,随着时间的延长,多酚的溶出率增加,使得多酚提取得率增大,但时间过长,已溶出的多酚物质易因长时间暴露在空气中而发生氧化与降解,且长时间的超声处理本身也可能会导致多酚化学结构一定程度的破坏[28-29]。因此,后续实验中菱茎多酚超声提取时间选定为25 min。

图4 提取时间对菱茎多酚提取得率的影响Fig.4 Effects of time on extraction yield of polyphenols from stems of Trapa bispinosa Roxb.
2.1.5 料液比对菱茎多酚提取的影响 由图5可知,随着料液比由1∶10增加到1∶35,多酚提取得率逐步增加,在料液比为1∶35时达到最大值46.92 mg GAE/g DW,当料液比超过1∶35时,菱茎多酚的提取得率反而呈现下降趋势。分析可能是由于液料比较小时,提取剂与菱茎粉末颗粒没有达到充分接触,而液料比的增加会促进乙醇溶液主体与菱茎颗粒内部多酚液的浓度差,进而促进多酚提取得率的增大,但当液料比过大时,会导致菱茎颗粒内部多糖等杂质的竞争性溶出,造成菱茎多酚提取得率的降低[30]。因此,菱茎多酚提取的饱和料液比在1∶35左右。

图5 料液比对菱茎多酚提取得率的影响Fig.5 Effects of solid-to-liquid ratio on extraction yield of polyphenols from stems of Trapa bispinosa Roxb.
2.2 正交实验
以乙醇浓度、pH、提取温度、提取时间、料液比为考察因素,以多酚提取得率为指标,进行5因素4水平正交实验,优化菱茎多酚的提取工艺,实验结果见表3。

表3 菱茎多酚提取正交实验设计及结果Table 3 Orthogonal array design with experimental results for extraction of polyphenols from stems of Trapa bispinosa Roxb.
由表3的极差分析可知,影响菱茎多酚提取的各因素主次顺序为C>B>E>A>D,即提取温度>pH>料液比>乙醇浓度>提取时间。由k值分析可得出最佳因素组合为A4B1C4D2E3,即乙醇浓度60%、pH为1、提取温度为70 ℃、提取时间为35 min、料液比为1∶35,该最佳因素组合恰好在正交表中,且显著(p<0.05)高于任何一个因素组合。按正交所得最佳提取工艺条件,进行5次重复提取实验,得到菱茎多酚的平均提取得率为67.31 mg GAE/g DW,说明由正交实验得到的最佳提取工艺条件是可行的,菱茎多酚的提取得到了优化。在最佳提取工艺条件下得到的菱茎多酚提取液经冷冻干燥用于后续的抗氧化、抑菌实验。
2.3 菱茎多酚的抗氧化活性
2.3.1 对DPPH自由基的清除力 由图6可知,随菱茎多酚质量浓度的增加,DPPH自由基的清除率不断升高,在10~80 μg/mL浓度范围,DPPH清除力几乎与阳性对照的VE相当,在浓度为640 μg/mL时对DPPH的清除率高达90.56%,在测定条件下,清除一半DPPH自由基所需的浓度(IC50)为228.34 μg/mL(y=0.169x+11.41,R2=0.980)。虽然弱于阳性对照组,但仍表现出较强的DPPH清除能力,且多酚样品浓度与DPPH清除率呈现明显的量效关系。

图6 菱茎多酚对DPPH自由基的清除力Fig.6 DPPH radical scavenging capacity of polyphenols from stems of Trapa bispinosa Roxb.
2.3.2 对ABTS自由基的清除力 菱茎多酚对ABTS自由基的清除能力结果见图7。可知,随菱茎多酚浓度的增加,对ABTS自由基的清除率也不断升高,在浓度为640 μg/mL时对自由基的清除率高达94.63%。在测定条件下,其IC50值为220.57 μg/mL(y=0.187x+8.753,R2=0.996),表明菱茎多酚具有较强的ABTS自由基清除能力,且多酚质量浓度与ABTS自由基清除力呈现明显的量效关系。

图7 菱茎多酚对ABTS自由基的清除能力Fig.7 ABTS radical scavenging capacity of polyphenols from stems of Trapa bispinosa Roxb.
2.3.3 FRAP还原力分析 FRAP反应的是抗氧化剂对Fe3+的还原能力。菱茎多酚的还原能力结果见图8,可知,随着菱茎多酚质量浓度的增加,其总还原力呈线性增强,当浓度为640 μg/mL时,在593 nm处的吸光值高达1.99,在测定条件下使A593达到0.5时所需的浓度(IC50)为152.00 μg/mL(y=0.003x+0.044,R2=0.995),稍弱于阳性对照的VE(IC50为151.12 μg/mL),说明菱茎多酚具有良好的还原能力,且多酚样品浓度与总还原能力呈现明显的量效关系。

图8 菱茎多酚对铁离子的还原能力Fig.8 FRAP capacity of polyphenols from stems of Trapa bispinosa Roxb.
2.4 菱茎多酚的抑菌效果
菱茎多酚对6种典型腐败微生物生长的抑制作用结果见表4和表5。由表4可知,菱茎多酚对大肠杆菌、腐败希瓦氏菌、青霉菌、酿酒酵母菌的生长抑制作用显著(p<0.05)。样品质量浓度为25 mg/mL时,平均抑菌圈直径分别为17.17、16.25、14.00、14.33 mm,与阳性对照相当;对金黄色葡萄球菌、蜡样芽胞杆菌的生长具有较好的抑制作用,抑菌圈直径分别为7.83、9.04 mm。对6种菌的抑菌圈直径均随着样品浓度的降低而减小,说明多酚质量浓度与抑菌效果呈现一定的剂量效应关系。由表5可知,菱茎多酚对供试菌的最低抑菌浓度(MIC)大小关系依次为金黄色葡萄球菌>蜡样芽胞杆菌>青霉菌>酿酒酵母菌>腐败西瓦氏菌>大肠杆菌。

表4 菱茎多酚对供试菌的抑菌效果Table 4 Inhibitory effect of polyphenols from stems of Trapa bispinosa Roxb. on the tested microorganisms

表5 菱茎多酚的最低抑菌浓度(MIC)Table 5 Minimum inhibitory concentration(MIC)of the polyphenols from stems of Trapa bispinosa Roxb.
可得出,菱茎多酚对革兰氏阴性菌、霉菌和酵母菌均有强抑制作用,而对革兰氏阳性菌的抑制作用较温和。
在菱壳抑菌活性研究中,Yu和Shen的结果认为菱壳多酚提取物对革兰氏阳性菌有较强抑制作用,对革兰氏阴性菌具有一定的抑制作用,而对真菌的抑制作用不明显[31]。分析可能是由于菱茎、菱壳中抑菌成分存在差异性或对微生物的作用机制不同,可在后续实验中作进一步探究。另外,实验结果也说明菱茎多酚和菱壳多酚提取物存在一定的抑菌互补性,因此可将菱茎、菱壳混合使用,以得到更好的抑菌效果。
3 结论
采用超声波辅助提取菱茎多酚,通过单因素和正交实验,得到菱茎多酚的最佳提取工艺条件:乙醇浓度60%、pH1、提取温度70 ℃、提取时间35 min、料液比1∶35。在此工艺条件下多酚提取得率达到67.31 mg GAE/g DW。菱茎多酚对DPPH、ABTS自由基的IC50值分别为228.34 μg/mL和220.57 μg/mL,FRAP还原力的IC50值为152.00 μg/mL;对金黄色葡萄球菌、蜡样芽孢杆菌、大肠杆菌、腐败希瓦氏菌、青霉和酿酒酵母的最小抑菌浓度(MIC)分别为6.25、3.13、0.20、0.39、1.56和0.78 mg/mL。菱茎是良好的天然植物多酚来源材料,菱茎多酚具有良好的抗氧化和抑菌活性。但菱茎多酚的分离纯化、结构鉴定、功能稳定性、抑菌机制及其它生物活性还有待作进一步探究。本文首次研究菱茎多酚的提取工艺、抗氧化和抑菌活性,为菱茎多酚开发为天然抗氧化剂和抑菌剂提供一定的理论依据和参考。
[1]Ananga A,Georgiev V,Tsolova V. Manipulation and engineering of metabolic and biosynthetic pathway of plant polyphenols[J]. Current Pharmaceutical Design,2013,19(34):6186-6206.
[2]Vijayalaxmi S,Jayalakshmi S K,Sreeramulu K. Polyphenols from different agricultural residues:extraction,identification and their antioxidant properties[J]. Journal of Food Science and Technology,2015,52(5):2761-2769.
[3]Zhou W,Xie H,Xu X,et al. Phenolic constituents fromIsodonlophanthoidesvar. graciliflorus and their antioxidant and antibacterial activities[J]. Journal of Functional Foods,2014,6:492-498.
[4]Yi J,Wang Z,Bai H,et al. Optimization of purification,identification and evaluation of theinvitroantitumor activity of polyphenols from pinus koraiensis pinecones[J]. Molecules,2015,20(6):10450-10467.
[5]Onishi S,Nishi K,Yasunaga S,et al. Nobiletin,a polymethoxy flavonoid,exerts anti-allergic effect by suppressing activation of phosphoinositide 3-kinase[J]. Journal of Functional Foods,2014,6:606-614.
[6]Nahar P P,Driscoll M V,Li L,et al. Phenolic mediated anti-inflammatory properties of a maple syrup extract in RAW 264.7 murine macrophages[J]. Journal of Functional Foods,2014,6:126-136.
[7]Gómez-García R,Martínez-ávila G C G,Aguilar C N. Enzyme-assisted extraction of antioxidative phenolics from grape(VitisviniferaL.)residues[J]. 3 Biotech,2012,2(4):297-300.
[8]Sarkis J R,Michel I,Tessaro I C,et al. Optimization of phenolics extraction from sesame seed cake[J]. Separation and Purification Technology,2014,122:506-514.
[9]Machado A P D F,Pasquel-Reátegui J L,Barbero G F,et al. Pressurized liquid extraction of bioactive compounds from blackberry(RubusfruticosusL.)residues:a comparison with conventional methods[J]. Food Research International,2015,77:675-683.
[10]Deng J,Liu Q,Zhang C,et al. Extraction optimization of polyphenols from waste kiwi fruit seeds(ActinidiaChinensisPlanch.)and evaluation of its antioxidant and anti-inflammatory properties[J]. Molecules,2016,21(7):832.
[11]Rangsriwong P,Rangkadilok N,Satayavivad J,et al. Subcritical water extraction of polyphenolic compounds from Terminalia chebula Retz. fruits[J]. Separation and Purification Technology,2009,66(1):51-56.
[12]Ghafoor K,Park J,Choi Y H. Optimization of supercritical fluid extraction of bioactive compounds from grape(VitislabruscaB.)peel by using response surface methodology[J]. Innovative Food Science & Emerging Technologies,2010,11(3):485-490.
[13]Carabias-Martínez R,Rodríguez-Gonzalo E,Revilla-Ruiz P,et al. Pressurized liquid extraction in the analysis of food and biological samples[J]. Journal of Chromatography A,2005,1089(1):1-17.
[14]Barros F,Dykes L,Awika J M,et al. Accelerated solvent extraction of phenolic compounds from sorghum brans[J]. Journal of Cereal Science,2013,58(2):305-312.
[15]Dai J,Mumper R J. Plant phenolics:extraction,analysis and their antioxidant and anticancer properties[J]. Molecules,2010,15(10):7313-7352.
[16]Chiang P Y,Li P H,Huang C C,et al. Changes in functional characteristics of starch during water caltrop(TrapaQuadrispinosaRoxb.)growth[J]. Food Chemistry,2007,104(1):376-382.
[17]Zhu F. Chemical composition,health effects,and uses of water caltrop[J]. Trends in Food Science & Technology,2016,49:136-145.
[18]Raza A,Li F,Xu X,et al. Optimization of ultrasonic-assisted extraction of antioxidant polysaccharides from the stem ofTrapaquadrispinosausing response surface methodology[J]. International Journal of Biological Macromolecules,2017,94:335-344.
[19]Tawaha K,Alali F Q,Gharaibeh M,et al. Antioxidant activity and total phenolic content of selected Jordanian plant species[J]. Food Chemistry,2007,104(4):1372-1378.
[20]Brand-Williams W,Cuvelier M E,Berset C. Use of a free radical method to evaluate antioxidant activity[J]. LWT-Food Science and Technology,1995,28(1):25-30.
[21]Cai Y,Luo Q,Sun M,et al. Antioxidant activity and phenolic compounds of 112 traditional Chinese medicinal plants associated with anticancer[J]. Life Sciences,2004,74(17):2157-2184.
[22]Benzie I F F,Strain J J. The ferric reducing ability of plasma(FRAP)as a measure of “antioxidant power”:the FRAP assay[J]. Analytical Biochemistry,1996,239(1):70-76.
[23]Oliveira I,Sousa A,Ferreira I C F R,et al. Total phenols,antioxidant potential and antimicrobial activity of walnut(JuglansregiaL.)green husks[J]. Food and Chemical Toxicology,2008,46(7):2326-2331.
[24]Bahadori M B,Valizadeh H,Asghari B,et al. Chemical composition and antimicrobial,cytotoxicity,antioxidant and enzyme inhibitory activities ofSalviaspinosaL[J]. Journal of Functional Foods,2015,18:727-736.
[25]Zaidan M R,Noor Rain A,Badrul A R,et al.Invitroscreening of five local medicinal plants for antibacterial activity using disc diffusion method[J]. Trop Biomed,2005,22(2):165-170.
[26]陈晨,胡文忠,田沛源,等. 超声辅助提取香蕉皮多酚工艺优化及其抗氧化性的分析[J].食品科学,2014,35(2):12-17.
[27]Boussetta N,Soichi E,Lanoisellé J L,et al. Valorization of oilseed residues:extraction of polyphenols from flaxseed hulls by pulsed electric fields[J]. Industrial Crops and Products,2014,52:347-353.
[28]Biesaga M,Pyrzyńska K. Stability of bioactive polyphenols from honey during different extraction methods[J]. Food Chemistry,2013,136(1):46-54.
[29]Carrera C,Ruiz-Rodríguez A,Palma M,et al. Ultrasound assisted extraction of phenolic compounds from grapes[J]. Analytica Chimica Acta,2012,732:100-104.
[30]Altemimi A,Watson D G,Kinsel M,et al. Simultaneous extraction,optimization,and analysis of flavonoids and polyphenols from peach and pumpkin extracts using a TLC-densitometric method[J]. Chemistry Central Journal,2015,9(1):1-15.
[31]Yu H,Shen S. Phenolic composition,antioxidant,antimicrobial and antiproliferative activities of water caltrop pericarps extract[J]. LWT-Food Science and Technology,2015,61(1):238-243.

