超声介入联合化疗对中央型肺癌伴脑转移患者肿瘤标志物和生存期的影响
任辉,申纪锐
(聊城市第三人民医院超声科,山东 聊城 252000)
中央型肺癌是目前临床上常见的恶性肿瘤,数据显示,其发病率和死亡率呈现逐年递增趋势,且中晚期中央型肺癌患者放疗和化疗的有效率最高不过40%,生存率低,严重威胁人类的生命健康[1]。相关文献[2-3]报道显示,肺癌患者预后不良的主要因素之一是局部复发或远处转移,而脑转移的发生率高达25%,通常发生脑转移的肺癌患者生存期仅为1~2个月。然而,对于一些一般状况良好但发生脑转移的患者采用必要的治疗显得极为重要。而超声介入治疗联合化疗作为一种新型的治疗方法,在高温环境中促使细胞热凝固组织的死亡,对肿瘤生长的抑制具有重要作用[4]。因此,本文旨在探讨超声介入治疗联合化疗对中央型肺癌伴脑转移患者的临床疗效。
1 资料和方法
1.1 一般资料
本研究方案经本院医学伦理委员会批准。选取2013年6月至2015年6月被确诊为中央型肺癌伴脑转移的82例患者,其中,男性43例,女性39例;年龄48~76岁,鳞癌38例,腺癌44例;病理分期:Ⅱ期27例,Ⅲ期37例,Ⅳ期18例。根据数字表法随机分为观察组和对照组,观察组42例,对照组40例。研究实施前患者及其家属均签署知情同意书。
1.2 纳入及排除标准
1.2.1 纳入标准 (1)经组织学或细胞学确诊为中央型肺癌;(2)经核磁共振 (magnetic resonance imaging,MRI)确诊为远处颅内转移的患者;(3)未服用影响机体免疫功能的药物。
1.2.2 排除标准 (1)严重的心、肝、肾功能异常患者;(2)预计生存期<12周的患者;(3)Karnofsky 功能量表(KPS)评分≤ 60 分的患者。
1.3 方法
对照组采用吉西他滨联合顺铂的静脉化疗方案。即:吉西他滨1 g/m2,第1天及第8天静滴;顺铂30 mg/m2,第2、3、4天静滴。观察组在对照组的基础上予以超声介入治疗。具体方法如下:采用可用于三维超声检查的多普勒超声诊断仪器,探头频率为3.6 MHz,采用valleylab射频消融体系,总功率为200 W。患者在术前15 min行杜冷丁50 mg注射以及仪器常规消毒和铺巾。然后在超声引导下将射频电极穿入肿瘤后,释放电极针。之后,根据患者的具体病情调节治疗功率。全程通过计算机平台对其进行操控和检测。术后6 h内患者不得进食,医护人员定时对患者的术后状况进行随访、观察和记录。
1.4 观察指标
1.4.1 近期疗效观察 根据实体瘤疗效评价标准(response evaluation criteria in solid tumors,RECIST)对患者近期疗效进行总体评价:完全缓解(complete remission,CR),所有病灶消失,持续4周以上(下同);部分缓解(partial remission,PR),肿瘤总量减少≥50%;稳定(stable disease,SD),病灶无明显变化,肿瘤量减少<50%或增大≤25%;疾病进展(disease progression,PD),病灶增大≥25%,或出现新病灶。有效率(objective response rat,ORR)=(CR+PR)/总例数×100,疾病控制率(disease control rate,DCR)=(CR+PR+SD)/总例数×100。
1.4.2 治疗前和治疗后4周肿瘤标志物变化 包括肿瘤标志物癌胚抗原(carcino-embryonic antigen,CEA、癌抗原125(cancer antigen125,CA125)、癌抗原19-9(cancer antigen19-9,CA19-9)、鳞状细胞癌抗原(squamous cell carcinoma antigen,SCC-Ag)、神经元特异性烯醇化酶(Neuron specific enolase,NSE)和血管内皮生长因子(vascular endothelial growth factor,VEGF) 指标,包括VEGFA、VEGFB、VEGFC。采集空腹静脉血,其中10 mL,离心10 min,分离血清,1 h内完成检测。肿瘤标志物利用CYFRA21-1采用电化学发光法,用 Roche170 电化学免疫分析仪及其配套试剂、校准品检测。VEGF通过酶联免疫吸附法进行检测。
1.4.3 随访 通过门诊或电话进行随访两年,记录患者的生存情况。其中无进展生存期(progression free survival,PFS)指患者首次治疗至出现疾病进展或末次随访时间。总生存期(overallsurvival,OS)指患者首次治疗至因任何原因死亡或末次随访日期的时间。
1.5 统计学分析
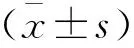
2 结果
2.1 一般资料
两组患者一般资料见表1,两组患者性别、年龄及病理类型和分期等资料比较,均无统计学意义(P>0.05)。
2.2 两组患者近期疗效比较
观察组的治疗有效率和控制率分别是45.2%和85.7%,而对照组为30.0%和70.0%,观察组的近期疗效显著优于对照组,有统计学意义(P<0.05),具体数据见表2。
2.3 肿瘤标志物和VEGF指标变化
肿瘤和VEGF指标比较如表3和表4所示,治疗前两组患者肿瘤和VEGF水平无统计学意义(P>0.05),治疗后其在两组患者中的表达量均下降,组间比较显示,观察组改善程度显著高于对照组(P<0.05)。
表1 一般资料比较
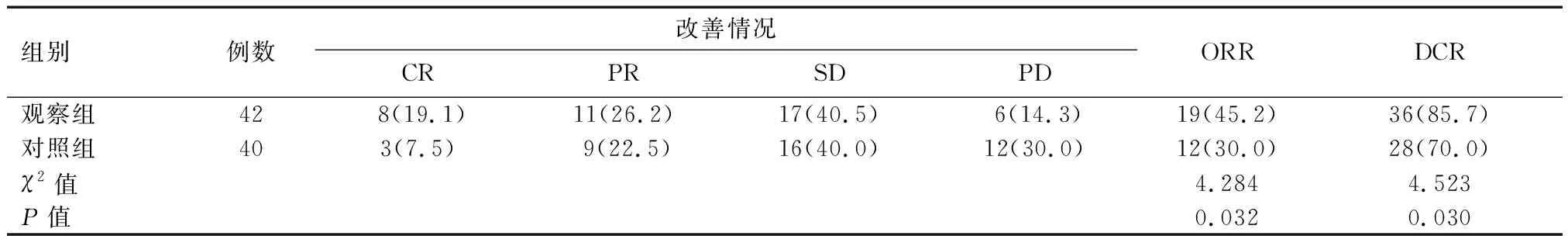
表2 两组患者近期疗效比较 [n(%)]
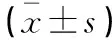
表3 两组患者肿瘤标志物变化
注: CEA、CA125和CA199的参考区间上限分别为 5.0 ng/mL、35 U/mL和37 U/mL。
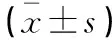
表4 两组患者VEGF变化
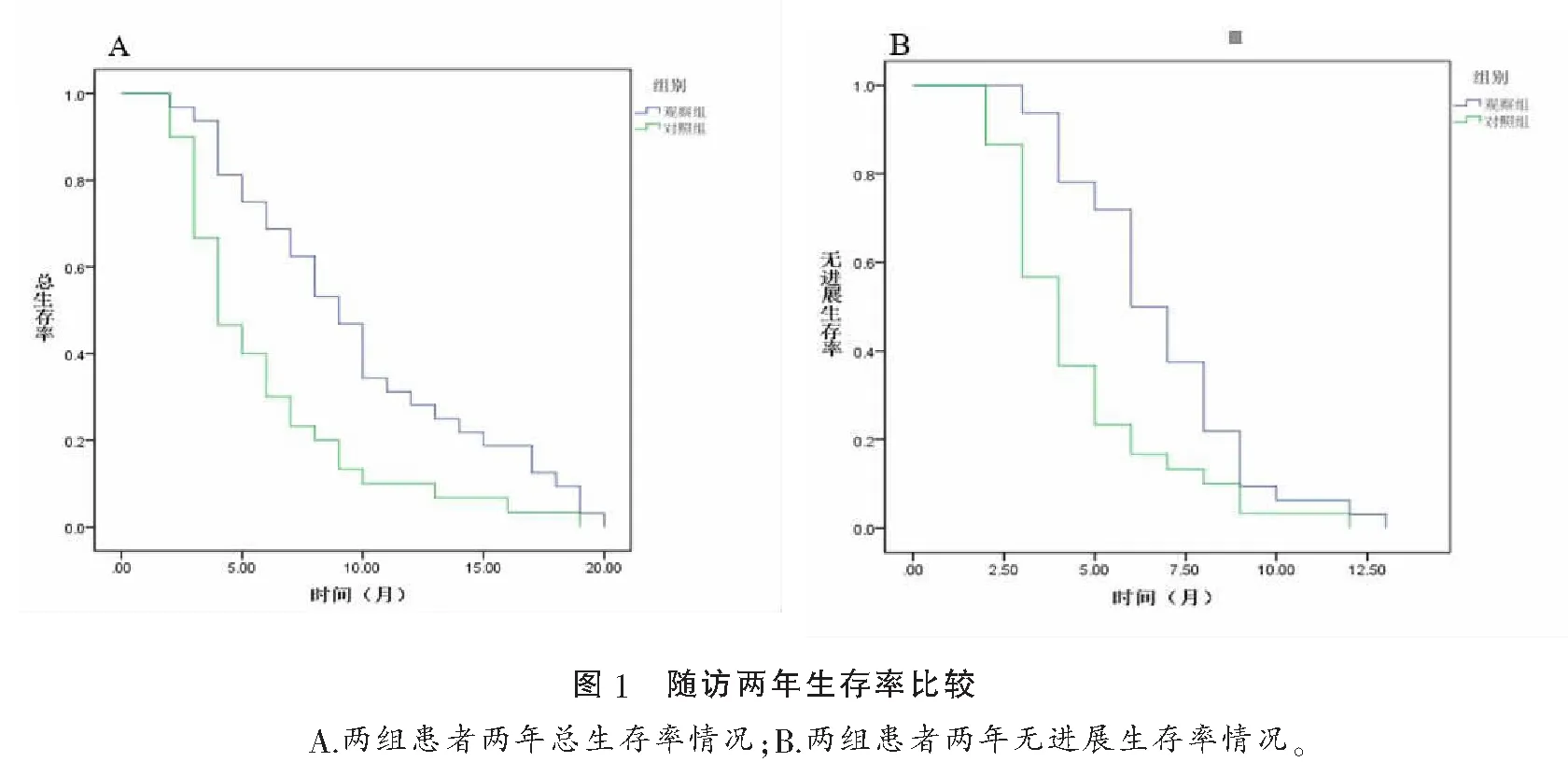
2.4 随访两年生存率比较
两年随访结果如图1所示,随访率为100%,其中,观察组患者的中位PFS为5个月,中位OS为8个月,对照组中位PFS为3个月,中位OS为5个月。另外,观察组的6个月生存率为67.3%,12个月生存率为26.9%,而对照组分别为28.9%和15.7%。观察组的PFS和OS分别显著长于对照组(P<0.05),以及其6个月和12个月的生存率均显著高于对照组(P<0.05)。
3 讨论
肺癌是对人类健康和生命威胁最大的恶性肿瘤之一,临床上以中央型肺癌更为常见。以铂类为代表的联合化疗是非靶向敏感患者群的治疗标准,尽管化学药物在对肺癌细胞的抑制和杀灭中具有显著的疗效,但是,随着化疗时间的延长,大部分患者会降低对药物的敏感性,从而增加各种不良反应的发生率,最终会导致化疗失败[5]。近年来,超声介入治疗在临床实体肿瘤的治疗中逐渐显现出其较好的效果。而超声介入治疗的机制主要是利用微波使肿瘤组织温度升高,通过高温环境杀死肿瘤细胞[4,6]。有文献[7-8]报道,超声介入治疗在一定程度上也会增强患者的免疫功能;利用超声介入治疗在对肝癌患者的治疗中,发现肿瘤体积显著缩小,内部血流减少,患者的整体生活质量水平得以提升[9-10]。在本研究中,观察组的治疗有效率和控制率分别是45.2%和85.7%,分别高于对照组(30.0%,70.0%)。观察组的近期疗效显著优于对照组,说明超声介入治疗联合药物化疗在中央型肺癌伴脑转移患者的治疗中较单纯药物化疗有更好的临床疗效。同样,在对患者随访两年记录中发现,观察组的6个月和12个月生存率(67.3%,26.9%)均显著高于对照组(28.9%,15.7%),说明超声介入治疗联合药物化疗可以显著延长患者的生存时间。
肿瘤标志物是肿瘤组织产生的一种蛋白质,可以协助肿瘤组织的增殖、浸润及转移。同样肺癌组织可以通过自身分泌的大量细胞因子来参与血管的新生,保证在增殖过程中的营养供应[11]。VEGE是公认的一种参与血管新生的细胞生长因子,包括VEGFA、VEGFB和VEGFC 3种类型[12-13]。和肺癌组织密切相关的肿瘤标志物主要有CEA、CA125、CA19-9、SCC-Ag和NSE,其中,CEA和CA125分别是结肠癌和上皮性卵巢癌级子宫内膜癌的特异性标志物。但是,近年来,大量研究显示,其在肺癌的诊断中具有较高的敏感性[14]。SCC-Ag是特异表达于肺、咽等癌组织中,尤其是鳞状细胞癌,NSE是作为一种肝糖分解酶,分布于神经元和神经内分泌细胞中,在肺癌组织中的含量是正常肺组织的3~30倍,小细胞性肺癌最常表现为神经分泌性质的肿瘤。有学者认为NSE是目前诊断小细胞末分化癌最敏感、最特异的标志物,可作为鉴别肺癌病理类型的重要指标[15]。同样,CA19-9在肺癌的诊断中也具有重要的意义[16]。因此本文对患者的血管内皮生长因子和肿瘤标志物进行检测。治疗后发现,其在两组患者中的表达量均下降,且观察组的改善程度显著高于对照组。这提示,超声介入治疗可通过物理方法直接杀死肿瘤细胞,加上药物化疗的作用,能显著降低患者机体内的肿瘤标志物,从而延长患者的生存期。
综上所述,超声介入治疗联合药物化疗在中央型肺癌伴脑转移患者的治疗中,效果显著,使患者的生存时间延长,值得临床推广应用。
[1] 石远凯,孙燕,于金明,等.中国肺癌脑转移诊治专家共识(2017年版)[J].中国肺癌杂志,2017,20(1):1-13.
[2] Tofts RPH,Lee PM,Sung AW.Interventional pulmonology approaches in the diagnosis and treatment of early stage non small cell lung cancer[J].Transl Lung Cancer Res,2013,2(5):316-331.
[3] 张生潭,兰新宇,陈莉,等.中西医结合治疗与单纯西医治疗肺癌疗效的Meta分析[J].中华中医药学刊,2014,23(10):2524-2527.
[4] Guibert N,Mazieres J,Marquette CH,etal.Integration of interventional bronchoscopy in the management of lung cancer[J].Eur Respir Rev,2015,24(137):378.
[5] Nakajima T,Yasufuku K,Sakairi Y,etal.Successful Treatment of Lung Cancer by Multimodal Endobronchial Interventions[J].Respiration,2014,88(2):144-147.
[6] 张扶莉.半金汤联合支气管动脉介入治疗中晚期肺癌的疗效观察[J].实用癌症杂志,2017,32(1):67-70.
[7] Andrew RLM.An Interventional Pulmonologist’s Tool:Endobronchial Ultrasound-Guided Transbronchial Needle Aspiration (EBUS-TBNA) in Thoracic Disease-An Update[J].Curr Respir Med Rev,2012,8(5):396-408.
[8] 欧文,李湧健,陈嘉璐,等.中医针灸综合治疗晚期非小细胞肺癌的生存分析[J].针灸临床杂志,2016,32(12):23-27.
[9] 王月霞,忽新刚,王月华.经支气管镜介入后装放疗治疗中央型肺癌患者的护理[J].护理学杂志,2014,29(17):42.
[10] Huang J,Zhang T,Ma K,etal.Clinical evaluation of targeted arterial perfusion of verapamil and chemotherapeutic drugs in interventional therapy of advanced lung cancer[J].Cancer Chemother Pharmacol,2013,72(4):889-896.
[11] 吴晓安,邱钧,钟小红,等.终末期肺癌127例抗感染治疗分析[J].实用癌症杂志,2012,27(4):392-393.
[12] 陈勇吉,李志强,江向明.非小细胞肺癌患者手术与非手术治疗的疗效及预后分析[J].检验医学与临床,2013,10(23):3140-3141.
[13] Sabri A,Batool M,Xu Z,etal.Predicting EGFR mutation status in lung cancer:Proposal for a scoring model using imaging and demographic characteristics[J].European Radiology,2016,26(11):1-7.
[14] Tofts R,Lee PM,Sung AW.Interventional pulmonary approaches in diagnosis and treatment of early stage non small cell lung cancer[J].Oncologist,2013,2(5):201-209.
[15] 王会芳,朱丽莉.血清SCC、NSE、CYFRA21-1及CEA联合检测在肺癌诊断中的价值[J].标记免疫分析与临床,2013,20(6):404-406.
[16] Lau WF,Ware R,Herth FJ.Diagnostic evaluation for interventional bronchoscopists and radiologists in lung cancer practice[J].Respirology,2015,20(5):705-714.

