乳腺癌肿瘤免疫微环境与T细胞浸润异质性分析
任莉莉,蒋锦杏,齐 晖,邓春艳,邙建波
(1深圳市人民医院,暨南大学第二临床医学院生物治疗室,深圳 518020;2深圳市人民医院,暨南大学第二临床医学院甲乳外科;*通讯作者,E-mail:2542499581@qq.com)
乳腺癌是女性最常见的恶性肿瘤之一,目前其发病率仍持续升高,在欧美国家,乳腺癌约占女性恶性肿瘤的25%-30%[1]。在我国,乳腺癌的发病率位于女性恶性肿瘤的第1位[2],并且与西方国家不同的是,我国乳腺癌的发病第一高峰位于40-45岁之间,相较于多发生于妇女绝经后的西方国家提早了10-15年[3]。目前免疫治疗是唯一有望彻底清除肿瘤细胞的治疗手段,但临床研究显示,应用效果不如理论推断,最主要的原因可能在于患者肿瘤微环境呈现较强免疫抑制状况,使浸润的T淋巴细胞识别肿瘤细胞的能力下降[4],同时肿瘤异质性的存在也可能导致单个肿瘤部位来源的肿瘤浸润淋巴细胞(tumor infiltrating lymphocytes,TILs)对其他部位肿瘤细胞不具有反应性。清晰地阐明肿瘤微环境的免疫状况及肿瘤微环境的异质性,对于激活患者的自体抗肿瘤免疫,纠正免疫抑制状态十分重要。
1 对象与方法
1.1 研究对象
收集2014-11~2015-12在我院甲乳外科就诊且经病理学检查证实为Ⅱb/Ⅲa期存在复发转移乳腺癌患者10例,其中浸润性导管癌7例,浸润性小叶癌3例,年龄39-57岁,中位年龄46岁。健康对照组10例来自2014-11~2015-12我院健康体检女性,年龄35-58岁,中位年龄45岁。所有对象均无糖尿病、类风湿、甲状腺功能亢进等自身免疫性疾病以及免疫治疗史。相关研究取得研究对象的知情同意并签署知情同意书。
1.2 方法
1.2.1 肿瘤微环境免疫相关基因表达谱分析 10例肿瘤患者的肿瘤组织样本按体积平均分为左、中、右三个部分,每份肿瘤组织DNA与RNA样本利用AllPrep DNA/RNA mini kit(Qiagen,Catalog number 80207)提取,外周血DNA样本利用QIAamp DNA Blood Midi Kit(Qiagen, Catalog number 51183)提取。利用标准化的TaqMan gene expression assays检测11个免疫相关基因的mRNA表达水平,采用的TaqMan®Gene Expression Assays试剂盒如下:TRB(Hs01588269-g1)、CD4(Hs01058407-m1)、CD8(Hs00233520-m1)、FOXP3(Hs01085834-m1)、PD-1(Hs01550088-m1)、OX40(Hs00937194-g1)、GZMA(Hs00989184-m1)、PRF1(Hs00169473-m1)、PD-L1(Hs01125301-m1)、IL10(Hs00961622-m1)及TIM3(Hs00958620-m1)。引物及探针均由试剂盒提供。基因相对表达水平分析通过与GAPDH(Hs02758991-g1)表达水平的比值确定。
1.2.2 肿瘤微环境TCR库分析 利用Ficoll密度梯度分离患者及健康对照组外周血单核细胞,与肿瘤组织一起利用AllPrep DNA/RNA mini kit(Qiagen,Catalog number 80207)提取RNA。按照文献描述的方案制备用于TCR测序的文库[5]:用TapeStation 2200(Agilent Technologies)对从肿瘤和PBMC中提取的总RNA进行定量,使用SMART cDNA文库构建试剂盒(Takara Bio USA,美国)合成cDNA,使用SMART衔接子的正向引物和特异于TCR恒定区的反向引物扩增TCR-β序列。然后使用Nextera XT Index试剂盒(Illumina,目录号FC-131-2001,FC-131-2002,FC-131-2003)添加具有条形码序列的Illumina序列接头。使用Reagent v3 600-循环试剂盒(Illumina,目录号MS-102-3001),通过Illumina MiSeq平台上的300 bp配对末端读数对最终制备的文库进行测序,使用Tcrip进行测序数据分析[6]。使用Bowtie2校准器(版本2.1.0)将测序读数映射到从IMGT/GENE-DB(http://www.imgt.org)获得TCR参考序列,并且在测序读取时分解成V,D和J片段,确定互补决定区3(complementarity determining region 3,CDR3)片段。计算inverse Simpson’s多样性指数(Diversity Index,DI)用于评估TCR库多样性。
1.3 统计学分析
利用Prism 7(GraphPad software,La Jolla,CA)对患者与健康对照组的TCR库多样性进行非配对t检验,P<0.01为有显著性差异。
2 结果
2.1 乳腺癌肿瘤微环境免疫相关基因表达谱
荧光定量PCR结果显示,肿瘤组织样本微环境的免疫相关基因的相对表达水平存在明显差异,不同组织样本中,各基因相对GAPDH表达水平从0.000 01至0.08不等,且同一患者肿瘤组织三个部位样本基因表达热图存在明显差异。每例患者肿瘤组织三份样本的11个免疫相关基因相对表达水平见图1,其中P1-P10代表10例乳腺癌患者,S1、S2、S3代表每例患者组织的左、中、右三份样本。
基因热图显示不同患者肿瘤内部淋巴细胞浸润存在明显的异质性,部分肿瘤样本中TRB基因的表达非常低,如患者P4的S2样本,患者P8的S2、S3样本,患者P10的S1样本,而部分样本TRB基因的表达水平很高,且同时伴有GZMA基因的高表达,如P1的S1,P2的S1、S2、S3,P4的S3,P6的S3,P9的S3,P10的S2。同时还有部分样本TRB基因的表达很高,同时高表达CD4与Foxp3基因,如P2的S1,P6的S3,P10的S2样本。CD4/TRB、CD8/TRB、GZMA/TRB、PRF1/TRB的比值介于0.01至2.5之间,代表了在不同肿瘤样本中CD4、CD8淋巴细胞亚群及细胞毒性CD8淋巴细胞占肿瘤浸润淋巴细胞的比例。
2.2 乳腺癌患者肿瘤微环境TCR库存在高度异质性
对同例患者肿瘤组织三份样本的受体库测序结果表明,肿瘤组织浸润T细胞受体库有部分重合,但三份样本均存在样本特异性的TCR类型。10例患者中,T细胞受体独特的CDR3序列数目分布在7015至12120之间,每例患者3份样本之间TCR库重合比例存在明显区别。患者P4的3份样本TCR库重合度最高,在3份样本中都存在的CDR3序列占总数的81.5%,而患者P3的3份样本TCR库重合度最低,只有29.9%。10例患者3份肿瘤组织样本(S1、S2、S3)的受体库分布见图2。

P1-P10为10例独立乳腺癌患者,S1-S3为每例乳腺癌组织左、中、右等重样本,红色从深至浅代表基因相对表达水平从高至低,基因表达比例从高至低由绿色色谱由深至浅表示图1 患者免疫相关基因的相对表达水平热图
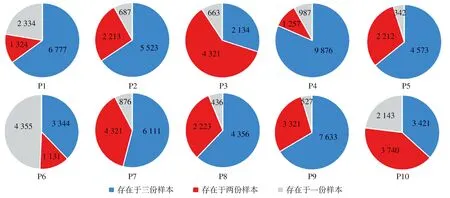
蓝色部分代表在同一患者肿瘤组织S1、S2、S3样本内都存在的TCR CDR3类型,红色部分代表在同一患者肿瘤组织两份样本内存在的TCR CDR3类型,灰色部分为只在一个部位出现的TCR CDR3类型,数字代表各个部分所包含的独特TCR CDR3序列的数目图2 10例乳腺癌患者三份样本中肿瘤浸润T淋巴细胞受体库独特CDR3序列的分布
2.3 乳腺癌患者与健康对照组外周血T淋巴细胞受体库多样性
对10例患者及健康对照组外周血T淋巴细胞受体库测序,对10例健康样本,平均得到4 768 197±22 197有效读数,包括15 004±1 502独特的TCR CDR3序列,而对10例肿瘤患者,平均得到582 433±61 229有效读数,包含9 048±756.7独特TCR CDR3序列,两者存在显著性差异(P=0.002 3,见图3A)。健康对照组DI为1 884±144.1,而乳腺癌患者的DI为1 087±109.2,与健康对照组相比,乳腺癌患者的TCR库的多样性显著下降(P=0.003,见图3B)。

A.健康组与乳腺癌组TCR独特CDR3序列数目 B.健康组与乳腺癌组TCR库DI指数图3 乳腺癌组与健康对照组TCR库多样性比较
3 讨论
继手术、放化疗之后,细胞过继免疫治疗以副作用低、靶向性强而成为肿瘤治疗的有益补充。然而,回输体外分离培养的肿瘤浸润淋巴细胞仅在黑色素瘤的治疗中取得了较好的效果[7],但是黑色素瘤具有高表达的肿瘤新抗原,较高的突变负荷,其免疫特征与其他实体瘤存在较大区别,尽管国内外针对乳腺癌及其他实体瘤的免疫治疗均已开展大量的临床研究,所报道的临床响应率均不甚满意,波动在10%-30%之间[8],深入了解肿瘤微环境的免疫状况,探讨肿瘤微环境内浸润淋巴细胞的功能及分布,可以为提高细胞过继免疫治疗的响应率做出有益探索。
本研究结果显示,在同一患者肿瘤组织中存在高度的肿瘤异质性,而TRB,CD8高表达的组织,通常可以看到CD4与Foxp3的高表达,证明在患者肿瘤微环境中,存在抗肿瘤免疫及肿瘤逃逸的双重机制。同时也提示目前的肿瘤浸润细胞疗法,需要更多的肿瘤标本来分离培养肿瘤浸润淋巴细胞,以增加得到肿瘤反应性T细胞的比例及可能性。与免疫基因表达谱的研究结果相似,通过对肿瘤不同部位的TCR库分析,我们发现在不同的肿瘤部位,浸润淋巴细胞的基因型尽管存在不同程度的重叠,但在每个肿瘤标本中都存在该位置特异性的TCR基因型,进一步说明了肿瘤浸润淋巴细胞分布的异质性及扩大TIL治疗取样范围的必要性。同时,乳腺癌患者外周血T淋巴细胞TCR库多样性的显著降低显示乳腺癌患者体内存在明显的免疫抑制状况,对于外来抗原的免疫能力降低,进一步造成了肿瘤的免疫逃逸。TCR库的多样性与患者的免疫状况之间的关系,之前的研究也有类似的结论[9]。联合应用PD1/PDL-1等检查点抑制剂,解除肿瘤患者体内的免疫抑制状况,从而激活患者体内抗肿瘤免疫对于提高过继细胞免疫疗法是十分必要的。
参考文献:
[1] Senn HJ. St. Gallen consensus 2013: optimizing and personalizing primary curative therapy of breast cancer worldwide[J]. Breast Care (Basel),2013,8(2):101.
[2] Yang L, Wang J, Cheng J,etal. Quality assurance target for community-based breast cancer screening in China: a model simulation[J]. BMC Cancer,2018,18: 261-269.
[3] Sung H, Ren J, Li J,etal. Breast cancer risk factors and mammographic density among high-risk women in urban China[J]. NPJ Breast Cancer,2018,4:3-14.
[4] Assadipour Y, Zacharakis N, Crystal JS,etal. Characterization of an immunogenic mutation in a patient with metastatic triple-negative breast cancer[J]. Clin Cancer Res,2017,23(15):4347-4353.
[5] Poschke I, Flossdorf M, Offringa R. Next-generation TCR sequencing-a tool to understand T-cell infiltration in human cancers[J]. J Pathol,2016,240(4):384-386.
[6] Kitaura K, Shini T, Matsutani T,etal. A new high-throughput sequencing method for determining diversity and similarity of T cell receptor(TCR) alpha and beta repertoires and identifying potential new invariant TCR alpha chains[J]. BMC Immunol,2016,17(1):38-53.
[7] Goff SL, Smith FO, Klapper JA,etal. Tumor infiltrating lymphocyte therapy for metastatic melanoma: analysis of tumors resected for TIL[J]. J Immunother,2010,33(8):840-847.
[8] Manjili MH, Payne KK. Prospects in cancer immunotherapy: treating advanced stage disease or preventing tumor recurrence[J]? Discov Med,2015,19(107):427-431.
[9] Rossetti M, Spreafico R, Consolaro A,etal. TCR repertoire sequencing identifies synovial Treg cell clonotypes in the bloodstream during active inflammation in human arthritis[J]. Ann Rheum Dis,2017,76(2):435-441.

