神经内镜手术与软通道穿刺引流术治疗高血压性脑出血的随机对照研究*
(河北省衡水市哈励逊国际和平医院 神经外科,河北 衡水 053000)
高血压性脑出血(hypertensive intracerebral hemorrhage,HICH)约占急性脑血管病的20.0%~30.0%,30 d内病死率高达30.0%~50.0%,存活者致残率可达30.0%[1]。脑出血引发的颅内血(水)肿与继发性脑组织损伤是致死、致残的重要原因,及时正确处理脑出血是挽救患者生命、减轻残疾程度的关键。目前,对HICH治疗方法的选择尚无严格标准,对出血量超过30 ml且未明显形成脑疝患者,临床倾向于通过微创手术来清除颅内血肿,解除脑疝危险[2]。神经内镜血肿清除术(neural endoscopic intracranial hematoma evacuation,NEIHE)与软通道穿刺引流术(soft channel puncture drainage,SCPD)是两种治疗HICH的微创手段,与传统开颅血肿清除术或去骨瓣减压术相比,具有创伤小、恢复快和预后好的优点,既往研究多关注上述两种微创手术方案与传统外科手术的比较,而对两种手术效果的对比性报道少见,笔者团队对两种微创手术方案的临床效果、并发症及短期预后进行了随机对照研究。现报道如下:
1 资料与方法
1.1 纳入与排除标准
纳入标准:①年龄<75岁;②有明确的高血压病史;③脑出血经颅脑CT明确诊断,且首次发病;④幕上血肿量>30 ml,幕下血肿量>10 ml,中线偏移<0.5 cm;⑤症状距手术开始时间≤12 h;⑥签订手术及术后随访知情同意协议书。排除标准:①脑干出血及脑干功能衰竭;②颅内动脉瘤及动静脉畸形导致的继发性脑出血;③脑疝形成者;④凝血功能障碍者;⑤合并心、肝、肾等重要脏器功能不全者。
1.2 临床病例资料
本研究经医院伦理委员会批准,选择2015年1月-2016年12月本院神经外科收治的106例HICH病例为研究对象。其中,男60例,女46例,年龄47~74岁,平均(59.7±7.8)岁;入院格拉斯哥昏迷评分(Glasgow coma scale,GCS)小于5分16例,5~8分37例、9~13分53例;基底节区出血67例,额叶出血13例,顶叶出血9例,颞叶出血7例,丘脑出血10例,破入脑室14例;发病距手术时间7~12 h,平均(9.4±1.9)h;血肿量38~74 ml,平均(54.4±15.7)ml。上述患者按照电脑产生的随机数字分为神经内镜组(51例)与穿刺引流组(55例)。两组患者术前基础特征差异无统计学意义(P>0.05),具有可比性。见表1。
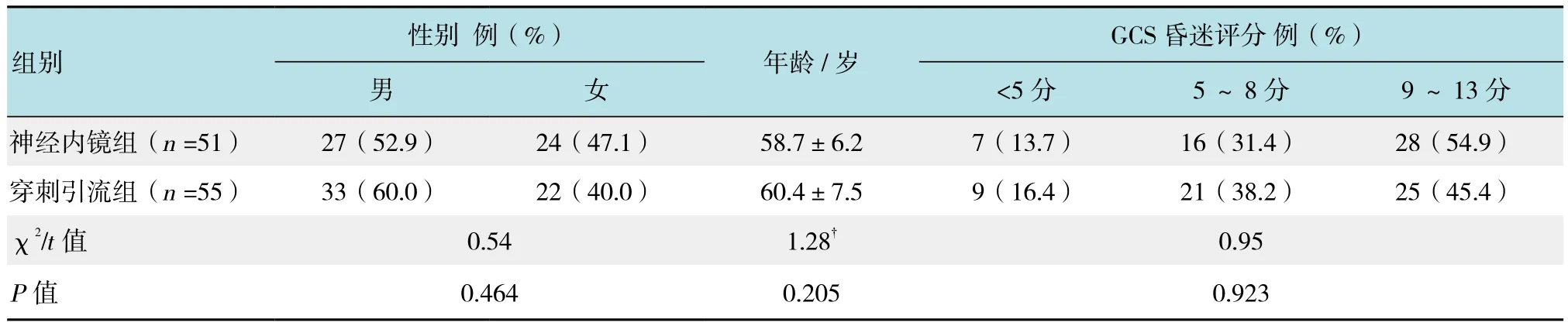
表1 两组患者术前特征比较Table 1 Comparison of basic characteristics before operation between the two groups
1.3 手术方法
1.3.1 神经内镜组 采用德国STORZ公司的硬质神经内镜及相应电视监视系统行NEIHE手术。具体为:患者全麻,根据血肿量最大的CT层面做3.0~4.0 cm切口,在距血肿中心最近的颅骨内板做直径1.0~1.5 cm钻孔(脑室出血病例则取前额中线与发际线交汇处后方旁开2.0~3.0 cm钻孔),“十字”切开硬膜,注意避开皮层血管,采用双极电凝局部皮层脑组织并适当分离,采用穿刺套管(外径7 mm)沿CT提示血肿方向穿刺,进入血肿后拔除穿刺套管内芯,留置外套管作为内镜通道;术者在监视器指引下借助吸引管、碎吸器彻底清除脑内血肿,对活动性出血点配合使用内镜专用齐柏林ZNE-242BIP双极电凝器电凝止血,在确认无活动性出血后,血肿腔壁覆盖止血纱,留置血肿腔外引流管;对于脑室出血者,吸净同侧脑室血肿,而后用生理盐水冲洗,术中行透明隔造瘘清除对侧脑室血肿,最后在第三脑室内置入引流管。术毕退出外穿刺套管,钻孔予明胶海绵填充,切口缝合。术后行吸氧、营养神经、脱水、降压和预防感染等常规内科治疗,监测脑脊液与颅脑CT,确认有无继发感染及脑积水产生,同时,观察引流液颜色变化,无感染、再出血等并发症情况下,一般于术后3~7 d拔管。
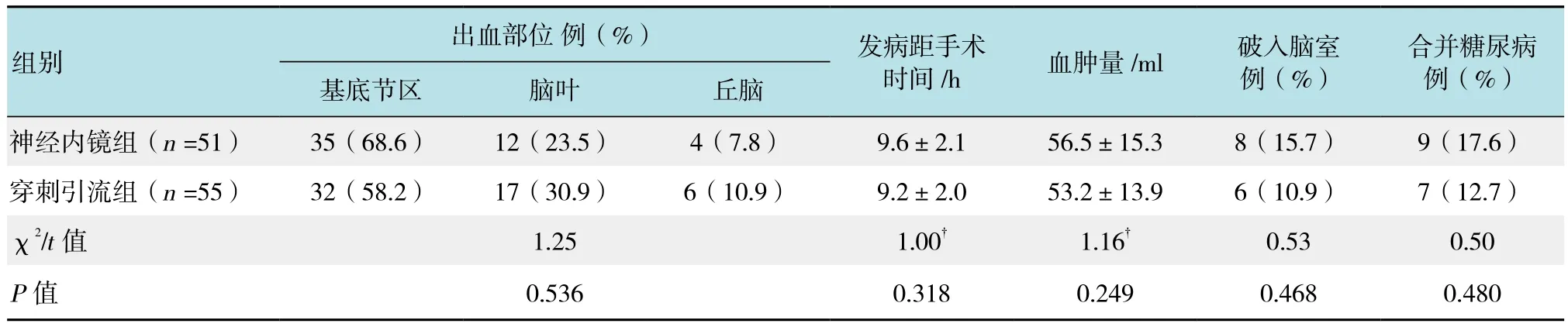
续表1Table 1
1.3.2 穿刺引流组 局麻下进行CT定位,确定血肿中心的X、Y、Z坐标值、穿刺角度及深度,以血肿最大层面中心为穿刺靶点并避开血管及重要功能区(脑室出血者穿刺点选择同神经内镜组),切开头皮,取直径5 mm的颅锥锥颅,通过穿刺针刺破硬脑膜,用F12硅胶脑室引流管穿刺到预定血肿中心,再用注射器连接体外引流管,缓慢抽吸血肿,抽吸量保持20.0%~30.0%,若抽吸出新鲜血液,使用肾上腺素1 mg+0.9生理盐水本着等量置换原则反复冲洗血肿腔;若为陈旧性血液,向血肿腔注入稀释后尿激酶5万u,闭管,2 h后开放引流。术后第2天起用,每日用同样方法冲洗2次,持续引流3~7 d,CT检查确认80.0%~90.0%血肿清除且中线结构恢复后拔管。
1.4 观察与评价指标
1.4.1 手术相关指标 记录两组手术时间、术中失血量、术后48 h血肿清除率及术后再出血、感染、脑积水(气)等并发症发生情况。其中,血肿清除率=(术前血肿体积-术后血肿体积)/术前血肿体积×100%,血肿体积经CT检查后按多田氏方程计算:π/6×长轴(cm)×短轴(cm)×血(水)肿层面(1层为1 cm),单位cm3。
1.4.2 外周血炎性因子 术前与术后14 d采集空腹外周静脉血,分离血清,测定肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-6(interleukin-6,IL-6)、超敏C反应蛋白(hypersensitive C-reactive protein,hs-CRP)水平。
1.4.3 临床疗效判定 术前与术后14 d,按照美国国立卫生院脑卒中量表评分(National Institutes of Health Stroke Scale,NIHSS)评价神经功能缺损情况,并按照全国第四届脑血管疾病学术会议制定的脑卒中标准判定临床疗效[3]。基本痊愈:功能缺损程度评分减少91.0%~100.0%;病残程度为0级;显著进步:功能缺损程度评分减少46.0%~90.0%,病残程度1~3级;进步:功能缺损评分减少18.0%~45.0%;无变化:功能缺损程度评分减少17.0%左右;恶化:功能缺损程度评分减少或增多18.0%以上。总体有效率=(基本痊愈数+显著进步数+进步数)/治疗总例数×100%。
1.4.4 日常生活能力 采用Barthel指数评估患者术后6个月生活能力,Barthel指数总分100分,分值越高表示日常生活能力越好,0分表示功能很差,没有独立生活能力,100分表示完全具备独立生活能力[4]。
1.5 统计学方法
采用SPSS 22.0软件进行统计学分析,手术相关指标、NIHSS评分、Barthel评分和炎性因子水平等计量资料均符合正态分布,用均数±标准差(±s)表示,上述指标的组间比较采用t检验,组间血肿清除率、并发症发生率等计数资料比较采用χ2检验或fisher精确概率法,组间疗效比较采用Mann-Whitney秩和检验,P<0.05为差异有统计学意义。
2 结果
2.1 两组手术及并发症指标比较
神经内镜组手术时间和术中失血量均明显高于穿刺引流术,差异有统计学意义(P<0.05),术后48 h血肿清除率亦明显高于穿刺引流组,差异有统计学意义(P<0.05)。两组术后再出血、颅内感染等单项并发症发生率差异无统计学意义(P<0.05),但神经内镜组总体并发症发生率明明显低于穿刺引流组(13.7%vs 29.1%,fisherP单侧=0.045)。见表2。
2.2 两组炎性因子变化比较
两组术后14 d,外周血TNF-α、IL-6和hs-CRP等均较术前明显下降,神经内镜组上述指标下降数值远高于穿刺引流组,差异均有统计学意义(P<0.05)。见表3。
2.3 两组神经功能缺损评分和临床疗效比较
两组术后存活者NIHSS评分均较术前下降,神经内镜组NIHSS评分较穿刺引流组下降更为明显,差异有统计学意义(P<0.05)。术后14 d,神经内镜组和穿刺引流组因再出血或病情恶化分别死亡3和5例(5.9% vs 9.1%)(fisherP=0.717),两组疗效差异无统计学意义(P=0.053),神经内镜组总有效率高于穿刺引流组(86.3% vs 74.5%),但差异无统计学意义(χ2=2.29,P=0.130)。见表4。
2.4 两组术后6个月生活能力评分
随访期间,神经内镜组和穿刺引流组分别死亡2和3例,穿刺引流组失访1例。存活病例术后6个月Barthel平均较术前明显提高,神经内镜组提高绝对幅度明显高于穿刺引流组,差异有统计学意义(P<0.05)。见表5。
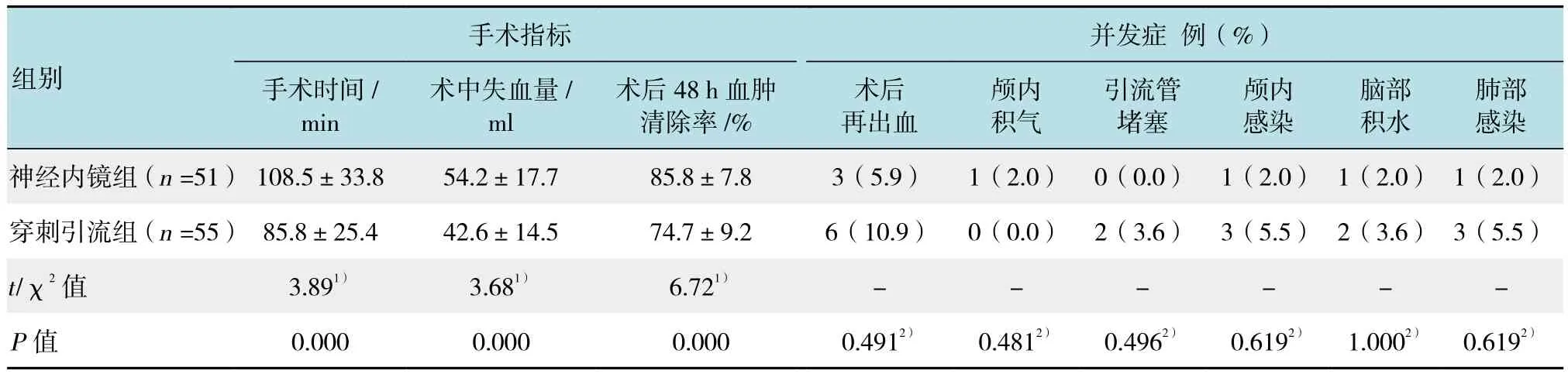
表2 两组患者手术指标和术后并发症发生率比较Table 2 Comparison of operational indexes and postoperative complications between the two groups
表3 两组患者术后外周血炎性因子变化比较 (±s)Table 3 Comparison of variations of the peripheral blood indicators between the two groups (±s)
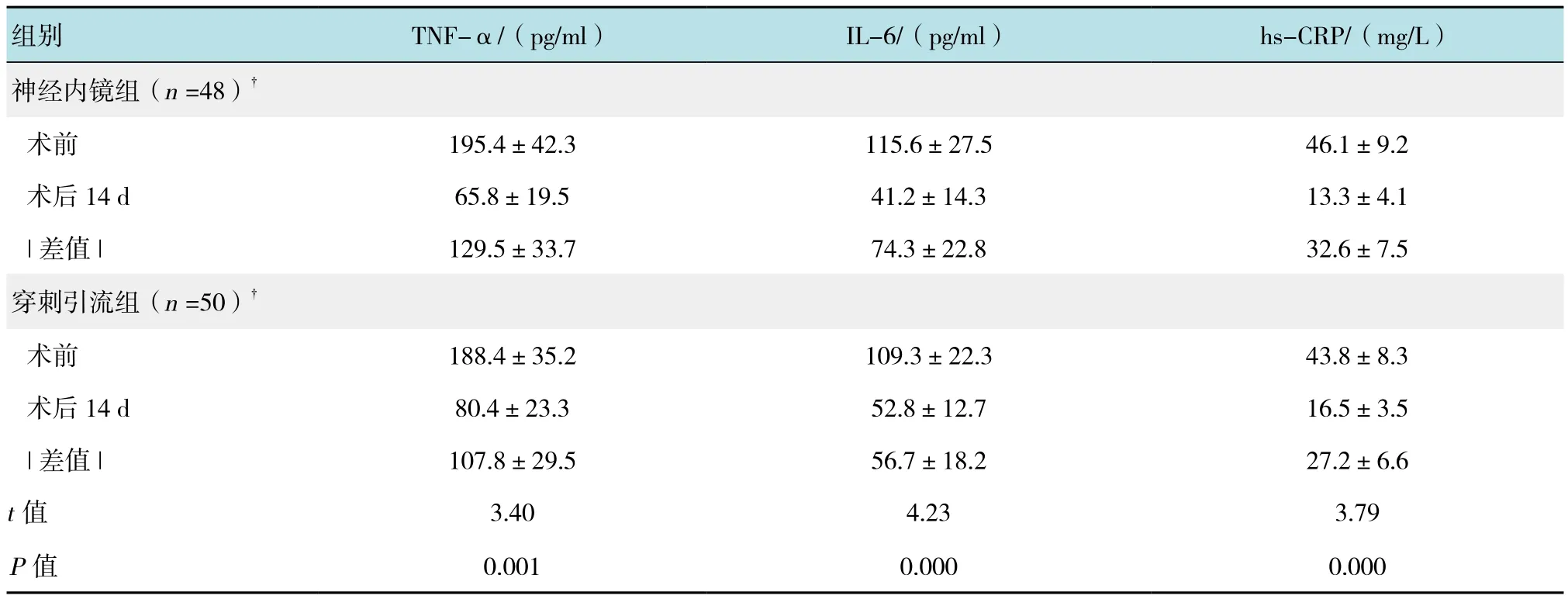
表3 两组患者术后外周血炎性因子变化比较 (±s)Table 3 Comparison of variations of the peripheral blood indicators between the two groups (±s)
注:†统计分析中剔除术后14 d内死亡病例:t、P值为两组差值的比较
组别 TNF-α/(pg/ml) IL-6/(pg/ml) hs-CRP/(mg/L)神经内镜组(n =48)†术前 195.4±42.3 115.6±27.5 46.1±9.2术后14 d 65.8±19.5 41.2±14.3 13.3±4.1|差值 | 129.5±33.7 74.3±22.8 32.6±7.5穿刺引流组(n =50)†术前 188.4±35.2 109.3±22.3 43.8±8.3术后14 d 80.4±23.3 52.8±12.7 16.5±3.5|差值 | 107.8±29.5 56.7±18.2 27.2±6.6 t值 3.40 4.23 3.79 P值 0.001 0.000 0.000
2.5 典型病例
不同手术方案钻孔引流及尿激酶注入血肿清除术和神经内镜下血肿清除术治疗前后图片对比见示意图1和 2。
表4 两组患者治疗14 d NIHSS评分和临床疗效比较Table 4 Comparison of NIHSS score and clinical efficacy 14 d after operation between the two groups
表5 两组患者术后6个月生活能力评分比较 (分,±s)Table 5 Comparison of living ability 6 months after operation between the two groups (score,±s)
表5 两组患者术后6个月生活能力评分比较 (分,±s)Table 5 Comparison of living ability 6 months after operation between the two groups (score,±s)
注:†剔除死亡及失访病例
术前 术后6个月 |差值|神经内镜组(n =46)† 24.9±4.2 69.5±13.2 44.8±9.7穿刺引流组(n =46)† 23.2±5.9 62.8±15.7 39.5±11.2 t值 1.59 2.22 2.43 P值 0.115 0.029 0.017组别
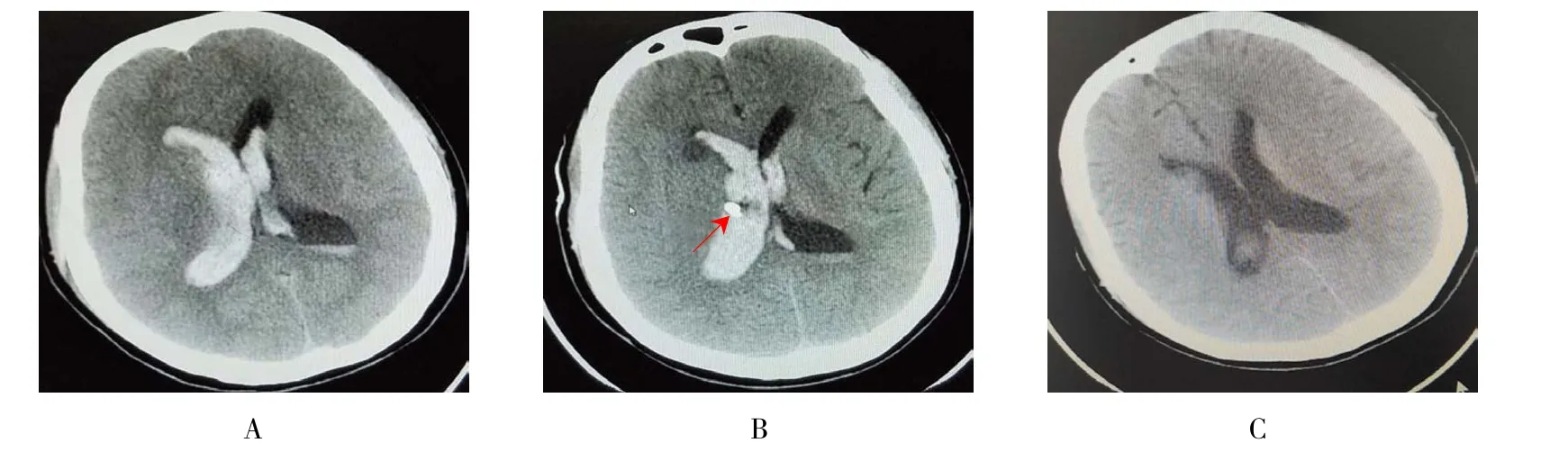
图1 穿刺引流术前术后CT图Fig.1 The CT image of pre and after SCPD surgery
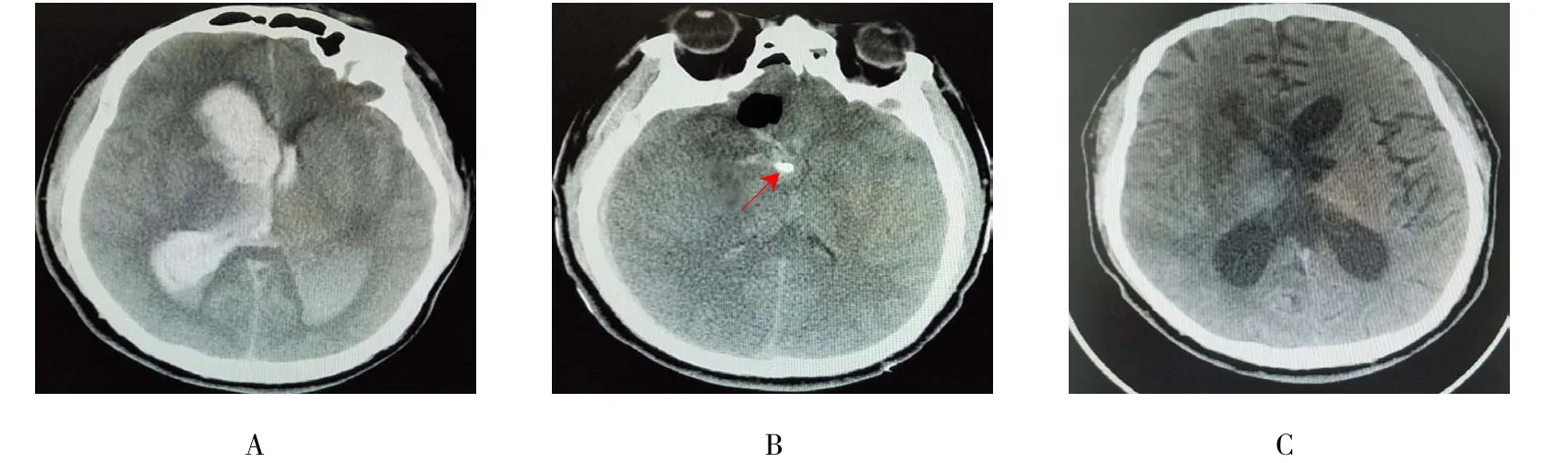
图2 神经内镜术前术后CT图Fig.2 The CT image of pre and after NEIHE surgery
3 讨论
HICH病理基础是脑内小动脉瘤破裂,出血本身可造成局部缺血、缺氧,引发神经元和胶质细胞凋亡;脑血肿、继发性脑水肿引发占位性效应导致颅内压增高和脑疝形成,导致脑内神经结构的机械性损伤,若脑实质出血破入脑室,则脑压急剧升高,病情迅速恶化,病死率高达50.0%~80.0%[5];同时,血液成分如凝血酶、血红蛋白等分解产生大量的脂质过氧化物,可引起脑细胞膜脂质过氧化应激反应[6],氧化应激反应可激活单核巨噬细胞释放TNF-α,T、B淋巴细胞释放IL-6,TNF-α、IL-6和hs-CRP等炎性介质的大量释放会进一步活化炎性细胞,产生大量炎症介质并释放氧自由基引发全身性炎性级联反应,加重脑细胞与神经元的继发性损伤,破坏血脑屏障,严重影响患者预后[7-8]。因此,尽早清除血肿,解除机械性压迫、降低颅内压是避免脑组织损伤、挽救HICH患者生命的关键。
NIEHE和SCPD是治疗脑实质出血的有效微创手术。NIEHE借助监视器的放大作用及镜头的“绕角观察”功能,能观察到细微的神经解剖结构,扩大了手术视角,有助于血肿深部结构的暴露,较为彻底地清除脑实质及脑室内血肿,既往国内外文献报道,NIEHE治疗HICH血肿清除率在83.3%~90.5%[9-12],本研究术后48 h,平均血肿清除率为85.8%,与文献结果相近;同时,NIEHE颅骨钻孔仅为1.0~1.5 cm,切口小,无须做骨瓣移植,完全符合微创原则,操作路径完全在穿刺套管内进行,对脑组织的牵拉损伤极小,极大降低了对中枢神经的伤害。SCPD是在CT定位下以硅胶软管进行、血肿穿刺引流的微创技术,既往报道,SCPD较常规外科手术的手术时间短,对大脑组织损伤小,患者应激反应小,对深部长椭圆形血肿或重要功能区的血肿清除尤其适用[13]。文献报道,SCPD治疗HICH术后平均血肿清除率为79.3%[6],术后7 d有效率显著高于硬通道穿刺引流术和开颅手术(90.5% vs 81.8% vs 81.0%)[14],本研究术后48 h SCPD组平均血肿清除率为74.7%,略低于文献报道,这可能与入选病例构成、病情严重程度及评价时间差异有关。既往亦有报道,由于SCPD无法在直视下止血,对出血6 h以内的活动性出血病例慎用,并建议在血肿相对稳定且经CT确认未进行性增大后采用该术式[15]。
本研究对比了NIEHE和SCPD两种微创手术治疗HICH的临床疗效。结果表明,神经内镜组虽然在手术操作时间、术中失血量方面明显高于穿刺引流组,但在术后48 h血肿清除率、术后并发症发生率、炎性因子水平与NIHSS评分下降幅度均明显优于穿刺引流组,术后14 d临床总有效率较穿刺引流组提高了近12.0%,术后6个月生活能力评价中Barthel指数提高数值亦明显高于穿刺引流组,说明NIEHE手术虽较SCPD操作复杂,但在临床疗效与预后方面具备明显的优势。笔者分析NIEHE手术镜下照明强度高、直视性强.可以准确地区分血肿与周围脑组织的边界,直视下可切开血肿间隔,直接清除血肿并电凝止血,且能通过透明隔造瘘清除对侧脑室的血肿及孟氏孔清除三、四脑室的血肿,故尤其适用于脑室内血肿的清除。既往报道,神经内镜治疗脑室出血的术后优良率远优于穿刺引流(88.7% vs 63.3%)[16]。软通道穿刺虽较硬通道穿刺对脑组织的损伤小,但依旧属于盲目穿刺,亦存在一定的穿刺损伤概率;穿刺引流术对稳定型血肿需借助尿激酶冲洗来促进引流,对于活动性出血需借助凝血酶来处理止血,故术后短期内血肿清除率较低,对活动性出血的止血效率较低,对有活动性出血的情况不能有效控制时仍需借助小骨窗开颅等术式解决出血问题[17]。因此,NIEHE既具备了开颅手术直视的优点和SCPD手术微创的优点,同时又能回避两种方法的缺点,上述差异直接导致穿刺引流术术后血肿清除率低于神经内镜组,而术后再出血、引流管堵塞、感染甚至因再出血发生死亡的概率高于神经内镜组。
神经内镜手术治疗HICH虽有其优点,但也存在局限性。一是由于神经内镜受管径所限,视野较为狭窄,容易产生“鱼眼效应”;二是操作空间有限,处理深部出血时,难以有效止血[18];三是对术者解剖结构和手术技巧的要求更高,导致目前神经内镜手术的推广性受限。此外,HICH导致的大血肿虽原则上适用于NIEHE手术,对于病情发展急骤、中线位移严重、短时间内形成脑疝及处于深昏迷状态者单纯行NIEHE手术难以尽快缓解颅内压增高症状,采用去骨瓣减压并血肿清除效果更佳[17]。
综上所述,本研究比较了NEIHE与SCPD两种微创手术治疗HICH的临床疗效,笔者认为前者虽较后者操作相对复杂,但血肿清除率更彻底,并发症更少,近期疗效及预后均具备明显优势。鉴于既往对两种手术效果的随机对照研究报道较少,本研究仅是单中心、小样本分析,对两种微创手术的确切效果仍需通过多中心、大样本、高质量的研究进一步确认。
[1] AKHIGBE T, OKAFOR U, SATTAR T, et al. Stereotacticguided evacuation of spontaneous suprat-entorial intracerebral hemorrhage: systematic review and meta-analysis[J]. World Neurosurg, 2015, 84(2): 451-460.
[2] 中华医学会神经病学分会, 中华医学会神经病学分会脑血管病学组. 中国脑出血诊治指南(2014)[J]. 中华神经科杂志, 2015,48(6): 435-444.
[2] Neurology Branch of the Chinese Medical Association,Cerebrovascular Disease Group, Neurological Branch of Chinese Medical Association. Guidelines for diagnosis and treatment of cerebral hemorrhage in China (2014)[J]. Chin J Neurol, 2015,48(6): 435-444. Chinese
[3] 全国第四届脑血管病学术会议. 脑卒中患者临床神经功能缺损评分标准(1995)[J]. 中华神经科杂志, 1996, 29(6): 381-383.
[3] The Fourth National Academic Conference on Cerebrovascular Disease. Clinical neurological deficit score criteria for stroke patients(1995)[J]. Chin J Neurol, 1996, 29(6): 381-383. Chinese
[4] 郭铭, 罗小林, 朱飚, 等. 高血压脑出血神经内镜微创手术与开颅血肿清除术的对比分析[J]. 现代诊断与治疗, 2012, 23(3):163-164.
[4] GUO M, LUO X L, ZHU B, et al. Comparison study of endoscopic prontal surgery and craniotomy evacuation in management of hypertensive intracerebral hemorrhage[J]. Modern Diagnosis &Treatment, 2012, 23(3): 163-164. Chinese
[5] WANG W H, HUNG Y C, HSU H P, et al. Endoscopic hematoma evacuation in patients with spontaneous supratentorial intracerebral hemorrhage[J]. J Chin Med Assoc, 2015, 78(2): 101-107.
[6] LI Y, YANG R, LI Z, et al. Surgical evacuation of spontaneous supratentorial lobar intracerebral hemorrhage: comparison of safety and efficacy of stereotactic aspiration, endoscopic surgery,and craniotomy[J]. World Neurosurg, 2017, 105: 332-340.
[7] YANG G, SHAO G F. Elevated serum IL-11, TNF-α and VEGF expressions contribute to the pathophysiology of hypertensive intracerebral hemorrhage (HICH)[J]. Neurol Sci, 2016, 37(8):1253-1259.
[8] 侯黎明, 李振, 汪棋笙, 等. 立体定向软通道穿刺引流术治疗高血压脑出血临床疗效评价[J]. 白求恩医学杂志, 2015, 13(6):584-586.
[8] HOU L M, LI Z, WANG Q S, et al. Clinical efficacy of stereotactic puncture and drainage in treatment of hypertensive cerebral hemorrhage[J]. Journal of Bethune Medical Science, 2015, 13(6):584-586. Chinese
[9] RENNERT R C, SIGNORELLI J W, ABRAHAM P, et al.Minimally invasive treatment of intracerebral hemorrhage[J].Expert Rev Neurother, 2015, 15(8): 919-933.
[10] FIORELLA D, ZUCKERMAN S L, KHAN I S, et al. Intracerebral hemorrhage: a common and devastating disease in need of better treatment[J]. World Neurosurg, 2015, 84(4): 1136-1141.
[11] XU X, CHEN X, LI F, et al. Effectiveness of endoscopic surgery for supratentorial hypertensive intracerebral hemorrhage: a comparison with craniotomy[J]. J Neurosurg, 2018, 128(2): 553-559.
[12] SADAHIRO H, NOMURA S, GOTO H, et al. Real-time ultrasound guided endoscopic surgery for putaminal hemorrhage[J]. J Neurosurg, 2015, 123(5): 1151-1155.
[13] ZHENG J, LI H, GUO R, et al. Minimally invasive surgery treatment for the patients with spontaneous supratentorial intracerebral hemorrhage (MISTICH): protocol of a multi-center randomized controlled trial[J]. BMC Neurol, 2014, 14: 206.
[14] 郑伟杰, 林运全, 金永寿, 等. 立体定向软通道微创血肿穿刺外引流术治疗高血压脑出血的临床分析[J]. 微创医学, 2015,10(4): 460-462.
[14] ZHENG W J, LIN Y Q, JIN Y S, et al. Clinical analysis of minimally invasive stereotactic soft channel hematoma puncture and drainage for the treatment of hypertensive intracerebral hemorrhage[J]. Journal of Minimally Invasive Medicine, 2015,10(4): 460-462. Chinese
[15] 杜波, 彭玉平, 钟贤良, 等. 神经内镜通道内技术治疗重度脑室内出血的研究[J]. 中国急救医学, 2016, 36(9): 799-803.
[15] DU B, PENG Y P, ZHONG X L, et al. Neuroendoseopic channel interior technique treats severe intraventricular hemorrhage[J].Chin J Crit Care Med, 2016, 36(9): 799-803. Chinese
[16] XU X, ZHENG Y, CHEN X, et al. Comparison of endoscopic evacuation, stereotactic aspiration and craniotomy for the treatment of supratentorial hypertensive intracerebral haemorrhage: study protocol for a randomised controlled trial[J].Trials, 2017, 18(1): 296.
[17] CHI F L, LANG T C, SUN S J, et al. Relationship between different surgical methods, Hemorrhage position, hemorrhage volume, surgical timing, and treatment outcome of hypertensive intracerebral hemorrhage[J]. World J Emerg Med, 2014, 5(3):203-208.
[18] 康东, 蒋永明, 曾春, 等. 立体定向软通道穿刺术对高血压脑出血患者应激状态及脑血流的影响[J].疑难病杂志, 2014,13(12): 1211-1214.
[18] KANG D, JIANG Y M, ZENG C, et al. The effect of stereotactic soft channel puncture for stress and cerebral blood flow in patients with hypertensive cerebral hemorrhage[J]. Chin J Diffic and Compl Cas, 2014, 13(12): 1211-1214. Chinese

