整肠生联合能全力早期肠内营养在重症COPD患者中的应用评价
刘丽君,张 强,潘君萍
0 引言
慢性阻塞性肺病(Chronic obstructive pulmonary disease,COPD)是一种以气流受限为特征的慢性炎症性疾病,包括两种特征显著的表型:慢性支气管炎和肺气肿[1]。COPD在呼吸系统疾病中比较常见,好发于老年人及吸烟人群,且病情迁延不愈[2]。据估计,在未来10年中,COPD预计将成为全球范围内排名第四的死亡原因[3]。COPD与炎症反应有关,因此,炎症指标的监测对于评估COPD急性期的治疗效果至关重要。COPD与心血管疾病、糖尿病、肺癌、肺炎、肺栓塞、髋部骨折和抑郁症等并发症的风险显著增加有关,还与代谢异常、体重减轻、骨骼肌功能障碍和贫血等全身表现有关[4-5]。另外,重症COPD患者由于进食困难,往往存在严重的营养风险。因此,对于重症COPD患者,营养指标的检测也是十分重要的。本文旨在探讨整肠生联合能全力早期肠内营养在需要机械通气的重症COPD患者中的有效性和安全性,为临床治疗提供参考,现报道如下。
1 资料与方法
1.1 临床资料 选取2016年1月至2017年9月我院第二呼吸与重症监护病房收治的需要机械通气的重症COPD患者共62例。纳入标准:①符合《慢性阻塞性肺疾病诊治指南》[6]中COPD 的诊断标准,行气管插管,呼吸机辅助通气;②同意鼻饲肠内营养治疗,且预计生存期>10 d;③肝肾功能正常或基本正常,无肿瘤/血液系统/风湿免疫系统疾病。排除标准:①鼻饲前有胃肠道症状;②治疗期间出现应激性消化道出血;③治疗期间使用静脉糖皮质激素、血制品。④依从性差,治疗不规范。纳入患者中,男38例,女24例,年龄52~81岁,平均年龄(68.4±8.5)岁。随机分为观察组和对照组,每组31例,两组临床资料差异无统计学意义。本研究经伦理委员会审批,患者均签署知情同意书。
1.2 治疗方法 两组患者均给予抗炎、平喘、化痰等药物治疗,给予气管插管,呼吸机辅助通气。12 h内予留置胃管,给予能全力肠内营养混悬液[纽迪希亚制药(无锡)有限公司 500 mL∶1.5 kcal] 首日500 mL,第2日起根据等氮、等热量原则计算患者所需量,根据患者耐受程度逐渐增加至全量。观察组另外给予整肠生胶囊(东北制药集团沈阳第一制药有限公司 0.25 g*20粒)0.5 g日3次鼻饲。以上治疗持续2周。
1.3 评价标准 于入院首日及第15日检查白细胞计数、C反应蛋白、降钙素原、中性粒细胞百分比、血红蛋白、血清白蛋白、前白蛋白指标,以及IgA、IgG、IgM,并比较两组患者肝肾功能异常、腹胀、呕吐、胃潴留、腹泻等不良反应的发生率。
2 结果
2.1 两组治疗前后各项指标比较 入院当日两组患者各项指标比较差异无统计学意义,治疗15 d后,两组患者白细胞计数、C反应蛋白、降钙素原、
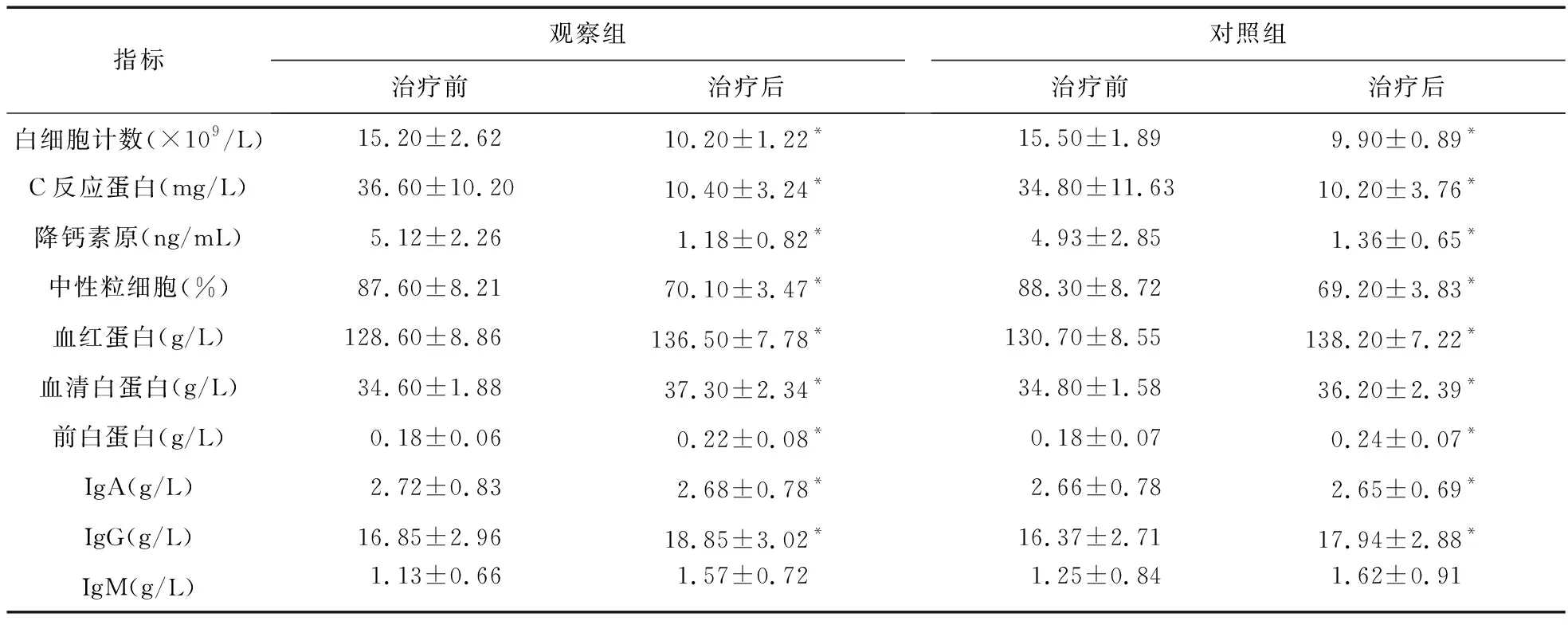
表1 两组治疗前后各项指标对比
注:与治疗前比较,*P<0.05
中性粒细胞百分比均下降(P<0.05),血红蛋白、血清白蛋白、前白蛋白、IgG、IgM均上升(P<0.05),IgA无明显变化,两组间各指标比较差异无统计学意义(P>0.05)。见表1。
2.2 两组不良反应发生情况比较 在治疗期间,两组患者均未出现严重的肝肾功能损伤。其中,观察组出现腹胀2例,对照组6例;观察组出现胃潴留1例,对照组4例;观察组出现腹泻2例,对照组7例。两组不良反应发生情况比较差异有统计学意义。见表2。

表2 两组不良反应比较(例,%)
注:#与对照组比较,P<0.05
3 讨论
COPD是一种慢性呼吸系统疾病,其特征是随着时间的推移肺功能持续下降,伴有呼吸系统症状,包括呼吸困难、咳嗽和痰液产生。由于吸烟、物质燃料引起的空气污染、人口老龄化等原因,COPD在发达国家和发展中国家都有增加。许多COPD患者的生活质量会受到严重影响,COPD的恶化可能影响患者的日常生活,并成为导致住院、病情恶化和死亡的危险因素。因此,COPD还与重要的社会和经济负担有关,包括住院、工作缺勤、残疾乃至死亡[7-8]。
在影响COPD的预后因素中,患者的体重和营养状态是一个重要的指标[9],非脂肪组织指数(Fat-free mass index,FFMI)在重症COPD患者中是一个独立危险因素。COPD患者的营养不良与恶病质、肌肉减少和体重减轻有关,会导致肺功能较差,运动能力下降,并增加恶化的风险。一方面,COPD患者由于长期处于机体缺氧和炎症状态,导致胃肠道功能紊乱,从而造成营养吸收障碍,机体容易出现负氮平衡。另一方面,COPD 患者由于机体内分泌紊乱,代谢高,呼吸耗能远远高于正常人,从而导致机体分解增加,合成减少,可出现或加重机体营养不良症状[10]。提供营养补充是一项重要的治疗干预措施,通过营养补充摄入的高热量可以显著增加体重和肌肉力量,改善营养不良的COPD患者的生活质量[11]。因此,加强重症COPD患者的营养治疗已经成为一个重要的课题。
研究证明,对于肠道有功能的重症患者进行早期肠内营养支持不但可以改善患者营养不良状态,还能纠正机体免疫低下状态,改善肠道黏膜功能,降低肠道菌群移位所导致的继发感染的风险,预防消化道应激性溃疡的发生,从而促进患者病情缓解及康复[12-13]。美国肠内与肠外营养协会在《2016美国肠内与肠外营养支持指南》中提出,对于消化功能无特殊异常的重症患者,可首选经胃肠道途径给予营养支持[14]。能全力是一种高热量、含有膳食纤维的肠内营养制剂,可用于糖尿病患者。临床常将其用于危重患者恢复期肠内营养的补充,具有安全、经济、方便使用的特点,容易为患者所接受。本研究将能全力应用于需要呼吸机辅助通气的重症COPD患者,取得了较好的疗效。患者白细胞计数、C反应蛋白、降钙素原、中性粒细胞百分比均降低,说明治疗后炎症得到控制。血红蛋白、血清白蛋白、前白蛋白指标升高,提示患者营养状态较前改善。另外,本研究还观察了患者免疫球蛋白的变化。其中,IgM是感染后最先出现的抗体,有调理及激活补体的作用,一般用于早期感染的诊断。IgG是血清中含量最高的抗体,具有重要的抗感染作用。IgA则与黏膜免疫有关。本研究中,患者IgM和IgG均较治疗前升高,提示患者免疫功能较前改善。
在肠内营养的重症患者中,继发感染、腹胀、胃潴留、腹泻等是较为常见的不良反应。在重症患者中,由于较高比例使用抗生素、饮食的急剧变化、营养不良以及疾病导致的压力,容易造成肠道有益菌的消耗和致病菌的过度生长[14-16]。因此,使用益生菌恢复肠道微生态,可以减少继发感染,增强肠道功能,减少不良反应的发生[17-18]。整肠生的成分为地衣芽胞杆菌活菌,与乳杆菌和双歧杆菌等传统发酵来源的益生菌比较,芽孢杆菌对胃肠道环境具有较强的耐受性,休眠体芽孢杆菌在胃肠道中的存活率可以达到90%以上。地衣芽孢杆菌能够抑制肠道内有害菌生长,促进乳杆菌、双歧杆菌等有益菌的繁殖,还能促进肠道消化吸收的能力以及保护肠道黏膜屏障。本研究将整肠生用于重症COPD患者能全力肠内营养的联合治疗,结果表明,其对肝肾功能无不良影响,且腹胀、腹泻、胃潴留等不良反应的发生率较对照组明显降低。
综上所述,整肠生联合能全力早期肠内营养治疗,可以保证重症COPD患者的营养供给,促进机体免疫功能,有助于患者康复。同时,可以减少腹胀、腹泻、胃潴留等不良反应的发生。
参考文献:
[1] Vestbo J,Hurd SS,Agusti AG,et al.Global strategy for the diagnosis,management,and prevention of chronic obstructive pulmonary disease:Gold executive summary[J] .Am J Respir Crit Care Med,2013,187(4):347-365.
[2] Mathers CD,Loncar D.Projections of global mortality and burden of disease from 2002 to 2030[J] .PLoS Med,2006,3(11):e442.
[3] Global,regional,and national age-sex specific all-cause and cause-specific mortality for 240 causes of death,1990-2013:A systematic analysis for the global burden of disease study 2013[J] .Lancet,2015,385(9963):117-171.
[4] Thomsen M,Dahl M,Lange P,et al.Inflammatory biomarkers and comorbidities in chronic obstructive pulmonary disease[J] .Am J Respir Crit Care Med,2012,186(10):982-988.
[5] Hoepers AT,Menezes MM,Frode TS.Systematic review of anaemia and inflammatory markers in chronic obstructive pulmonary disease[J] .Clin Exp Pharmacol Physiol,2015,42(3):231-239.
[6] 慢性阻塞性肺疾病诊治指南(2013年修订版)[J] .中国医学前沿杂志(电子版),2014,6(2):67-80.
[7] Rycroft CE,Heyes A,Lanza L,et al.Epidemiology of chronic obstructive pulmonary disease:a literature review[J] .Int J Chron Obstruct Pulmon Dis,2012,7:457-494.
[8] Landis SH,Muellerova H,Mannino DM,et al.Continuing to confront COPD international patient survey:methods,COPD prevalence,and disease burden in 2012-2013[J] .Int J Chron Obstruct Pulmon Dis,2014,9:597-611.
[9] Schols AM,Slangen J,Volovics L,et al.Weight loss is a reversible factor in the prognosis of chronic obstructive pulmonary disease[J] .Am J Respir Crit Care Med,1998,157(6 Pt 1):1791-1797.
[10] 张超,王海清.慢性阻塞性肺疾病患者重症监护期间机械通气时间的影响因素分析[J] .中国医药导报,2015,12(2):65-68.
[11] Hsieh MJ,Yang TM,Tsai YH.Nutritional supplementation in patients with chronic obstructive pulmonary disease[J] .J Formos Med Assoc,2016,115(8):595-601.
[12] 梁振杰,刘俊,刘端绘,等.危重症患者应激程度与早期肠内营养达标率的关系[J] .现代临床医学,2016,42(4):289-291.
[13] 崔玲宏,王小霞.严重烧伤患者肠内营养及护理[J] .中国误诊学杂志,2012,12(3):521-522.
[14] McClave SA,Taylor BE,Martindale RG,et al.Guidelines for the provision and assessment of nutrition support therapy in the adult critically ill patient:Society of Critical Care Medicine (sccm) and American Society for Parenteral and Enteral Nutrition (aSPEN)[J] .JPEN J Parenter Enteral Nutr,2016,40(2):159-211.
[15] Manzanares W,Wischmeyer PE.Erratum to:probiotic and synbiotic therapy in critical illness:a systematic review and meta-analysis[J] .Crit Care,2017,21(1):42.
[16] Wischmeyer PE,McDonald D,Knight R.Role of the microbiome,probiotics,and ‘dysbiosis therapy’ in critical illness[J] .Curr Opin Crit Care,2016,22(4):347-353.
[17] Koekkoek KW,van Zanten AR.Nutrition in the critically ill patient[J] .Curr Opin Anaesthesiol,2017,30(2):178-185.
[18] Malik AA,Rajandram R,Tah PC,et al.Microbial cell preparation in enteral feeding in critically ill patients:a randomized,double-blind,placebo-controlled clinical trial[J] .J Crit Care,2016,32:182-188.

