不同类型止痛药对妇科腹腔镜手术术后肠麻痹的影响
杨艳峰,刘洪涛
0 引言
术后胃肠功能障碍,在所有的经腹手术后均有发生[1],主要表现为术后早期肠麻痹(POI)。其不仅引起术后各种早期胃肠道并发症,甚至因肠源性感染而引发多器官功能障碍,在增加患者医疗负担的同时,还会导致生活质量的下降[2]。POI的发生机制与诸多因素有关,麻醉用药是其中的一个重要因素。不同类型的静脉止痛药对术后早期胃肠功能影响的相关研究较少。本实验观察应用3种不同类型的静脉止痛药对腹腔镜手术后肠麻痹持续时间的影响,现报道如下。
1 资料与方法
1.1 一般资料 选择2016年12月至2017年4月于我院全麻下行子宫肌瘤剔除术的患者75例,年龄20~46岁,ASAⅠ~Ⅱ级,体重45~65 kg,随机均分3组,每组25例。排除术前肝肾功能异常、凝血功能障碍、胃肠功能疾病、神经精神疾病、止痛药物滥用史和过敏史患者。
1.2 麻醉方法 患者入室后常规监测心电图(ECG)、无创血压(BP)、动脉血氧饱和度(SpO2)、呼气末二氧化碳分压(PETCO2)。开放上肢静脉,麻醉诱导均给予长托宁0.01 mg/kg 、顺苯磺酸阿曲库铵0.15 mg/kg、舒芬太尼0.3 μg/kg、依托咪酯0.25 mg/kg。插入7.0号的气管导管,以吸入七氟醚-笑气混合气体维持麻醉深度,静脉持续泵注瑞芬太尼。维持血压波动±20%。术毕前10 min停用瑞芬太尼,并给予各组对应的负荷量后连接静脉镇痛泵。N组于手术结束前30 min给予负荷量30 mg酮咯酸氨丁三醇+0.3 mg雷莫司琼,静脉止痛泵中放生理盐水+180 mg酮咯酸氨丁三醇+0.6 mg雷莫司琼;S组于手术结束前10 min给予负荷量10 μg舒芬太尼+0.3 mg雷莫司琼,静脉止痛泵中放入生理盐水+100 μg舒芬太尼+0.6 mg雷莫司琼;B组于手术结束前30 min给予负荷量1 mg布托非诺+0.3 mg雷莫司琼,静脉镇痛泵中放入生理盐水+10 mg布托非诺+0.6 mg雷莫司琼,所有静脉镇痛泵内容量均为100 mL。术后VAS评分≥4分者,行PCA自控镇痛,力求三组患者同一镇痛水平下观察胃肠功能恢复时间的差异。
1.3 观察指标 记录各组患者停药至拔管时间,拔管即刻(T0)及术后2 h (T1)、4 h (T2)、8 h (T3)、12 h (T4)、24 h (T5)各时点的视觉模拟评分(VAS) (0分:无痛;1~3分:轻度疼痛,能忍受;4~6分:疼痛尚可忍受,但已影响睡眠;7~10分:疼痛难忍,影响食欲与睡眠)。Ramsay镇静评分(1分:激动或焦虑不安;2分:合作,服从及安静;3 分:入睡,仅对命令反应;4分:入睡,对摇晃身体或大声呼喊刺激反应;5分:入睡,对疼痛刺激才反应;6分:入睡,对上述刺激无反应。1分为镇静不足,2~4分:镇静恰当,5~6分为镇静过度)。术毕2 h后开始监测首次肠鸣音恢复及肛门排气时间。记录各组恶心、呕吐、头晕、嗜睡、过敏及呼吸抑制等不良反应发生情况。

2 结果
2.1 三组患者一般资料比较 三组患者年龄、体重、术中各类静脉或吸入药物用量、麻醉与手术时间、出血与补液量等一般资料比较差异无统计学意义。N组与S组拔管时间比较差异无统计学意义(P>0.05),但N组、S组拔管时间较B组缩短,差异有统计学意义(P<0.05)。N组、S组与B组停药至拔管时间分别为(10.84±2.26)、(11.28±2.62)、(15.68±3.62) min。
2.2 三组患者术后不同时点VAS与Ramsay镇静评分比较 术后三组患者同一时点VAS评分两两比较差异无统计学意义(P>0.05),见表1。N组、S组各时点Ramsay镇静评分差异无统计学意义(P>0.05),但N组、S组在T0~T4时点的镇静评分显著低于B组,差异有统计学意义(P<0.05),见表2。
2.3 三组患者胃肠功能恢复时间比较 N组首次肠鸣音恢复及肛门排气时间较B组、S组缩短,差异有统计学意义(P<0.05)。B组、S组比较差异无统计学意义(P>0.05)。见表3。
2.4 不良反应 N组出现恶心2例,呕吐2例,不良反应发生率为16%(4/25)。S组出现恶心5例,呕吐3例,皮肤瘙痒3例,不良反应发生率为44%(11/25)。B组出现恶心3例,呕吐4例,皮肤瘙痒1例,嗜睡4例,不良反应发生率为48%(12/25)。N组不良反应发生率显著低于B组、S组,差异有统计学意义(P<0.05)。B组与S组不良反应发生率比较差异无统计学意义(P>0.05)。
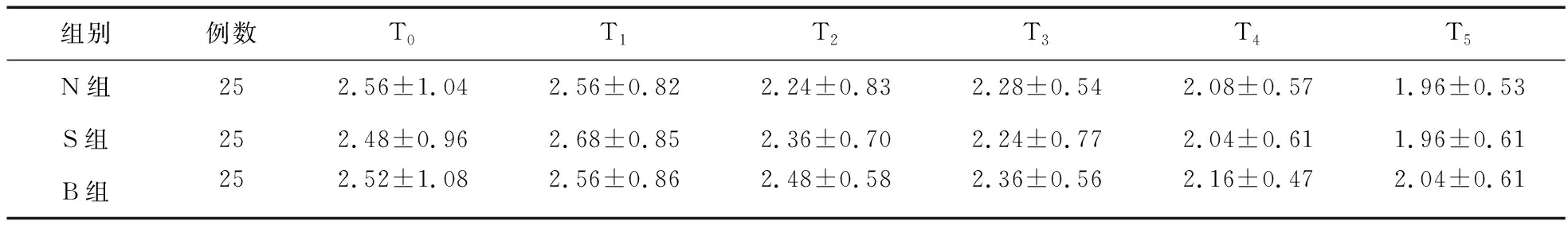
表1 三组患者PCIA治疗后不同时点VAS评分

表2 三组患者PCIA治疗后不同时点Ramsay镇静评分

表3 三组患者肠鸣音及肛门首次排气时间
3 讨论
研究表明,POI主要与下列因素有关:神经调节、炎症介质、麻醉用药及胃肠激素[3]。麻醉和手术可以通过影响以上因素或更多机制而对术后胃肠功能产生较大的影响[4]。阿片类药物通过作用分布于中枢神经系统及胃肠道神经丛的μ受体而抑制胃肠功能[5]。先前有研究发现,吗啡抑制胃肠功能,且肠道术后功能恢复时间与其用药量呈正相关性[6]。而舒芬太尼是目前已知的最强效的阿片类镇痛药,是特异性的μ受体激动剂,对μ受体的亲合力比吗啡强达数百倍[7-9]。因而,其对胃肠功能的抑制更加显著[10]。酒石酸布托啡诺属于混合型的阿片受体激动-拮抗剂,主要激动κ和σ受体,拮抗μ受体。激动强度κ∶σ∶μ=25∶4∶1。通过激动κ与σ受体而发挥良好的镇痛及镇静作用;对μ受体有部分拮抗作用[11],理论上在临床应用中对胃肠功能抑制的程度较轻,但由于其较强的镇静作用,围术期应用会引起苏醒及拔管时间延迟。
炎性因子在POI的发生中也发挥关键性的作用。可能的机制:①肠壁组织损伤促使机体大量释放炎症细胞及炎性因子,导致肠壁水肿,肠蠕动功能受到抑制。②炎性因子直接导致肠屏障功能受损,引起细菌及内毒素移位,加重机体炎症反应,进一步促进POI的发展[12]。非甾体抗炎药通过抑制环氧化酶(COX)而干扰花生四烯酸的代谢途径,从而减少前列腺素的合成,发挥镇痛、解热及抗炎的作用。近年研究发现,COX有2种不同的异构体。COX-1是结构酶,其催化合成的前列腺素,发挥保护胃黏膜、调节肾血流及血小板功能的作用,属于机体正常组分;COX-2是诱导酶,存在于炎症部位,在炎症因子的诱导下激活而促进前列腺素的生成,进而诱发疼痛和炎症反应。假如选择性抑制COX-2这一异构体的活性,可使损伤部位的疼痛及炎症反应明显减轻[13]。酮咯酸氨丁三醇以终产物酮咯酸在机体内发挥其药理学作用,镇痛、解热及抗炎作用较显著[14-15],使用的过程中无镇静和呼吸抑制的发生。通过抑制炎性因子的生成,甚至能够改善老年患者早期术后认知功能障碍[16-17]。适用于需要阿片水平镇痛药的急性中重度疼痛的短期治疗,65岁以下患者每6 h静注或肌注30 mg,最大日剂量不超过120 mg时,很少引起胃肠黏膜损害。理论上在发挥良好的镇痛作用时,可改善术后胃肠道功能,缩短POI持续时间。
经腹手术术后患者肠道功能处于不同程度的抑制状态,表现为肠麻痹,常在术后3~8 h才逐渐恢复肠道蠕动功能,于24~48 h后,待肠道功能完全恢复,此时出现肛门排气反应[18]。因而临床上以首次肠鸣音恢复和肛门排气时间作为肠道功能恢复的主要依据[19]。术后胃肠功能快速恢复,不仅缩短患者住院时间、减少医疗开支,更能提高患者术后满意度。目前临床上优化术后胃肠功能的措施主要包括实行微创手术、术后早期饮食、鼓励早期下床活动等[20]。尽管胃肠激素能够调节胃肠道功能,但是其发挥作用的具体机制仍不明确,通过调节胃肠激素改善术后胃肠功能障碍,并未达到预期效果[21]。由于术后肠麻痹的发生机制复杂,除上述外科干预措施外,我们通过优化麻醉及用药方案,对现代医学提倡开展ERAS具有重大意义[22]。
本实验中应用3种不同作用机制的镇痛药物,均能满足当前这种中等疼痛强度手术后的镇痛需求,达到满意的效果。三组患者在镇痛效果处于同一水平下,比较其术后胃肠功能恢复时间的差异,实验结果更具有说服力。
综上所述,非甾体抗炎药酮咯酸氨丁三醇不仅镇痛效果可靠,而且可以改善妇科腹腔镜下子宫肌瘤剔除术患者术后胃肠功能,缩短肠麻痹时间,不良反应发生率低。
参考文献:
[1] Vather R,Bissett I.Management of prolonged post-operative ileus:evidence-based recommendations[J].ANZ J Surg,2013,83(5):319-324.
[2] Forrester DA,Doyle-Munoz J,McTigue T,et al.The efficacy of gum chewing in reducing postoperative ileus:a multisite randomized controlled trial[J].J Wound Ostomy Continence Nurs,2014,41(3):227-232.
[3] Bragg D,El-Sharkawy AM,Psaltis E,et al.Postoperative ileus:Recent developments in pathophysiology and management[J].Clin Nutr,2015,34(3):367-376.
[4] Bauer AJ,Boeckxstaens GE.Mechanisms of postoperative ileus[J].Neurogastroenterol Motil,2004,16(Suppl 2):54-60.
[5] Crighton IM,Martin PH,Hobbs GJ,et al.A comparison of the effects of intravenous tramadol,codeine,and morphine on gastric emptying in human volunteers[J].Anesth Analg,1998,87(2):445-449.
[6] Koo KC,Yoon YE,Chung BH,et al.Analgesic opioid dose is an important indicator of postoperative ileus following radical cystectomy with ileal conduit:experience in the robotic surgery era[J].Yonsei Med J,2014,55(5):1359-1365.
[7] 刘羽,包胜华,容青霖,等.小剂量舒芬太尼预防剖宫产麻醉中寒战及牵拉痛的临床观察[J].沈阳医学院学报,2016,18(5):356-358.
[8] 曹梦如,贺海丽,刘晓鹏.舒芬太尼复合羟考酮用于剖宫产术后镇痛的临床效果[J].中国医药,2017,12(9):1392-1395.
[9] 刘毅,张娜,周桥灵,等.不同剂量舒芬太尼对喉罩通气下腹腔镜疝囊高位结扎术患儿七氟烷用量的影响[J].中国临床实用医学,2015,6(5):52-53.
[10]孙艳丽,韩宏光,历志,等.舒芬太尼对重症冠心病冠状动脉旁路移植术后Swan-Ganz飘浮导管血流动力学指标影响研究[J].临床军医杂志,2017,45(10):1046-1049.
[11]黄宇光,黄文起,李刚,等.酒石酸布托啡诺镇痛专家共识[J].临床麻醉学杂志,2011,27(10):1028-1029.
[12]Kalff JC,Schraut WH,Simmons RL,et al.Surgical manipulation of the gut elicits an intestinal muscularis inflammatory response resulting in postsurgical ileus[J].Ann Surg,1998,228(5):652-663.
[13]刘红,李国珍,葛泉丽.非甾体抗炎药的作用机制及进展[J].实用医技杂志,2003,10(4):401-402.
[14]Beltrán-Montoya JJ,Herrerias-Canedo T,Arzola-Paniagua A,et al.A randomized,clinical trial of ketorolac tromethamine vs ketorolac trometamine plus complex B vitamins for cesarean delivery analgesia[J].Saudi J Anaesth,2012,6(3):207-212.
[15]陈贤,檀文好,张碧莹,等.酮咯酸氨丁三醇和地佐辛在妇科腹腔镜手术中的超前镇痛作用研究[J].中国医药,2015,10(2):246-250.
[16]谢国柱,袁志国,卞丽玉,等.酮咯酸氨丁三醇对舒芬太尼用于老年病人术后镇痛的节俭作用[J].中华麻醉学杂志,2012,32(5):573-575.
[17]杨日辉,黄品,赵红炜,等.酮咯酸氨丁三醇超前镇痛用于妇科腹腔镜手术中的效果观察[J].中国医药指南,2012,10(13):155-156.
[18]杨泽利.手术后肠梗阻的治疗[J].中外健康文摘,2013,10(27):120-121.
[19]罗敏,曾丽文,程茂华.腹部非胃肠道手术后患者肠道功能恢复判定方式的改进[J].护理学杂志,2015,30(4):9-11.
[20]Steenhagen E.Enhanced recovery after surgery:it′s time to change practice[J].Nutr Clin Pract,2016,31(1):18-29.
[21]Vather R,O′Grady G,Bissett IP,et al.Postoperative ileus:mechanisms and future directions for research[J].Clin Exp Pharmacol Physiol,2014,41(5):358-370.
[22]周斌,肖凡,陈勇,等.围术期应用右美托咪定对结肠癌根治术后肠麻痹的影响[J].临床麻醉学杂志,2016,32(4):328-332.

