miR-630通过靶向BMI1抑制乳腺癌细胞增殖的作用机制研究
, ,, ,, (.延安市人民医院检验科,陕西 延安 76000;.延安市第二人民医院检验科,陕西 延安 76000)
乳腺癌是女性恶性肿瘤中最常见的癌症之一,占全球女性中所有新发癌症的29%(246/660)[1]。越来越多的证据支持乳腺肿瘤发生与癌基因的异常表达有关[2]。例如,HER2高表达是HER2+乳腺癌的关键驱动因素[3];BRAC1和BRAC2在病理性高级别乳腺癌中经常出现启动子甲基化、体细胞突变和基因缺失的异常表达[4]。乳腺肿瘤发生病理机制多样,值得注意的是,癌症具有抵抗细胞死亡和逃避生长抑制因子的特征,这也是导致肿瘤最终恶化的关键原因[5]。寻找新的调节分子抑制癌细胞增殖,诱导细胞凋亡可能是治疗乳腺癌的潜在治疗策略。
microRNA代表内源性非编码RNA的大家族,并在转录后调节基因表达[6]。有研究已经证明,miRNA通过介导肿瘤发生的每一个步骤,包括增殖、凋亡、存活、迁移和侵袭,许多microRNA发挥着其作为促癌因子或肿瘤抑制基因的功能[7-8]。已有报道显示,位于染色体区域15q24.1的miR-630的表达失调参与了几种人类恶性肿瘤的进展[9]。例如,miR-630的表达增加与胃癌总体生存率差有关[10];在缺氧条件下,上调的miR-630促进卵巢癌进展[11]。之前的研究表明,miR-630在各种乳腺癌细胞系以及临床乳腺癌组织中下调。miR-630通过靶向MTDH抑制乳腺癌转移[12]。然而,除了抑制乳腺癌的迁移和侵袭外,miR-630在乳腺癌进展的其他步骤(如细胞增殖或凋亡)中是否发挥其肿瘤抑制功能还需要进一步研究。
B细胞特异性病毒整合位点1(BMI1)是polycomb群复合物1(PRC1)的主要成分,在DNA损伤修复、染色质稳定性、细胞周期、细胞永生化和衰老过程中扮演着多重角色[13-14]。重要的是,BMI1的上调与某些癌症患者的化疗耐药和肿瘤复发有关[15]。在目前的研究中,我们发现miR-630通过诱导乳腺癌细胞凋亡,引起肿瘤细胞周期阻滞,抑制肿瘤细胞增殖。此外,我们将BMI1鉴定为miR-630的新靶基因,揭示了miR-630通过直接调控乳腺癌细胞系BT-549中BMI1表达水平发挥其功能机制。
1 材料与方法
1.1 材料
2014年3月至2015年3月在延安大学附属医院收集了40例组织标本,其中包括乳腺癌癌组织和相邻的正常组织。所有样本均立即保存在液氮中。手术后,储存在-80 ℃直到RNA提取。所有组织诊断都具有病理和/或细胞学证据。本研究方案经医院医学伦理委员会批准,患者知情同意。脂质体Lipofectamine 2000购自上海吉凯基因,Trizol购自美国Ambion公司。PCR试剂盒购自美国Kapa公司。荧光素酶活性检测试剂盒购自Promega公司。荧光素酶报告载体由Promega公司合成。Transwell小室购自美国Millipore公司(Millipore,Billerica,MA),Matrigel购自Bio-Rad (Bio-Rad,Madrid,Spain)。
1.2 细胞培养
人类乳腺癌细胞系(BT-549)获自中国科学院细胞库(中国上海)。所有细胞在含有10%胎牛血清和100 u/mL青霉素或100 mg/mL链霉素的Dulbecco’s改良的Eagle培养基中培养,培养条件:37 ℃含5%CO2的恒温孵箱中。
1.3 RNA分离和定量实时PCR(qRT-PCR)分析
使用TRIzol试剂从组织或细胞中分离总RNA,并按照制造商的说明书用逆转录酶(TaKaRa)和寡核苷酸(dT)合成cDNA。使用SYBR Premix Ex TaqTM II试剂盒进行实时PCR。实时PCR的条件如下:94 ℃10 s,94 ℃ 5 s,52 ℃ 30 s退火,72 ℃ 15 s,然后40个循环。本实验使用miR-630的特异性引物(正向引物,5’-TTGAGCTGGATTGGCGGGAT-3’和反向引物5’-TTGACGGATGCGGAGGGCT-3’)。作为对照,用特异性引物(正向引物5’-CATCACCATCAGGAGAGTCG-3’和反向引物5’-TGACGCTTGCCCACAGCCTT-3’)扩增U6。
1.4 细胞转染
miR-630模拟物和相应的阴性对照(miR-NC)分别转染到实验细胞株中。按照生产商的说明,使用Lipofectamine 2000(Invitrogen)将模拟物或质粒转染到细胞中。转染后24 h,收集细胞并进行基因表达分析和细胞增殖和侵袭测定。
1.5 双荧光素酶报告分析
BMI1的野生型(Wt)和突变型(Mut)3’非转录区(3’-UTR)由生物技术公司提供设计制备,并克隆到pMIR-Report质粒中,称为BMI1-WT和BMI1-Mut。对于荧光素酶测定,将1×105个细胞铺板并在12孔板中培养以达到约70%汇合。细胞与miR-630模拟物或NC共转染,检测BMI1Wt/Mut报告质粒的荧光表达活性。使用双荧光素酶报告基因测定试剂盒,转染48 h后进行萤光素酶测定。实验重复3次。
1.6 细胞增殖测定
细胞在转染后24 h以每孔5 000个细胞接种于96孔板(每孔5 000个细胞)中。使用Cell Counting Kit-8(CCK-8)在接种细胞24、48、72 h后测量细胞增殖。使用微孔板分光光度计在450 nm处测定吸光度。实验重复3次。
1.7 细胞周期分析
使用荧光激活细胞分选(FACS)流式细胞仪(FACSCalibur,Becton Dickinson)测定细胞周期分布。转染后48 h收获细胞。将细胞消化并随后在4 ℃下在70%乙醇中固定过夜。然后将固定的细胞在室温下用50 μg/mL碘化丙锭(BD Biosciences)在黑暗中染色30 min。用FACS Calibur系统和ModFit 3.0软件分析细胞周期分布。实验重复3次。
1.8 集落形成实验
进行集落形成试验以评估转染的BT-549细胞的增殖能力,将BT-549细胞在24 h后收获,然后接种到新的6孔板(200细胞/孔)中并培养约2周,直到观察到集落形成。然后,将细胞在4%多聚甲醛中固定,并通过Giemsa试剂染色。
1.9 统计学分析
定量数据采用SPSS 19.0版(IBM,USA)进行分析,并用至少3次独立实验的平均值±标准偏差(SD)表示。使用ANOVA或双向t检验比较组间差异,以P<0.05表示差异有统计学意义。
2 结果
2.1 MiR-630诱导乳腺癌细胞凋亡并抑制增殖
为了确定miR-630是否能诱导乳腺癌细胞凋亡,观察分别转染了miR-630模拟物或miR-NC的侵袭性乳腺癌细胞系BT-549细胞的形态。实验结果显示miR-630异位过度表达的细胞呈泡状,萎缩和脱离基质,类似于细胞凋亡的特征(图1a)。此外,miR-630转染的BT-549细胞中的TUNEL阳性细胞数目与在24 h、48 h、72 h和96 h的miR-NC转染的细胞相比显著增加,表明miR-630可以抑制乳腺癌细胞的增殖,促进其凋亡(图1b)。
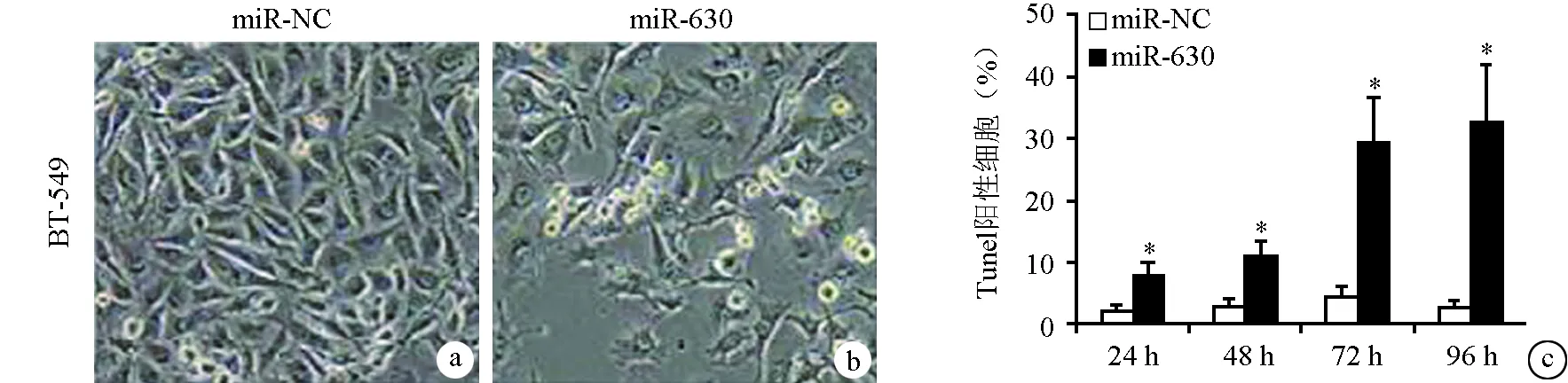
a:经过miR-NC转染的细胞;b:miR-630转染后凋亡的细胞;c:Tunel阳性细胞数 *:与miR-NC比较,P<0.05图1 miR-630诱导乳腺癌细胞凋亡并抑制增殖
2.2 miR-630诱导细胞周期停滞并减少乳腺癌细胞的集落形成
细胞周期变化总是与细胞生长停滞和凋亡相关,细胞周期分析显示,在miR-630转染24 h、48 h、72 h后,miR-630在G1/G0期显著增加BT-549细胞中的细胞百分比(从49%至70%),见图2。除了细胞无限生长和细胞凋亡抗性外,克隆增殖是肿瘤发生过程的另一个重要步骤。因此,在miR-630异位表达的BT-549细胞中使用集落形成测定法。如图3所示,与对照组相比,在miR-630过表达的细胞中形成显著较少的集落。这些结果表明miR-630的异位表达可以诱导细胞凋亡和细胞周期阻滞,抑制乳腺癌细胞的克隆增殖。

#:P<0.01图2 MiR-630诱导细胞周期停滞
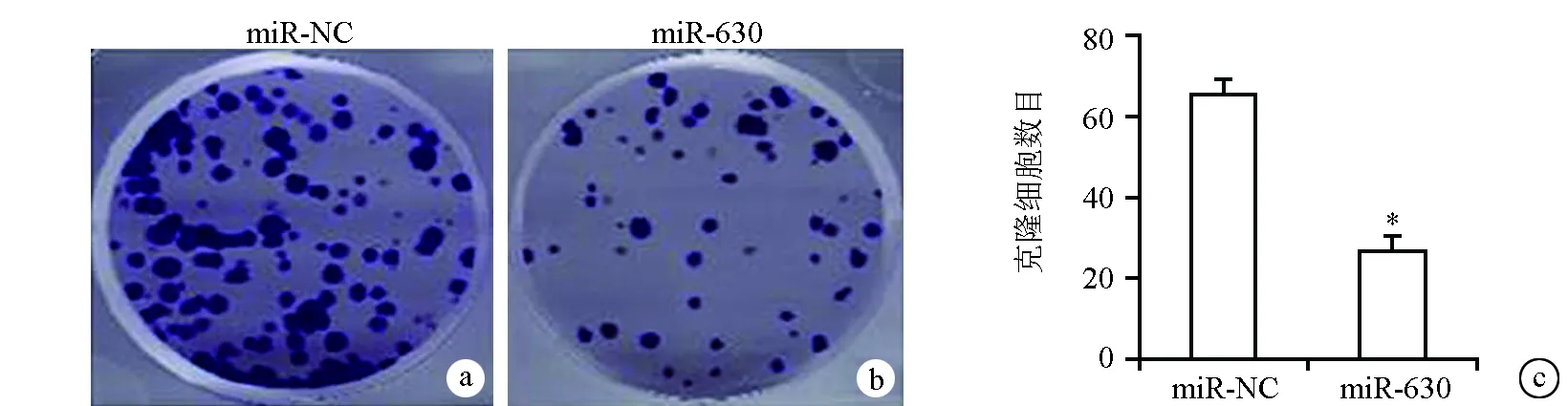
a:miR-NC转染细胞集落形成;b:miR-630转染细胞集落形成;c:转染细胞集落形成的定量分析 *:与miR-NC比较,P<0.05图3 miR-630减少乳腺癌细胞的集落形成
2.3 BMI1是miR-630的直接靶基因
为寻找miR-630的有效功能目标,本实验采用3种在线计算miRNA靶标预测算法(TargetScan,PicTar和miRanda),并重点研究凋亡相关和细胞周期相关基因,结果筛选出候选目标基因BMI1。根据Targetscan预测,BMI1的3′非翻译区(UTR)(1812-1819)上有一个miR-630结合位点(图4)。为了验证BMI1是否是miR-630的直接靶标,我们将BMI1 3′UTR的野生型和4bp突变体形式分别插入海肾荧光素酶基因下游的psiCHECK-2载体中(图4),miR-630显著抑制BT-549中海肾荧光素酶活性,当miR-630的结合位点发生突变时,HEK293T细胞受损,提示BMI1是miR-630的直接靶基因。
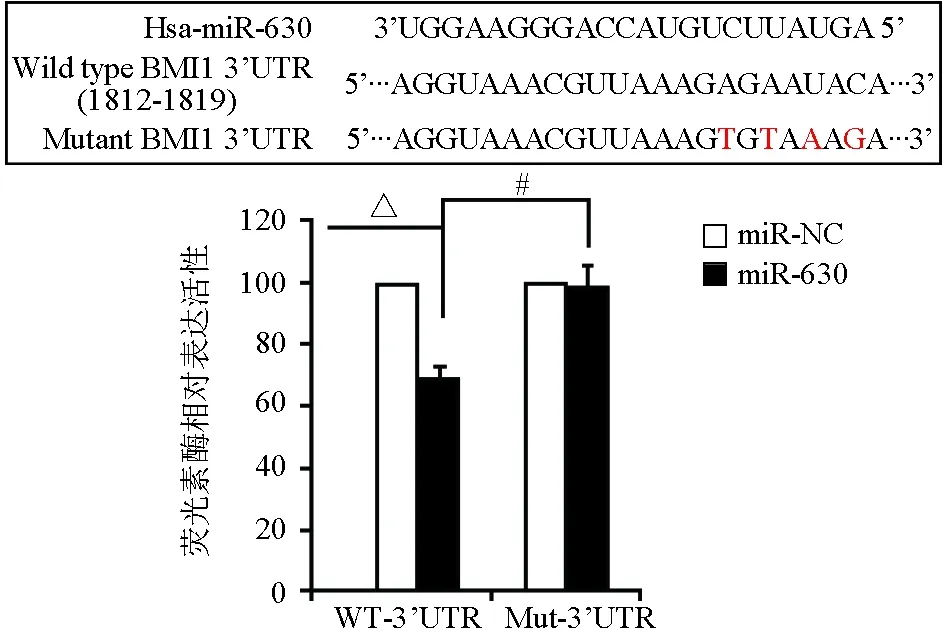
#:P<0.01;△:P<0.001图4 双荧光素酶实验检测BMI1是miR-630的直接靶基因
2.4 BMI1参与miR-630调控的乳腺癌细胞凋亡细胞周期阻滞和增殖抑制
在用siRNA消除BMI1使转染效率达到85%后,使用转染后的细胞进行凋亡率检测,在指定时间点,凋亡率连续增加;同时,抑制BMI1可阻断BT-549细胞的G0/G1期细胞周期。BMI1沉默的BT-549细胞的增殖和克隆形成能力也被显著抑制(图5)。上述实验数据证实了BMI1介导miR-630抑制乳腺癌进展的功能的观点。

a:siNC干预乳腺癌细胞的克隆形成;b:siMBI1-1干预乳腺癌细胞的克隆形成;c:siMBI1-2干预乳腺癌细胞的克隆形成;d:定量分析不同干预乳腺癌细胞的克隆形成 *:P<0.05;#:P<0.01;△:P<0.001
图5转染MBI1后对细胞克隆形成能力的影响
3 讨论
miR-630在非小细胞肺癌A549细胞中首次被发现可以诱导顺铂耐药的产生,并在细胞周期的G0/G1期中增加了被阻滞的细胞的增殖,导致A549细胞对顺铂耐药性增强[16]。在随后的研究中,对于miR-630在不同类型的肿瘤类型中已经提出了肿瘤抑制和肿瘤促进的差异作用。miR-630的表达在肝细胞癌组织中显着增加,缺氧条件下在卵巢癌细胞中诱导其凋亡进展[17]。在乳腺癌组织中,miR-630表达水平下调抑制乳腺癌转移并增加药物敏感性[18]。为了进一步揭示miR-630肿瘤抑制功能的机制,本研究检测了miR-630在乳腺癌细胞系中的凋亡、细胞周期调控和细胞生长的功能机制。此外,我们还提出miR-630阻断细胞周期过程并抑制乳腺癌细胞的再生。这与Zhou等[19]提出的miR-630异位过表达上调了细胞周期相关蛋白p21、p27和DNA损伤敏感标记pγH2AX等蛋白的表达水平的实验结论相一致,进一步支持了miR-630的细胞周期阻滞和凋亡诱导功能。
BMI1是polycomb组家族成员,在多种肿瘤组织中表达上调[20]。有研究显示其在正常干细胞和祖细胞的细胞周期和增殖调控活性中起作用,其高表达与化疗耐药呈正相关[21]。BMI1的高度激活可以绕过细胞衰老,并因此通过促进细胞周期进程促进肿瘤发生和细胞转化。同时,BMI1通过结合并稳定催化亚基RING2/RING1b来催化组蛋白H2A(H2A-K119Ub)赖氨酸(K)119处的单泛素化,从而增强PRC1的E3泛素连接酶活性,进而修饰染色质并抑制多个基因位点,其中定位了促进p53-pRb轴功能的肿瘤抑制基因[22]。在神经干细胞(NSC)中,shRNA介导的BMI1减少导致p21表达的显著增加,并且随后作为胚胎和成人NSC增殖和自我更新的关键介质[23]。因此,BMI1的功能性失活频繁阻断细胞周期中G1期至S期的转变并导致凋亡,说明BMI1是一个重要的癌基因。本研究通过双荧光素酶报告基因测定证实BMI1是miR-630的直接靶基因。此外,利用两种特异性靶向siBMI1的RNA干扰技术抑制BMI1的表达,并成功模拟miR-630的功能,包括诱导细胞凋亡,引起肿瘤细胞G0/G1期周期阻滞,抑制细胞增殖和集落形成能力。
近来,已经报道了几种miRNA,包括miR-16、miR-128、miR-141、miR-183、miR-203、miR-200c、miR-200b能够靶向BMI1并影响其功能[24]。例如,miR-15a和miR-16介导BMI1的表达下调,其阻碍DNA修复,而升高的水平可以使乳腺癌细胞对阿霉素敏感,导致细胞凋亡[25]。miR-128特异性阻断符合BMI1下调的胶质瘤自我更新[26]。众所周知,特定的miRNA可以靶向不同的基因,并且特定的蛋白质编码基因可以被不同的miRNA转录后调节。因此,包括miR-630、miR-16、miR-128、miR-200c等在内的一组miRNA可能包含一个复杂的网络,通过调控BMI1在乳腺癌进展中发挥重要作用。
综上所述,本实验证实miR-630可以靶向BMI1,从而诱导BMI1介导的乳腺癌细胞凋亡和细胞周期停滞,以及乳腺癌细胞的再生阻断。上述数据提供了miR-630依赖性BMI1对乳腺癌细胞整体调控的机制,以及抑制其进展的全面分析,并提供了治疗乳腺癌的治疗潜力,为miR-630和BMI1成为乳腺癌临床治疗靶点提供理论依据。
[参考文献]
[1] Ali AM,Schmidt MK,Bolla MK,et al.Alcohol consumption and survival after a breast cancer diagnosis: a literature-based meta-analysis and collaborative analysis of data for 29,239 cases[J].Cancer Epidemiol Biomarkers Prev,2014,23(6):934-945. doi: 10.1158/1055-9965.EPI-13-0901.
[2] DeSantis CE,Bray F,Ferlay J,et al.International variation in female breast cancer incidence and mortality rates[J].Cancer Epidemiol Biomarkers Prev,2015,24(10):1495-1506.doi: 10.1158/1055-9965.EPI-15-0535.
[3] Paci E,Broeders M,Hofvind S,et al.European breast cancer service screening outcomes:a first balance sheet of the benefits and harms[J].Cancer Epidemiol Biomarkers Prev,2014,23(7):1159-1163. doi: 10.1158/1055-9965.EPI-13-0320.
[4] Parada H,Bradshaw PT,Engel LS,et al.Environmental tobacco smoke exposure and survival following breast cancer[J].Cancer Epidemiol Biomarkers Prev,2017,26(2):278-280. doi: 10.1158/1055-9965.EPI-16-0658.
[5] Ban KA,Godellas CV.Epidemiology of breast cancer[J].Surg Oncol Clin N Am,2014,23(3):409-422.doi:10.1016/S1470-2045(00)00254-0.
[6] Venkatadri R,Muni T,Iyer AKV,et al.Role of apoptosis-related miRNAs in resveratrol-induced breast cancer cell death[J].Cell Death Dis,2017,7(2):e2104.doi:10.1038/cddis.2016.6.
[7] Wojtas B,Ferraz C,Stokowy T,et al.Differential miRNA expression defines migration and reduced apoptosis in follicular thyroid carcinomas[J].Mol Cell Endocrinol,2014,388(1-2):1-9. doi: 10.1016/j.mce.2014.02.011.
[8] Hauser B,Zhao Y,Pang X,et al.Functions of MiRNA-128 on the regulation of head and neck squamous cell carcinoma growth and apoptosis[J].PLoS One,2015,10(3):e0116321.doi:10.1371/journal.pone.0116321.
[9] Corcoran C,Rani S,Breslin S,et al.miR-630 targets IGF1R to regulate response to HER-targeting drugs and overall cancer cell progression in HER2 over-expressing breast cancer[J].Mol Cancer,2014,13:71.doi: 10.1186/1476-4598-13-71.
[10] Chu D,Zhao Z,Li Y,et al.Increased microRNA-630 expression in gastric cancer is associated with poor overall survival[J].PloS one,2014,9(3):e90526.doi:10.1371/journal.pone.0090526.
[11] Zhang S,Zhang JY,Lu LJ,et al.MiR-630 promotes epithelial ovarian cancer proliferation and invasion via targeting KLF6[J].Eur Rev Med Pharmacol Sci,2017,21(20):4542-4547.
[12] Tong L,Chu M,Yan B,et al.MTDH promotes glioma invasion through regulating miR-130b-ceRNAs[J].Oncotarget,2017,8(11):17738.doi: 10.18632/oncotarget.14717.
[13] Hu X,Feng Y,Zhang D,et al.A functional genomic approach identifies FAL1 as an oncogenic long noncoding RNA that associates with BMI1 and represses p21 expression in cancer[J].Cancer cell,2014,26(3):344-357.doi:10.1016/j.ccr.2014.07.009.
[14] Paranjape AN,Balaji SA,Mandal T,et al.Bmi1 regulates self-renewal and epithelial to mesenchymal transition in breast cancer cells through Nanog[J].BMC cancer,2014,14(1):785.doi:10.1186/1471-2407-14-785.
[15] Du R,Xia L,Ning X,et al.Hypoxia-induced Bmi1 promotes renal tubular epithelial cell-mesenchymal transition and renal fibrosis via PI3K/Akt signal[J].Mol Biol Cell,2014,25(17):2650-2659. doi: 10.1091/mbc.E14-01-0044.
[16] Wu DW, Wang YC, Wang L, et al.A low microRNA-630 expression confers resistance to tyrosine kinase inhibitors in EGFR-mutated lung adenocarcinomas via miR-630/YAP1/ERK feedback loop[J].Theranostics,2018;8(5):1256-1269.doi: 10.7150/thno.22048. eCollection 2018.
[17] Zhou CX,Wang CL,Yu AL,et al.MiR-630 suppresses breast cancer progression by targeting metadherin[J].Oncotarget,2016,7(2):1288.doi:10.18632/oncotarget.6339.
[18] Li X,Lin Y,Yang X,et al.Long noncoding RNA H19 regulates EZH2 expression by interacting with miR-630 and promotes cell invasion in nasopharyngeal carcinoma[J].Biochem Biophys Res Commun,2016,473(4):913-919.doi:10.1016/j.bbrc.2016.03.150.
[19] Zhou L,Zhang H,Li C,et al.MicroRNA-630 acts as a prognostic marker in gastric cancer and its role in cell migration and invasion[J].Int J Clin Exp Pathol,2017,10(5):4969-4978.
[20] Mourgues L,Imbert V,Nebout M,et al.The BMI1 polycomb protein represses cyclin G2-induced autophagy to support proliferation in chronic myeloid leukemia cells[J].Leukemia,2015,29(10):1993-2002.doi:10.1038/leu.2015.112.
[21] Ferretti R,Bhutkar A,McNamara MC,et al.BMI1 induces an invasive signature in melanoma that promotes metastasis and chemoresistance[J].Genes Dev,2016,30(1):18-33. doi: 10.1101/gad.267757.115.
[22] Ren H,Du P,Ge Z,et al.TWIST1 and BMI1 in cancer metastasis and chemoresistance[J].J Cancer,2016,7(9):1074-1080.doi:10.7150/jca.14031.
[23] Zheng X,Wang Y,Liu B,et al.Bmi-1-shRNA inhibits the proliferation of lung adenocarcinoma cells by blocking the G1/S phase through decreasing cyclin D1 and increasing p21/p27 levels[J].Nucleic Acid Ther,2014,24(3):210-216. doi: 10.1089/nat.2013.0459.
[24] Yu J,Lu Y,Cui D,et al.miR-200b suppresses cell proliferation,migration and enhances chemosensitivity in prostate cancer by regulating Bmi-1[J].Oncol Rep,2014,31(2):910-918.doi:10.3892/or.2013.2897.
[25] Patel N,Garikapati KR,Ramaiah MJ,et al.miR-15a/miR-16 induces mitochondrial dependent apoptosis in breast cancer cells by suppressing oncogene BMI1[J].Life Sci,2016,164:60-70.doi:10.1016/j.lfs.2016.08.028.
[26] Yu WW,Jiang H,Zhang CT,et al.The SNAIL/miR-128 axis regulated growth,invasion,metastasis,and epithelial-to-mesenchymal transition of gastric cancer[J].Oncotarget,2017,8(24):39280.doi:10.18632/oncotarget.1684.

