飞蝗几丁质酶5-1抗体制备及表达特性分析
张婷婷,柳伟伟,2,高璐,2,李任建,2,付穗业,2,刘晓健,李大琪,3,刘卫敏,董卿,2,张建珍
飞蝗几丁质酶5-1抗体制备及表达特性分析
张婷婷1,柳伟伟1,2,高璐1,2,李任建1,2,付穗业1,2,刘晓健1,李大琪1,3,刘卫敏1,董卿1,2,张建珍1
(1山西大学应用生物学研究所,太原 030006;2山西大学生命科学学院,太原 030006;3山西省农业科学院植物保护研究所,太原 030031)
【目的】通过制备飞蝗()几丁质酶5-1()的多克隆抗体,建立飞蝗体内LmCht5-1蛋白水平检测方法,分析LmCht5-1在4龄飞蝗的表达特性及组织定位。【方法】采用MEGA 软件对LmCht5-1和LmCht5-2氨基酸序列进行比对,利用Expression网站对LmCht5-1氨基酸序列进行抗原表位预测分析,获得LmCht5-1抗原结构区域;以飞蝗cDNA为模板,通过PCR扩增的抗原片段;同时通过酶切连接构建含有鸡血清白蛋白OVA的载体pET32a-OVA;然后通过酶切连接将插入到pET32a-OVA载体构建pET32a-OVA-LmCht5-1;将pET32a-OVA-LmCht5-1转入表达菌株BL21(DE3)中,IPTG诱导表达重组蛋白OVA-LmCht5-1;利用Ni-NTA纯化后免疫新西兰白兔,制备多克隆抗体。通过ELISA方法检测抗体效价;利用Western blot检测抗体特异性。提取4龄飞蝗不同日龄表皮,采用Western blot分析LmCht5-1蛋白表达模式。对4龄飞蝗注射ds,检测蛋白水平LmCht5-1表达量,并通过免疫组化方法对LmCht5-1进行定位及功能分析。【结果】通过和序列比对和抗原表位预测分析,获得LmCht5-1的471—533AA可作为抗原区域;通过酶切连接分别获得pET32a-OVA和pET32a-OVA-LmCht5-1。经诱导表达和纯化后获得重组蛋白OVA-LmCht5-1,分子量为71.34 kD;免疫后制备多克隆抗体OVA-LmCht5-1,ELISA检测效价为1﹕102 400。多克隆抗体OVA-LmCht5-1用于Western blot检测时可特异性识别LmCht5-1,与LmCht5-2蛋白无交叉反应。利用Western blot方法检测4龄若虫各日龄表皮中LmCht5-1蛋白的表达,发现LmCht5-1蛋白随发育日龄其表达量逐渐增加,在蜕皮当天达到峰值,蜕皮后快速降至最低点。对飞蝗若虫N4D2注射ds,检测到在N4D5时,的转录水平和蛋白水平均被显著抑制,抑制率分别为70.0%和73.6%。选取注射ds和ds的4龄飞蝗表皮,进行免疫组化实验显示LmCht5-1定位于表皮细胞和旧表皮中,其功能失活引起旧表皮中几丁质不降解。【结论】获得飞蝗LmCht5-1多克隆抗体可特异性识别LmCht5-1,可用于Western blot和免疫组化检测。明确LmCht5-1在飞蝗4龄若虫蜕皮当天表达最高,定位于表皮细胞和旧表皮中。ds可减少表皮细胞和旧表皮中LmCht5-1的表达,阻碍旧表皮中几丁质的降解。
飞蝗;几丁质酶5-1;抗体制备;表达分析;Western blot
0 引言
【研究意义】飞蝗()是重要的世界性农业害虫,其表皮周期性的生成与降解是重要的生物学现象,研究表皮发育对害虫防治具有重要意义。【前人研究进展】飞蝗表皮富含几丁质,其周期性的降解由几丁质酶等催化完成。几丁质酶5(chitinase5,Cht5)属于Group I,是第一个被鉴定的昆虫几丁质酶基因(),由Kramer等[1]于1993年从烟草天蛾()的蜕皮液中分离得到,之后该基因的直系同源基因在至少15个昆虫物种中被陆续分离鉴定[2-5],被认为参与昆虫表皮几丁质的降解[6-7]。Cht5在飞蝗中具有基因复制现象[8],飞蝗Cht5包含和两个基因,其中含有信号肽、几丁质结合域和催化域,与已报道的昆虫基因直系同源,通过向5龄若虫注射ds,发现影响飞蝗5龄若虫到成虫期的蜕皮发育,造成飞蝗蜕皮困难而死亡;而抑制无可见异常表型。通过几丁质结合蛋白Knickkopf(Knk)和Cht5蛋白在赤拟谷盗()表皮的定位分析,发现Knk蛋白和Cht5蛋白共定位于新合成的表皮,提出Knk蛋白的新功能,即保护新合成几丁质不被几丁质酶降解[9]。YU等[10]通过几丁质脱乙酰基酶2(CDA2)在飞蝗表皮的蛋白定位,发现该蛋白主要定位在外表皮(exocuticle)与上表皮(epicuticle)之间,结合生化和电镜结果,发现了昆虫CDA2的新功能,即连接外表皮和上表皮,具有支架作用,启动几丁质螺旋结构的形成和有序紧密排列。【本研究切入点】LmCht5-1的抗体缺乏,影响对其表达特性及功能的分析。制备高特异性LmCht5-1抗体,有利于解析其功能及与LmCht5-2的功能分化。【拟解决的关键问题】通过序列比对和抗原表位预测分析,获得抗原结构区域,通过与高免疫原性鸡卵清白蛋白偶联制备高效多克隆抗体,检测抗体效价与特异性,分析在飞蝗不同发育日龄的表达特性及组织定位;解析LmCht5-1蛋白缺失对表皮几丁质降解的影响。为后续深入解析功能及其与的功能分化研究提供试验材料和平台条件。
1 材料与方法
试验于2016—2017年在山西大学应用生物学研究所完成。
1.1 材料
试虫:试验用飞蝗饲养于山西大学应用生物学研究所昆虫培养室。饲养条件:室温28—30℃,光照14L﹕10D,相对湿度15%—25%。挑选大量3龄飞蝗若虫进行同步化培养。取4龄各日龄飞蝗的表皮进行分析。
主要试剂:载体pET32a和JMB88-OVA为实验室保存。IPTG、X-Gal购于索莱宝公司。蛋白纯化Ni-NTA柱和RiboMAXTMExpression RNAi System购于Promega公司。Trizol、HiFi cDNA-script、SYBR Green、2×Tag Mix购自康为世纪,其他试剂均为分析纯。
1.2 飞蝗LmCht5-1高免疫活性载体构建
1.2.2 pET32a-OVA-LmCht5-1构建 利用双酶切方法从JMB88-OVA中酶切获得OVA片段并插入至pET32a的对应酶切位点处,获得pET32a-OVA载体。设计抗原序列的扩增引物(表1),酶切位点选用d III和I。以飞蝗表皮cDNA为模板,通过PCR方法,扩增抗原序列。利用d III和I同时双酶切和pET32a-OVA,连接获得pET32a-OVA-LmCht5-1。引物序列为d IIIF:gggATGGATGTCGAC TGCAGCGACG和I R:G AGGCTGTGCTTGGCCATGGAGC。
1.3 pET32a-OVA-LmCht5-1蛋白表达及纯化
1.3.1 pET32a-OVA-LmCht5-1蛋白诱导表达 将载体pET32a-OVA-LmCht5-1通过42℃热激的方法转化至BL21(DE3)感受态中,在LB+Amp平板中进行筛选。挑取单克隆摇菌至OD600为0.6,加0.5 mmol·L-1IPTG于37℃诱导培养4 h。12 000 r/min离心1 min收集细菌沉淀,超声波破碎后离心,分离上清与沉淀,通过12% SDS-PAGE电泳确定目的蛋白的表达部位。
1.3.2 蛋白OVA-LmCht5-1和OVA的Ni-NTA纯化 将OVA-LmCht5-1菌液接种至400 mL LB培养基中,16℃过夜诱导。12 000 r/min离心1 min收集细菌沉淀,超声波破碎后,12 000 r/min离心1 min收集包涵体。利用50 mmol·L-1Tris-HCl+200 mmol·L-1NaCl+8 mol·L-1尿素溶解包涵体后,使用Ni-NTA系统对溶解的包涵体蛋白进行纯化。采用不同浓度咪唑进行逐级洗脱,并收集洗脱液馏分。利用12% SDS-PAGE蛋白胶检测蛋白浓度和纯度。收集蛋白纯度较高的洗脱馏分,采用分子量为30 kD的超滤离心管(Millipore)对其进行超滤浓缩,12 000 r/min离心获得超滤液。利用BCA试剂盒测定蛋白浓度。采用同样条件对OVA蛋白进行表达与纯化。
1.4 OVA-LmCht5-1抗体制备及效价检测
1.4.1 OVA-LmCht5-1抗体制备方法 委托华大公司通过以下程序免疫新西兰白兔以制备多克隆抗体,具体方法:取纯化后的OVA-LmCht5-1蛋白400 μg,生理盐水稀释至500 μL,与等体积的弗氏完全佐剂混合,充分混匀,制备油包水结构,对2.0 kg左右的新西兰白兔的背部进行皮下注射,完成初次免疫。14 d与21 d分别进行一次加强免疫。在免疫之前通过耳静脉取阴性血清用做后期蛋白特异性的检测。28 d时,颈动脉取血收集全血,5 000 r/min离心10 min,2次离心后收取血清作为多克隆抗体血清[11]。
1.4.2 OVA-LmCht5-1效价检测 采用ELISA方法测定所制备抗体的效价[12]。抗原包被为OVA-LmCht5-1抗原蛋白,终浓度为2 μg·mL-1,一抗为多抗血清,从200倍开始用PBS梯度稀释,设置PBS为空白对照(Blank),以PBS稀释的200倍阴性血清作为阴性对照(negative);二抗为稀释20 000倍的羊抗兔HRG,显色后加50 μL终止液终止反应;双波长(450/630 nm)测吸光值。抗体效价为1/2最大OD值所对应的稀释倍数[13]。
1.5 OVA-LmCht5-1抗体特异性检测
1.5.1 蛋白水平检测OVA-LmCht5-1抗体特异性 取原核表达蛋白OVA-LmCht5-1和OVA检测OVA-LmCht5-1抗体是否识别OVA;取笔者课题组利用昆虫病毒表达系统获得的真核蛋白[14]--acetylglucosaminidase(eLmNAG)、eukaryotic expression LmCht5-1(eLmCht5-1)和eukaryotic expression Cht5-2(eLmCht5-2),通过Western blot鉴定OVA-LmCht5-1抗体是否准确区分eLmCht5-1和eLmCht5-2;取飞蝗中肠与表皮蛋白样品用于检测OVA-LmCht5-1对组织样品检测的灵敏度和特异性。以上蛋白样品浓度调整为500 ng·μL-1,上样量均为30 μL,用于后续Western blot检测。
1.5.2 Western blot检测LmCht5-1 采用12% SDS-PAGE分离胶蛋白样品,电泳条件为80 V 30 min,120 V 40 min。电泳结束后,采用湿转方法将蛋白转印至PVDF膜,湿转条件为150 V,45 min。利用含10% BSA的TBS溶液在常温下封闭1 h。TBST清洗3次,每次5 min。将OVA-LmCht5-1抗体稀释2 000倍后进行孵育,时间为1 h,TBST洗涤3次,每次10 min。二抗孵育羊抗兔IgG,时间为1 h,TBST洗涤5次,每次10 min。利用奥德赛双红外荧光捕捉信号并采集图像。设置免疫前阴性血清为阴性对照,检测抗体的特异性。
除了全要素生产率 (ln TFP)之外,本文参考以往研究还提出如下控制变量:企业规模 (ln size)、 企业年龄 (ln age)、资本密集度 (ln capints)、综合税率(taxrt)、 是否国企(equnat)、 有无外资(forcap)。具体变量定义见表1。
1.6 LmCht5-1在飞蝗不同发育日龄表皮中的表达特性
选择4龄第1天(N4D1)至N4D5和N5D1的若虫表皮,检测不同发育日龄飞蝗表皮中蛋白的表达特性。以上所有样品均取3个生物学重复,每个生物学重复3头若虫。分离飞蝗背部表皮,加入RIPA+PMSF+DTT混合液后子冰上进行匀浆,放置30 min后,离心取上清。采用BCA方法测定蛋白浓度,调整蛋白浓度为300 ng·μL-1。蛋白检测参照1.5.2。利用灰度分析计算不同日龄表皮中LmCht5-1相对于-actin的表达量,观察LmCht5-1表达量的变化以及对表皮发育的影响。
1.7 dsLmCht5-1的合成、注射与蛋白样品制备
ds的合成与注射参照实验室标准步骤进行[15-16]。选取4龄第2天飞蝗若虫进行dsRNA注射,同时注射ds作为对照组。将dsRNA从飞蝗第2和3腹节连接处注入体腔,注射量为10 μg/头,设置3个生物学重复,每个重复5头若虫。在注射后第5天取样,分离飞蝗腹部背面表皮,方法参照1.6。
1.8 LmCht5-1在表皮中的组织定位及功能
取1.7中N4D4的表皮进行固定。按照标准石蜡切片制备方法制备飞蝗表皮切片[17]。利用OVA- LmCht5-1抗体染色确定LmCht5-1的表达定位。切片厚度为5 μm,每张载玻片上保留3—5张切片。将表皮石蜡切片进行抗原修复,双氧水处理后,滴加1滴1﹕1 000稀释的OVA-LmCht5-1抗体,室温孵育2 h。洗涤后滴加1滴聚合物增强剂,室温孵育20 min。再次洗涤滴加1滴羊抗兔HRP,室温孵育30 min。PBS(pH 7.4)冲洗3次,每次5 min。
利用Fluorescent Brightener 28(FB28)染色确定ds干扰对表皮几丁质的影响。在上述石蜡切片中滴加1滴FB28,室温孵育10 min,中性树胶封固,晾干后荧光显微镜下观察,以确定样品中几丁质的变化。
2 结果
2.1 飞蝗LmCht5-1高免疫活性载体构建
利用MEGA软件将和氨基酸序列进行比对,发现的前445AA与序列一致度极高,此区域无法作为抗原制备抗体而区分和。在446AA后,与氨基酸序列一致度上较低(图1-A),此区域与其他比对的相似度较低。利用软件BepiPred Server 2.0分析发现,的471—533AA氨基酸序列富含抗原表位,可以作为制备的抗原序列。
利用ClonemanageV7软件将与抗原序列进行虚拟偶联后,通过TMHMM预测,发现该融合蛋白可溶性差。随后通过酶切连接将JMB88- OVA中的OVA片段连接至原核表达载体pET32a中,构建pET32a-OVA骨架载体(图1-B);然后通过PCR扩增获得抗原片段,通过酶切连接后插入至pET32a-OVA中,获得可表达的高特异性抗原表达载体pET32a-OVA- LmCht5-1(图1-C)。
2.2 OVA-LmCht5-1蛋白表达与纯化
将构建好的pET32a-OVA和pET32a-OVA- LmCht5-1分别转化BL21(DE3)感受态,挑取阳性克隆在LB+Amp培养基中过夜培养。隔日1﹕100接种,37℃培养4 h后,加0.5 mmol·L-1IPTG在16℃过夜诱导。收集菌液,超声波破碎后,分别收集上清和沉淀,利用12% SDS-PAGE进行检测。发现OVA蛋白在沉淀中表达,分子量为64.37 kD,OVA-LmCht5-1重组蛋白也在沉淀中表达,分子量为71.34 kD(图2-A)。
按照上述培养条件将pET32a-OVA-LmCht5-1扩大培养至400 mL,破碎收集沉淀,用含8 mol·L-1尿素的缓冲液溶解包涵体后,利用Ni-NTA纯化进行。蛋白上柱前PB中大量OVA-LmCht5-1,而结合缓冲液BB中蛋白量明显减少,说明Ni柱对OVA-LmCht5-1有较强的结合能力。咪唑梯度洗脱后,在50—500 mmol·L-1的馏分中OVA-LmCht5-1量大,且条带单一,杂蛋白含量少。收集50—500 mmol·L-1咪唑下的馏分,利用30 kD超滤离心管进行超滤浓缩。利用BCA测定总蛋白浓度为400 μg·mL-1,可用于制备多克隆抗体(图2-B),同时纯化OVA蛋白,通过Ni-NTA纯化发现,OVA蛋白在100和200 mmol·L-1咪唑浓度下的馏分中条带单一,收集在100和200 mmol·L-1咪唑浓度下的馏分,利用30 kD超滤离心管进行超滤浓缩,用于后续抗体特异性检测与分析(图2-C)。
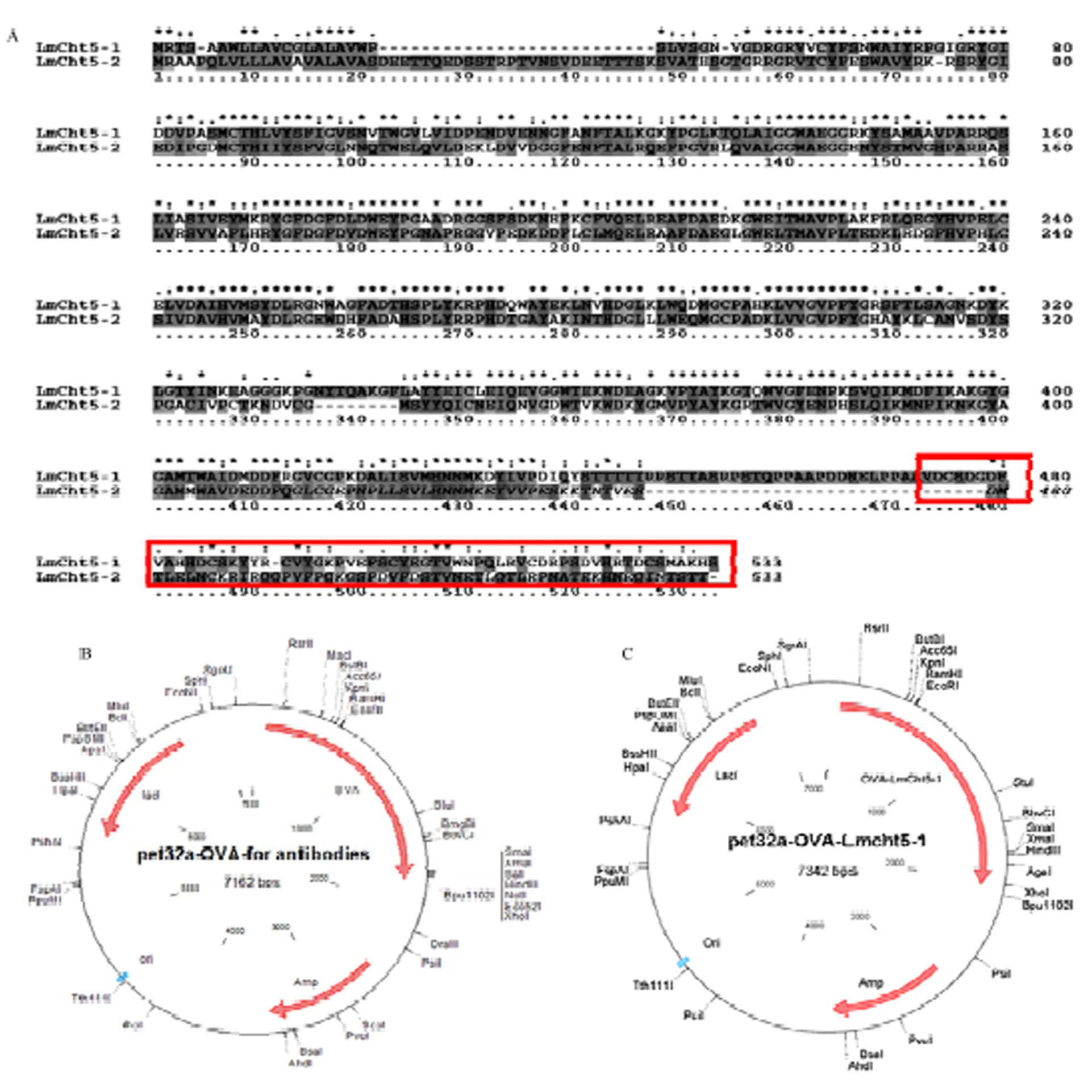
A:LmCht5-1与LmCht5-2比对获得特异性抗原序列LmCht5-1 specific antigen sequences through alignment with LmCht5-2;B:高免疫原性抗原通用载体pET32a-OVA Common high immunogenicity plasmid pET32a-OVA;C:OVA-LmCht5-1抗原表达载体Antigen expression plasmid pET32a-OVA
2.3 OVA-LmCht5-1 抗体制备及效价检测
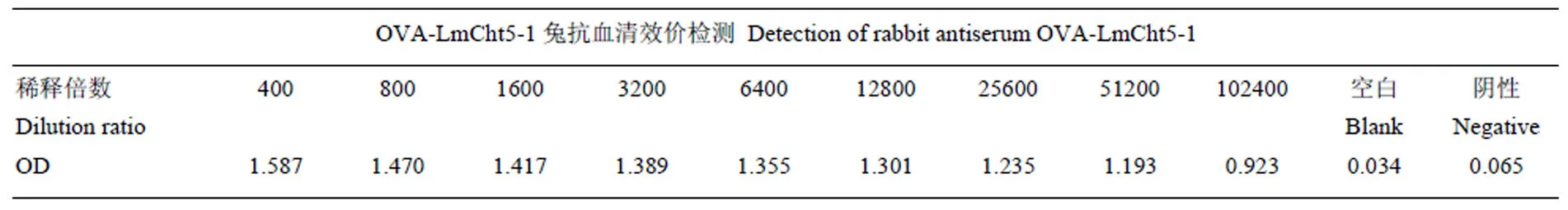
委托华大公司将OVA-LmCht5-1抗原与弗氏完全佐剂混合后注射新西兰白兔,并进行两次加强免疫。28 d后从颈动脉收集兔血液,通过离心收集到50 mL兔抗OVA-LmCht5-1血清抗体。在96孔酶标板中包被抗原蛋白OVA-LmCht5-1,利用ELISA方法检测发现兔抗OVA-LmCht5-1抗体效价可达到1﹕102 400(表1),抗体产生效果良好,可用于后续Western blot和免疫组化检测。
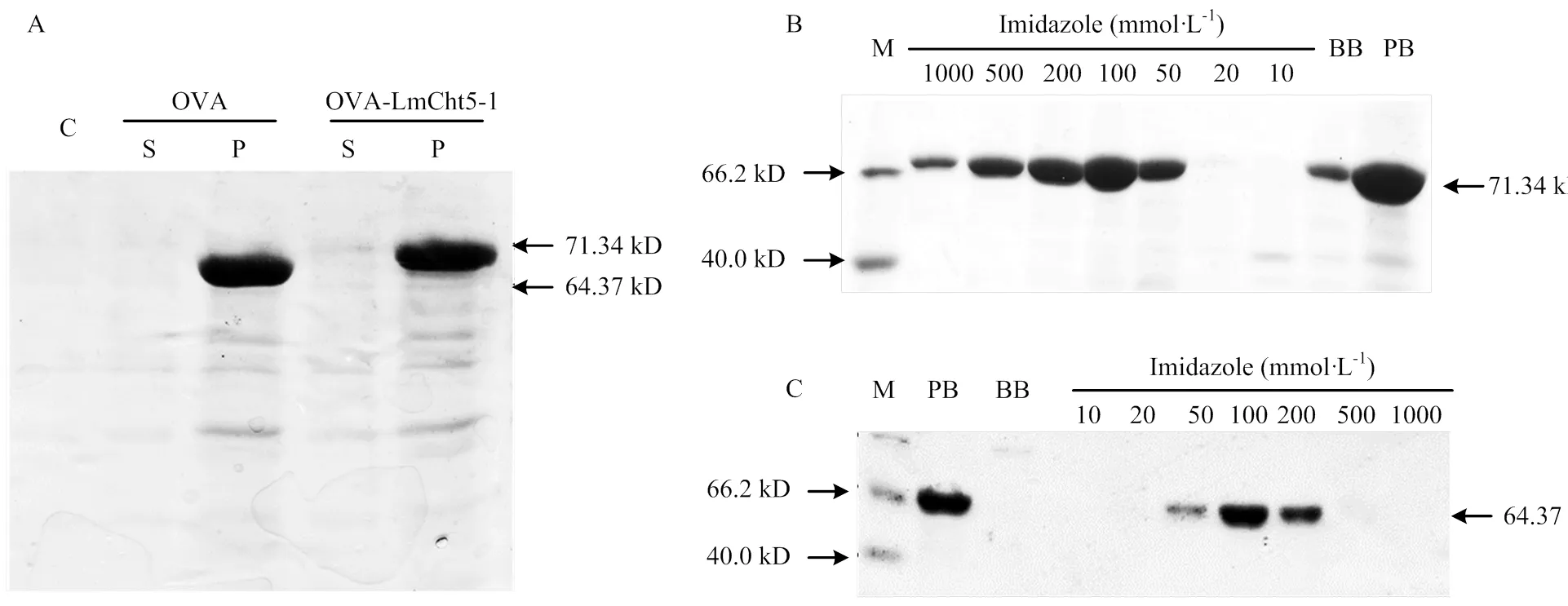
A:OVA和OVA-LmCht5-1原核表达The expression of OVA and OVA-LmCht5-1;B:抗原蛋白OVA-LmCht5-1纯化The purification of OVA-LmCht5-1;C:OVA蛋白纯化The purification of OVA。C:对照Control;S:上清Supernatant;P:沉淀precipitate;M:marker;PB:纯化前蛋白Protein before purification;BB:结合缓冲液Binding buffer
表1 抗体效价检测
Table 1 Detection of antibody titer
2.4 OVA-LmCht5-1 抗体特异性检测
采用Western blot方法检测OVA-LmCht5-1抗体的特异性。所选抗原蛋白为原核表达蛋白OVA- LmCht5-1和OVA、真核表达蛋白NAG、eCht5-1和eCht5-2[14]。抗体OVA-LmCht5-1与抗原蛋白OVA- LmCht5-1杂交产生条带为71.34 kD,与OVA杂交显示条带为64.37 kD,说明抗体OVA-LmCht5-1能有效识别OVA-LmCht5-1和OVA的原核蛋白。抗体OVA-LmCht5-1与eLmNAG、eLmCht5-2杂交不显示任何条带,而可以在eLmCht5-1中识别分子量为57.0 kD的蛋白,说明该抗体有效识别LmCht5-1抗原,而不识别LmCht5-2抗原,实现对LmCht5-1和LmCht5-2的区分。提取飞蝗肠道MT和表皮CT的蛋白进行检测,发现OVA-LmCht5-1可识别样品中分子量为56.0 kD的蛋白,与预样本中LmCht5-1蛋白大小一致,表明OVA-LmCht5-1抗体可用于检测飞蝗表皮中LmCht5-1的表达(图3-A)。同时将免疫前阴性血清识别上述抗原,未有任何条带产生,说明新西兰白兔自身血清中未含有识别LmCht5-1和OVA的抗体成分(图3-B)。
2.5 飞蝗不同发育日龄表皮中LmCht5-1蛋白表达
提取飞蝗N4D1—N5D1中发育每天的飞蝗表皮蛋白,利用Western blot检测发现,LmCht5-1随着飞蝗日龄增加而表达量逐渐升高,在飞蝗蜕皮当天表达量达到最高。而在飞蝗蜕皮后的N5D1表达量快速降低,恢复到N4D1的起始水平(图4)。
2.6 注射dsLmCht5-1对飞蝗LmCht5-1转录和蛋白水平表达的影响
在飞蝗N4D2注射ds和ds,在N4D5时提取飞蝗总RNA和表皮蛋白。RT-qPCR检测显示的转录本表达降低70%(图5-A),蛋白水平检测发现蛋白表达量减少73.6%,说明ds有效抑制在mRNA和蛋白水平的表达;同时说明OVA-LmCht5-1可特异性地识别飞蝗体内的LmCht5-1(图5-B)。
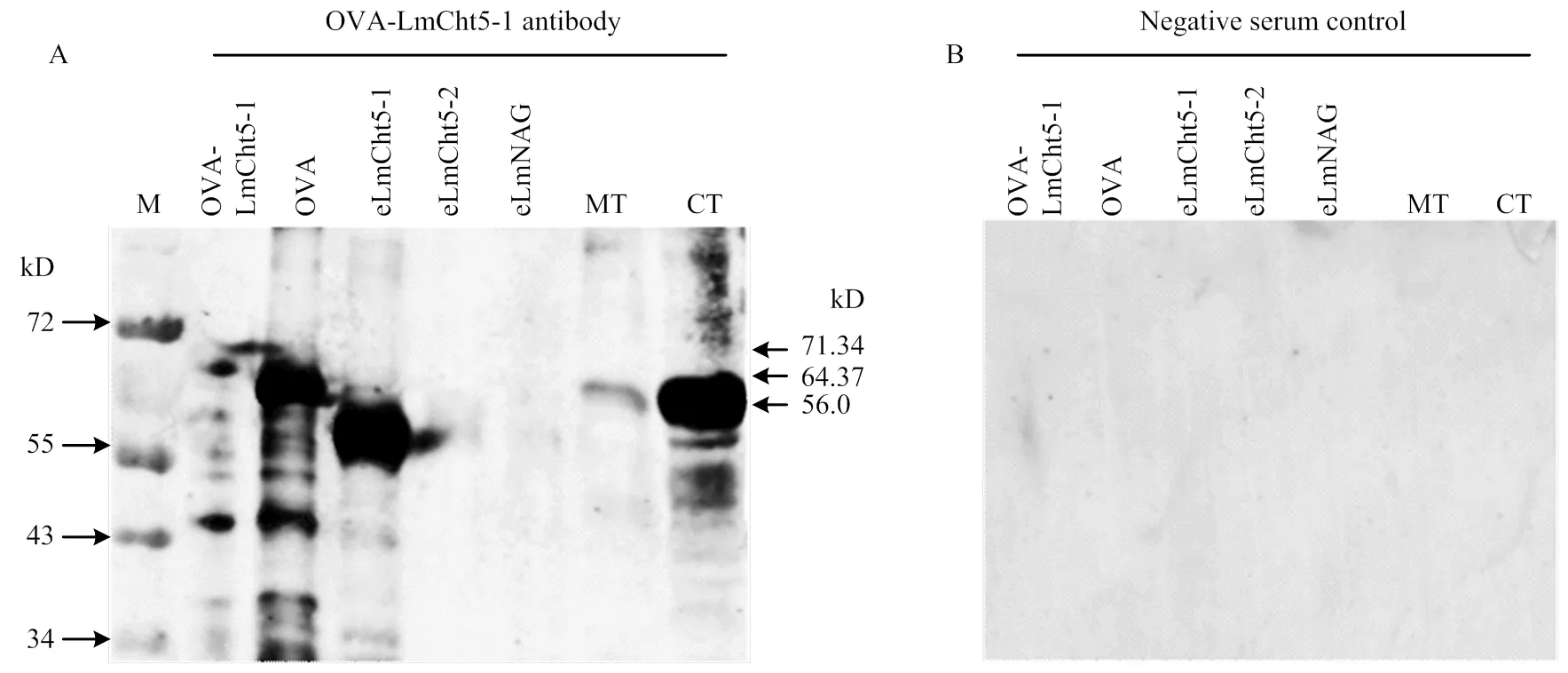
A:OVA-LmCht5-1抗血清与不同蛋白杂交OVA-LmCht5-1 antibody hybridation with different kinds of antigen protein;B:阴性血清与不同蛋白杂交Negative antibody serum hybridation with different kinds of antigen protein。OVA-LmCht5-1:原核蛋白OVA-LmCht5-1 Prokaryotic expression protein OVA-LmCht5-1;OVA:原核蛋白OVA Prokaryotic expression protein OVA;eLmCht5-1:昆虫真核表达系统表达LmCht5-1 Insect eukaryotic expression protein LmCht5-1;eLmCht5-2:昆虫真核表达系统表达LmCht5-2 Insect eukaryotic expression protein LmCht5-2;eLmNAG:昆虫真核表达系统表达LmNAG Insect eukaryotic expression protein LmNAG;MT:飞蝗中肠组织Midgut tissue of L. migratoria;CT:飞蝗表皮组织Cuticle tissue of L. migratoria
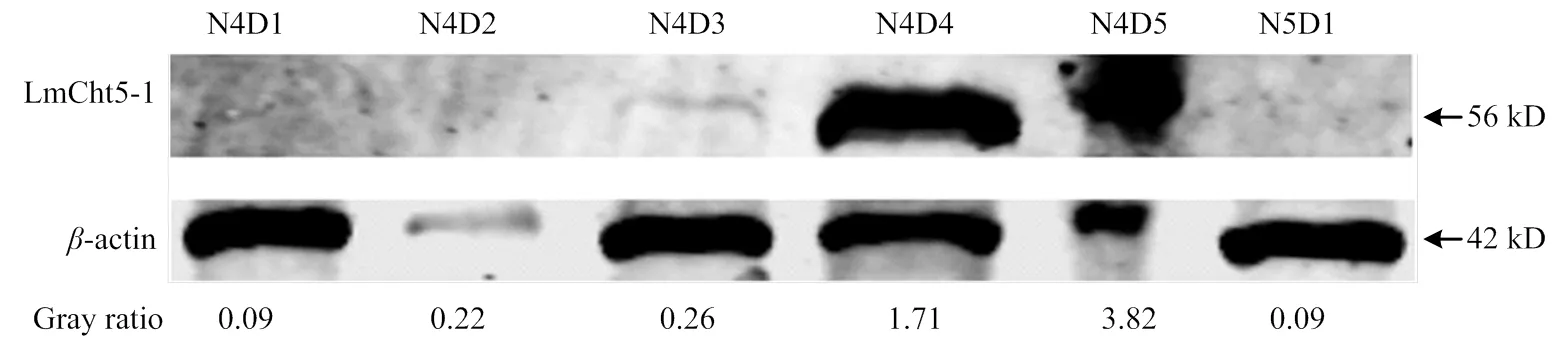
图4 飞蝗不同发育日龄表皮中LmCht5-1蛋白表达
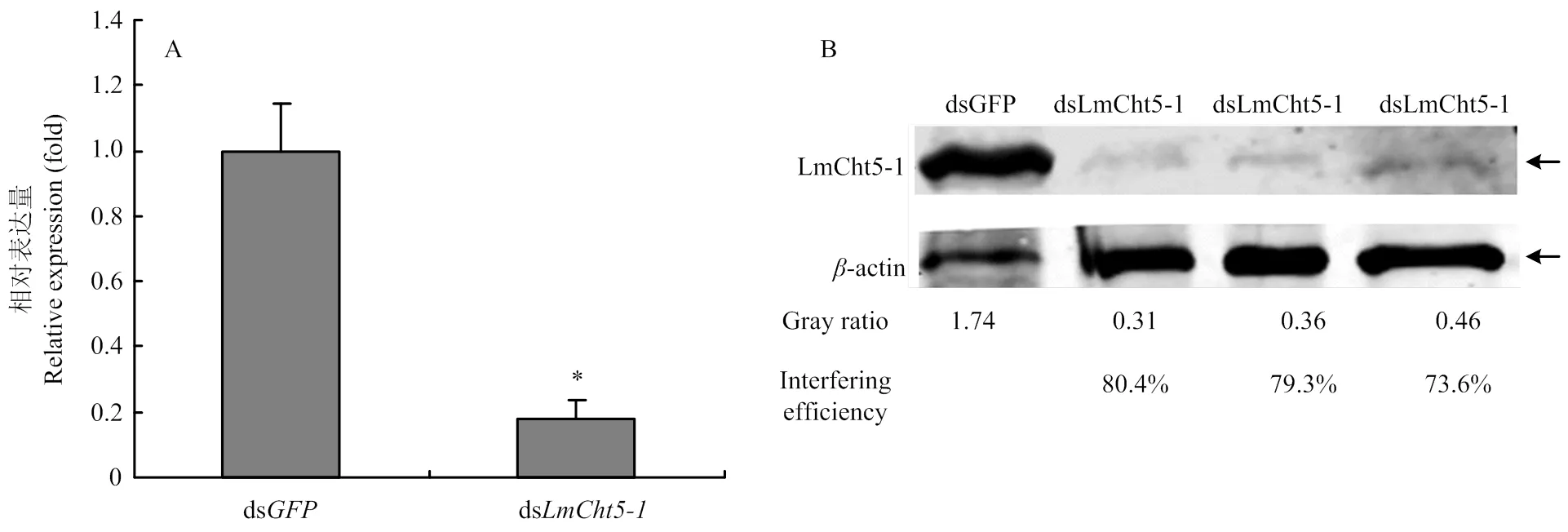
A:RNAi后mRNA水平检测LmCht5-1表达mRNA level detection of LmCht5-1 by RT-qPCR;B:RNAi后蛋白水平检测LmCht5-1表达Protein level detection of LmCht5-1 by Western blot
2.7 OVA-LmCht5-1检测表皮中LmCht5-1定位及功能
取注射后发育至N4D4的飞蝗ds和ds的表皮样品,制备石蜡切片,利用OVA-LmCht5-1抗体对其进行免疫组化检测。OVA-LmCht5-1在注射ds的表皮样本中无可见的信号,但OVA- LmCht5-1在注射ds的飞蝗表皮样本中,可检测到表达的强烈信号(图6)。LmCht5-1蛋白在表皮细胞质和旧表皮中表达。ds组在N4D4时,旧表皮结构破坏,而同时期的ds组中表皮结构完整,表明LmCht5-1蛋白的作用方式为降解表皮中的几丁质。
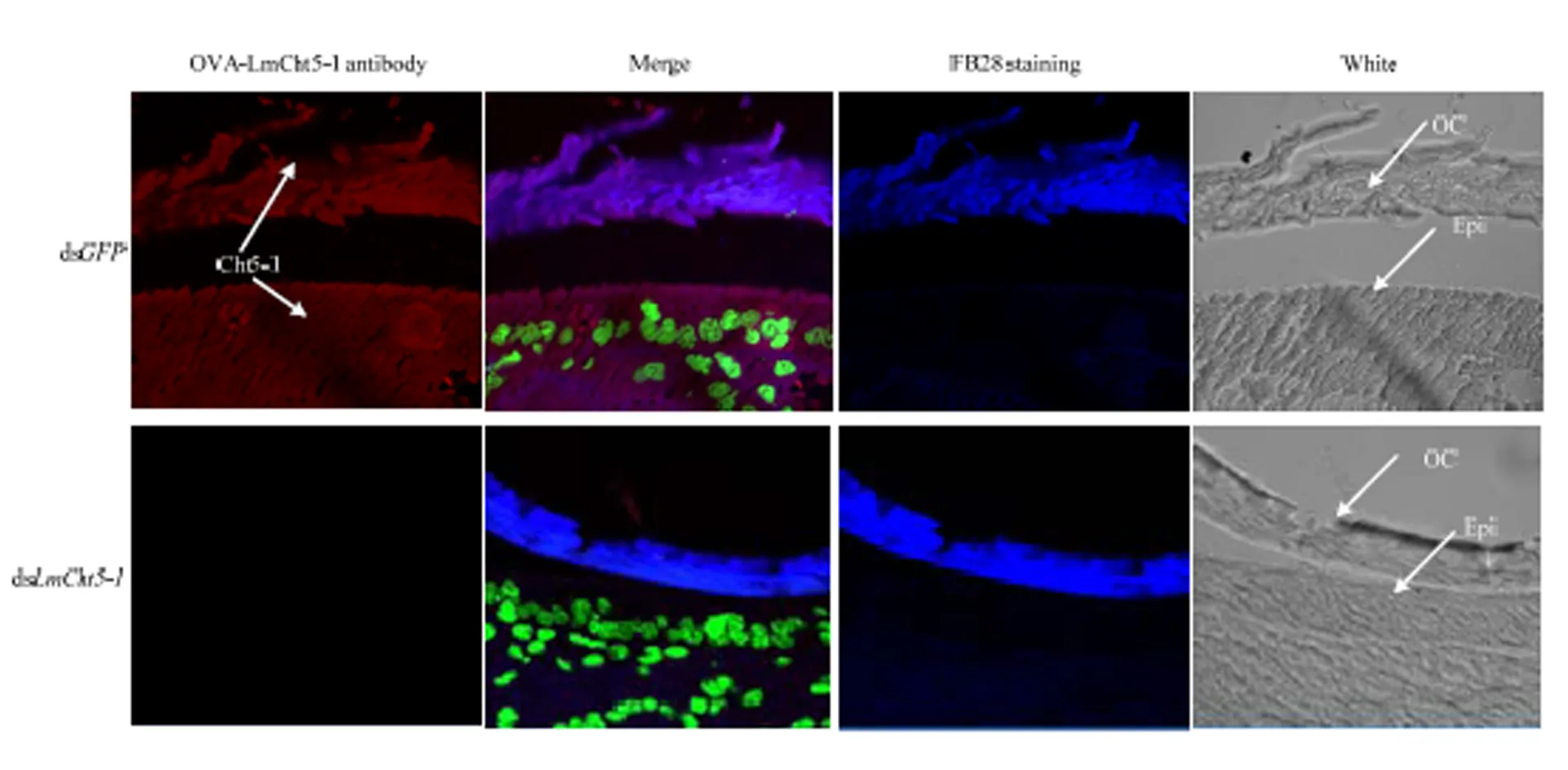
Cht5-1:几丁质酶5-1 Chitinase 5-1;Epi:表皮细胞Epidermis cell;OC:旧表皮Old cuticle
3 讨论
抗体制备是昆虫基因功能研究的重要手段,然因昆虫蛋白序列未知、功能域结构复杂、家族基因数量庞大而造成抗体制备困难[18]。笔者课题组曾通过多肽免疫制备几丁质合成酶和几丁质酶抗体,但均未获得高效价的抗体,分析其原因为几丁质酶蛋白免疫原性差。一般来说,提高抗原的免疫原性,是抗体制备成功的关键。鸡卵清白蛋白OVA由386个氨基酸而组成,常作为蛋白添加剂用于提高生物药或疫苗等的稳定性,同时OVA也可以通过半抗原偶联而作为载体蛋白用于抗体制备[19-20]。在本研究中首先通过序列比对和抗原决定簇分析,获取特异性的抗原序列。将与特异性抗原序列进行偶联,通过原核表达与纯化获得大量的OVA-LmCht5-1抗原蛋白,用于制备多克隆抗体。
本研究中制备的OVA-LmCht5-1多克隆抗体利用ELISA进行效价检测可达到1﹕102 400,足以满足抗体使用需求。在抗体特异性方面,抗体OVA-LmCht5-1能有效识别体外真核表达的eLmCht5-1,识别分子量为57.0 kD的蛋白,而在eLmNAG和eLmCht5-2蛋白泳道中不产生杂交条带,充分说明所制备抗体识别的特异性。此外,抗体OVA-LmCht5-1可以有效识别飞蝗表皮与中肠中的LmCht5-1蛋白。免疫前血清不能与蛋白OVA-LmCht5-1、OVA、NAG、eLmCht5-1、eLmCht5-2、飞蝗表皮和飞蝗中肠蛋白产生可见的杂交条带,进一步表明,兔血清OVA-LmCht5-1是针对LmCht5-1的特异性抗体。OVA-LmCht5-1在ds注射组检测到表达量极低的杂交条带,而在对照组得到表达量较高的杂交条带,不仅说明ds直接影响LmCht5-1在蛋白水平的表达,而且进一步证实抗体OVA-LmCht5-1特异性结合飞蝗表皮LmCht5-1蛋白。
4龄不同日龄的Western blot结果表明,LmCht5-1主要在第4和第5天表达,笔者课题组在mRNA水平研究表达时发现其在蜕皮前一天高表达[2],而蛋白检测则发现在蜕皮当天高表达,推测与mRNA和蛋白在表达上的时间差异有关。在蜕皮当天高表达,与其行使几丁质降解、协助表皮蜕去的生理学功能相符合。进一步采用免疫组化技术鉴定LmCht5-1在飞蝗表皮组织中的表达位置和相对表达量,发现OVA- LmCht5-1抗体可特异性识别组织切片中LmCht5-1,主要在表皮细胞和旧表皮中表达,这与桑卷叶蛾和赤拟谷盗的研究结果一致[9,21]。而利用免疫前阴性血清对上述切片进行染色,未发现任何可见的信号,说明免疫前血清中不含有对表皮组织切片进行非特异结合的成分,进一步鉴定了OVA-LmCht5-1抗体的特异性。
飞蝗的表皮富含几丁质,因此针对几丁质的代谢途径进行调控是防治害虫的重要手段。昆虫表皮发育关键基因功能的解析,有助于寻找新的靶标基因作为害虫防治的靶点。笔者课题组已经利用RNAi技术发现几丁质合成酶[16,22-27]和几丁质酶[8,15,28]的缺失会引起飞蝗表皮形成与降解发生障碍而导致飞蝗死亡。飞蝗几丁质酶5是催化飞蝗表皮降解的关键酶,且存在基因扩增现象,有2个亚型(和)[2],与已报道的昆虫基因直系同源,通过向5龄若虫注射ds发现影响飞蝗5龄若虫到成虫期的蜕皮发育,造成飞蝗蜕皮困难而死亡;而-2是仅在飞蝗中发现的亚型,其若虫期干扰后未发现明显的表型变化。利用昆虫杆状病毒表达LmCht5-1和LmCht5-2进行体外酶活性测定时发现,LmCht5-1主要降解寡聚几丁质,而LmCht5-2主要负责降解多聚几丁质,二者的功能存在分化[29]。在飞蝗的胚胎发育过程中,和具有明显的表达差异[8],推测可能在飞蝗浆膜表皮降解和预若虫表皮降解中发挥不同功能。进一步利用OVA-LmCht5-1抗体对蛋白进行时空表达定位,将有助于解析和在飞蝗胚胎发育及其他发育阶段的功能分化。
4 结论
偶联与抗原序列可获得高免疫原性的原核蛋白OVA-LmCht5-1;通过该抗原所制备的LmCht5-1多克隆抗体可特异性识别飞蝗体内,可用于Western blot和免疫组化检测。蛋白LmCht5-1在飞蝗4龄蜕皮当天表达量最高,定位于表皮细胞和旧表皮中。ds可抑制LmCht5-1蛋白表达,减少表皮细胞和旧表皮中LmCht5-1的表达,阻碍旧表皮中几丁质的降解。
[1] KRAMER K J, CORPUZ L, CHOI H K, MUTHUKRISHNAN S. Sequence of a cDNA and expression of the gene encoding epidermal and gut chitinases of., 1993, 23(6): 691-701.
[2] LI D Q, ZHANG J Q, WANG Y, LIU X J, MA E B, SUN Y, LI S, ZHU K Y, ZHANG J Z. Two chitinase 5 genes from: Molecular characteristics and functional differentiation., 2015, 58: 46-54.
[3] WU Q Y, LIU T, YANG Q. Cloning, expression and biocharacterization ofCht5, the chitinase from the insect., 2013, 20(2): 147-157.
[4] XI Y, PAN P L, YE Y X, YU B, XU H J, ZHANG C X. Chitinase-like gene family in the brown planthopper,., 2015, 24(1): 29-40.
[5] ZHANG X, ZHENG S. 20-hydroxyecdysone enhances the expression of the chitinase 5 via broad-complex zinc-finger 4 during metamorphosis in silkworm,., 2017, 26(2): 243-253.
[6] ZHU K Y, MERZENDORFER H, ZHANG W, ZHANG J Z, MUTHUKRISHNAN S. Biosynthesis, turnover, and functions of chitin in insects., 2016, 61: 177-196.
[7] ZHANG J Z, ZHANG X, ARAKANE Y, MUTHUKRISHNAN S, KRAMER K J, MA E B, ZHU K Y. Identification and characterization of a novel chitinase-like gene cluster () possibly derived from tandem duplications in the African malaria mosquito,., 2011, 41(8): 521-528.
[8] 李大琪. 飞蝗几丁质酶家族基因功能及RNAi介导的害虫防治应用研究[D]. 太原: 山西大学, 2016.
LI D Q. Function ofchitinase family genes and potential application in RNAi-mediated pest control[D]. Taiyuan: Shanxi university, 2016. (in Chinese)
[9] CHAUDHARI S S, MOUSSIAN B, SPECHT C A, ARAKANE Y, KRAMER K J, BEEMAN R W, MUTHUKRISHNAN S. Functional specialization among members of Knickkopf family of proteins in insect cuticle organization., 2014, 10(8): e1004537.
[10] YU R R, LIU W M, LI D Q, ZHAO X M, DING G W, ZHANG M, MA E B, ZHU K Y, LI S, MOUSSIAN B, ZHANG J Z. Helicoidal organization of chitin in the cuticle of the migratory locust requires the function of the chitin deacetylase 2 enzyme (LmCDA2)., 2016, 291(47): 24352-24363.
[11] 丁杨, 姜少杰, 陈贤祯, 陈丽红, 张行, 程浩. 11型HPV E7蛋白的表达及其多克隆抗体的制备. 细胞与分子免疫学杂志, 2014, 30(6): 618-622.
DING Y, JIANG S J, CHEN X Z, CHEN L H, ZHANG X, CHENG H. Expression and polyclonal antibody preparation of HPV-11E7 protein., 2014, 30(6): 618-622. (in Chinese)
[12] KEYHANI J, AHADI M, KEYHANI E, NARAGHI Z, SHAMOHAMMADI S. DNA mobility shift assay as a tool for the detection of anti-dsDNA antibodies in sera from discoid lupus erythematosus patients., 2012, 39(7): 602-607.
[13] LIU J, ZHU R, YE X, YANG L, WANG Y, HUANG Y, WU J, WANG W, YE J, LI Y, ZHAO Q, ZHU H, CHENG T, XIA N. A monoclonal antibody-based VZV glycoprotein E quantitative assay and its application on antigen quantitation in VZV vaccine., 2015, 99(11): 4845-4853.
[14] LI Y L, SONG H F, ZHANG X Y, LI D Q, ZHANG T T, MA E B, ZHANG J Z. Heterologous expression and characterization of two chitinase 5 enzymes from the migratory locust., 2016, 23(3): 406-416.
[15] 李大琪, 杜建中, 张建琴, 郝耀山, 刘晓健, 王亦学, 马恩波, 张建珍, 孙毅. 东亚飞蝗几丁质酶家族基因的表达特性与功能研究.中国农业科学, 2011, 44(3): 485-492.
LI D Q, DU J Z, ZHANG J Q, HAO Y S, LIU X J, WANG Y X, MA E B, ZHANG J Z, SUN Y. Study on expression characteristics and functions of chitinase family genes from(Meyen)., 2011, 44(3): 485-492. (in Chinese)
[16] 刘晓健, 崔淼, 李大琪, 张欢欢, 杨美玲, 张建珍. 飞蝗几丁质合成酶2基因的表达特性、功能及调控.中国农业科学, 2014, 47(7): 1330-1340.
LIU X J, CUI M, LI D Q, ZHANG H H, YANG M L, ZHANG J Z. Expression, function and regulation of chitin synthase 2 gene in., 2014, 47(7): 1330-1340. (in Chinese)
[17] 浦涛, 王李阳, 高迎凤, 薛雅卓, 徐学红. 果蝇胚胎石蜡切片制作方法的改良.生物学通报, 2015, 50(9): 47-50, 63.
PU T, WANG L Y, GAO Y F, XUE Y Z, XU X H. Modification of paraffin section method forembryo., 2015, 50(9): 47-50, 63. (in Chinese)
[18] 游娟, 黄建林, 曹莉, 韩日畴. 昆虫病原细菌Cip蛋白多克隆抗体的制备.河南农业科学, 2013, 42(8): 62-66.
YOU J, HUANG J L, CAO L, HAN R C. Preparation of polyclonal antibody against crystalline inclusion protein of entomopathogenic bacterium., 2013, 42(8): 62-66. (in Chinese)
[19] Taneichi M,Tanaka Y,Kasai M,Mori M,Nishida M,Yamamura H,Mizuguchi J,Uchida T. Induction of differential T-cell epitope by plain- and liposome-coupled antigen., 2006, 17(4): 899-904.
[20] 王丹阳, 杨雨, 杨秀梅, 张富春, 张爱莲.和6及其蛋白滴鼻免疫增强小鼠抗体水平.生物技术, 2015, 25(6): 586-590, 612.
WANG D Y, YANG Y, YANG X M, ZHANG F C, ZHANG A L.,6and its protein can enhance antibody levels by intranasal co-immunization in mice., 2015, 25(6): 586-590, 612. (in Chinese)
[21] ZHENG Y P, RETNAKARAN A, KRELL P J, ARIF B M, PRIMAVERA M, FENG Q L. Temporal, spatial and induced expression of chitinase in the spruce budworm,., 2003, 49(3): 241-247.
[22] LIU X J, SUN Y W, LI D Q, LI S, MA E B, ZHANG J Z. Identification ofas a 20-hydroxyecdysone response gene in the chitin biosynthesis pathway from the migratory locust,., 2018, 25(2): 211-221.
[23] LIU X J, ZHANG H H, LI S, ZHU K Y, MA E B, ZHANG J Z. Characterization of a midgut-specific chitin synthase gene () responsible for biosynthesis of chitin of peritrophic matrix in., 2012, 42(12): 902-910.
[24] ZHANG J Z, LIU X J, ZHANG J Q, LI D Q, SUN Y, GUO Y P, MA E B, ZHU K Y. Silencing of two alternative splicing-derived mRNA variants of chitin synthase 1 gene by RNAi is lethal to the oriental migratory locust,(Meyen)., 2010, 40(11): 824-833.
[25] 刘晓健, 孙亚文, 崔淼, 马恩波, 张建珍. 飞蝗海藻糖酶基因的分子特性及功能.中国农业科学, 2016, 49(22): 4375-4386.
LIU X J, SUN Y W, CUI M, MA E B, ZHANG J Z. Molecular characteristics and functional analysis of trehalase genes in., 2016, 49(22): 4375-4386. (in Chinese)
[26] 刘晓健, 杨美玲, 张建琴, 马恩波, 张建珍. 氟虫脲对东亚飞蝗和中华稻蝗几丁质合成酶基因表达的影响.昆虫学报, 2010, 53(9): 1039-1044.
LIU X J, YANG M L, ZHANG J Q, MA E B, ZHANG J Z. Effects of flufenoxuron on the expression of chitin synthase gene in(Meyen) (Orthoptera: Acrididae) and(Thunberg) (Orthoptera: Oedipodidae)., 2010, 53(9): 1039-1044. (in Chinese)
[27] 刘晓健, 张欢欢, 李大琪, 崔淼, 马恩波, 张建珍. 飞蝗可溶型海藻糖酶基因的序列分析及mRNA表达特性.昆虫学报, 2012, 55(11): 1264-1271.
LIU X J, ZHANG H H, LI D Q, CUI M, MA E B, ZHANG J Z. Sequence characterization and mRNA expression profiling of a soluble trehalase gene in(Orthoptera: Acrididae)., 2012, 55(11): 1264-1271. (in Chinese)
[28] 李大琪, 王燕, 张建琴, 李涛, 孙毅, 张建珍. 中华稻蝗几丁质酶基因10 ()的分子特性及功能.中国农业科学, 2014, 47(7): 1313-1320.
LI D Q, WANG Y, ZHANG J Q, LI T, SUN Y, ZHANG J Z. Molecular characterization and function of chitinase 10 gene () from, 2014, 47(7): 1313-1320. (in Chinese)
[29] 李应龙. 飞蝗几丁质降解酶基因的异质性表达及酶学特性分析[D]. 太原: 山西大学, 2016.
LI Y L. Heterologous expression and characterization of the chitin degradation enzymes from[D]. Taiyuan: Shanxi university, 2016. (in Chinese)
(责任编辑 岳梅)
The antibody preparation and expression analysis of Chitinase 5-1 in
ZHANG TingTing1, LIU WeiWei1,2, GAO Lu1,2, LI RenJian1,2, FU SuiYe1,2, LIU XiaoJian1, LI DaQi1,3, LIU WeiMin1, DONG Qing1,2, ZHANG JianZhen1
(1Institute of applied biology, Shanxi University, Taiyuan 030006;2College of life science, Shanxi University, Taiyuan 030006;3Institute of plant protection, Shanxi academy of agricultural sciences, Taiyuan 030031)
【Objective】The objective to this study is to prepare polyclonal antibody ofchitinase5-1 (LmCht5-1), establish method for detection ofprotein, understand the expression pattern of LmCht5-1 protein in the 4thinstar nymph and finally confirm its location and function.【Method】LmCht5-1 antigen structure area, which was selected by sequence alignment betweenandwith MEGA software and antigen epitope prediction analysis with the website of Expression, was amplified using cDNA ofas the template. The LmCht5-1 antigen sequence was cloned into expression vector pET32a-OVA, which contains ovalbumin to improve immunogenicity, to generate the antigen expression recombinant plasmid pET32a-OVA-LmCht5-1. pET32a-OVA-LmCht5-1 was then transformed intostrain BL21 (DE3). The IPTG induced OVA-LmCht5-1 was purified through Ni-NTA system and used as the antigen to generate polyclone antibody by rabbit immunization. The titer and specificity of OVA-LmCht5-1 were detected by ELISA and Western blot analysis, respectively. Then the expression pattern of LmCht5-1 in cuticle of the 4th instar nymph was analyzed in parallel by Western blot. Finally, the intracellular localization and function of LmCht5-1 in the 4thinstar nymph cuticle were detected by immunohistochemical analysis after the dsinjection. 【Result】The 5′ fragment (471-533AA) of LmCht5-1, which was selected as the antigen area with the sequence alignment between LmCht5-1 and LmCht5-2 and the epitope prediction analysis, was inserted into pET32a-OVA to obtain recombinant plasmid pET32a-OVA-LmCht5-1. The 71.34 kD recombinant protein OVA-LmCht5-1 was expressed, purified and immunized with rabbit to generate polyclone antibody. The titer of anti-serum of OVA-LmCht5-1 was 1﹕102 400 by ELISA detection. Antibody OVA-LmCht5-1 could accurately distinguish the LmCht5-1 but not LmCht5-2 in Western blot analysis. Further, it was found that the protein expression level of LmCht5-1 increasedgradually with the age in the 4th instar nymph ofand reached to the highest at the same day of molting, while it declined to the lowest after molting.Injection dsinto the 4th instar nymph led to the expression of LmCht5-1 significantly declined to 70.0% in mRNA level and 73.6% in protein level. The immunohistochemical analysis with the epidermis ofafter dsinjection, showed that LmCht5-1 was located in old cuticle and epidermis cell. Finally, it was found that the inhibition of protein expression of LmCht5-1 led to the chitin degradation blocking in old cuticle. 【Conclusion】High titer and specificity ofantibodies, which could be used for Western blot and immunohistochemistry analysis were obtained. The protein expression of LmCht5-1 reached to the highest level at the day of molting in 4th instar nymph. LmCht5-1 was located in the epidermis cell and old cuticle in the 4th instar nymph. Moreover, the injection of dstocould inhibit the protein expression of LmCht5-1 in epidermis cells and old cuticle, and finally caused the chitin degradation deficiency in old cuticle.
; LmCht5-1; polyclonal antibody preparation; expression pattern analysis; Western blot
2018-01-15;
2018-02-26
国家自然科学基金青年基金(31501905)、中国博士后科学基金(2016M591722)、山西省科技厅青年基金(201601D021120)
张婷婷,E-mail:zhangyanqiu3520@sxu.edu.cn。
张婷婷。通信作者张建珍,E-mail:zjz@sxu.edu.cn
10.3864/j.issn.0578-1752.2018.12.018
