心脏脂肪与心律失常:心脏CT的研究价值
于怡驰 李毅刚
心脏CT影像技术飞速发展使我们能以更快捷、低廉和低辐射剂量的方式研究人类各种心脏疾病,甚至是心律失常[1]。目前认为折返活动、自律异常与触发活动是引起心律失常的三大机制,但是心房颤动(简称房颤)以及某些心肌病等发生心律失常的具体机制目前尚无确切定论。近来CT影像技术逐渐用于心肌脂肪在心律失常中的研究,特别是病理状态下的心肌内脂肪浸润与室性心律失常关系密切[2]。
笔者综述CT影像技术在研究心脏脂肪与心律失常关联的最新进展。
1 心脏的脂肪组织及功能
中国城市中20岁以上成年人代谢综合征的患病率已达14%~16%[3]。内脏脂肪目前被认为是代谢综合征发病的最主要的病理生理学基础,相较于体质指数(body mass index, BMI),内脏脂肪对预测心血管风险的发生更具有价值[4-5]。目前认为与心脏病理生理直接相关的脂肪包括心肌内脂肪组织(myocardial adipose tissue)和心外膜脂肪组织(epicardial adipose tissue,EAT)。健康人群中心肌内脂肪组织约占心脏总质量的1%,以脂滴的形式分布在心肌细胞间[2];而EAT位于心肌外脏层心包内,约占心脏总质量的20%,直接与心肌接触,其内有冠状动脉穿行和心脏神经丛(ganglionated plexi, GPs)分布,可通过内分泌及旁分泌的方式释放多种炎症因子(如白介素-6、肿瘤坏死因子α等),或经由自主神经介导等多种机制对心肌产生影响[6]。组织学上,性质与外周脂肪亦有不同,具有棕色脂肪组织性质,解耦联蛋白-1(UCP-1)有较高的表达[7]。
2 CT影像研究心脏脂肪的特点
CT、心脏超声以及心脏磁共振(cardiac magnetic resonance, CMR)是心脏科临床常用的三种影像技术。例如在心外膜脂肪的研究中,心脏超声仅能获取局部脂肪厚度且重复性差,CMR虽为金标准但耗时长且成本昂贵,而心脏CT以其操作时间短、低成本、高空间分辨率、可重复性强、信息量大等优势,故心脏CT成了研究心脏脂肪主要采用的工具[1,5,8]。且双源CT(dual-source CT)和多排螺旋CT(multi-detector helical CT, MDCT)的出现进一步减少了辐射量。
CT对心肌内脂肪的检出具有较高的灵敏度。正常人群中右室心肌内脂肪的CT检出率也可达16%~43%(解剖证实为85%);既往心肌梗死的患者,左室局部病灶心肌内脂肪CT检出率可达22%~62%[9]。而对于心脏外的脂肪,现有CT可明确将心包脂肪组织(pericardial adipose tissue, PAT)分为两个部分:即脏层心包以内的EAT以及壁层心包以外的心周脂肪组织(paracardial adipose tissue)(如图1示)。EAT直接接触心脏产生影响,故多数研究主要针对EAT,部分研究受制于CT影像质量转而分析PAT,虽定量研究的结果亦可反映EAT的影响,但可增加II类错误的风险[8]。
根据Framingham研究对3 000余例样本的分析,男性总EAT体积中位数为117.5 cm3,女性为93.9 cm3[4]。EAT的CT衰减值推荐范围下限为-250~-190 HU,上限为-50~-30 HU。解剖边界的上界为肺动脉分叉或右肺动脉水平,下界为膈肌或左室心尖部水平。CT平扫和增强的影像均可用于分析脂肪,两者在计算总EAT体积时无显著性差异[5]。另外,经过特殊方式,CT影像支持与现今主流的CARTO及NavX三维电生理标测系统融合,同时也支持将EAT的分布情况传至标测系统。
3 CT影像下心脏脂肪与房颤关系的研究
心脏脂肪与房颤发病之间的关系最近为多项研究所证实。2010年著名的Framingham研究通过心脏CT对3 217名患者进行分析,发现EAT体积与房颤患病相关,经BMI等多因素进行校正后仍存在显著相关性[10]。

1例64岁男性患者,入院诊断为持续性房颤。冠状动脉CT增强所示心脏脂肪。A:右下肺静脉水平,B:左室水平。两图中所示蓝色部分为心外膜脂肪,红色部分为心周脂肪。图中脂肪的CT值为-190~-30HU。LA=左房,RA=右房,LV=左室,RV=右室
2014年的Heinz Nixdorf Recall研究[11]纳入了3 467名对象,发现EAT体积可用于预测房颤发病,尽管其预测价值不及左房内径。
EAT引起房颤的触发和维持机制目前尚未完全阐释。已有研究证实,房颤患者在发病前其EAT厚度与心房总传导时间[12]和P波时长的离散度[13]间存在正相关,支持了EAT对心房肌基质的影响。在机制上,组织学证据发现脂肪可直接浸润心房心内膜下,并在免疫介导下形成纤维化,造成心内膜与心外膜传导系之间的电分离;另一方面EAT可通过多种炎症因子或氧化应激作用于心房肌导致基质改变;此外迷走神经过度兴奋也被认为与房颤的发生和维持机制密切相关,而支配心房的GPs就主要分布于心房外脂肪垫中[5, 8, 13-16]。
基于EAT与房颤的关联,将CT重建EAT的影像引入房颤射频消融成为了一种新的治疗尝试。有团队将EAT与当前热点的转子学说和碎裂电位为基础的房颤个性化消融治疗相结合[17]:心房的复杂碎裂电位(complex fractionated atrial electrograms, CFAEs)被认为与房颤基质相关,而时域信号经傅里叶变换转为频谱分析得到的主导频峰(dominant frequencies, DFs)则被认为与房颤的维持有关。Nakatani等[15]的研究发现接受房颤射频消融的患者中,CT下左房EAT分布与频谱分析得到的主导频峰(dominant frequencies, DFs)的分布重叠率较高;Nakahara等[18]对60名持续性房颤的患者行环肺静脉隔离联合左房EAT分布区消融,相较于传统环肺静脉隔离联合线性消融或CFAEs消融患者,术后房颤复发显著减少。
4 CT影像下心脏脂肪与心肌病关系的研究
心肌内脂肪除了可分布健康成人的心脏内,还可分布在缺血性心肌病(ischemic cardiomyopathy, ICM)、致心律失常性右室心肌病(arrhythmogenic right ventricular cardiomyopathy , ARVC)、扩张型心肌病(dilated cardiomyopathy, DCM)、Duchenne型肌营养不良等患者的心肌内[9]。病理状态下心肌内脂肪可改变心肌基质,可引发各类心律失常,甚至是恶性室性心律失常导致猝死,尤其是ARVC和ICM的患者。CT作为一种常用的心脏影像学手段在诊断和治疗方面具有重要的意义。
4.1ARVC ARVC是一种常染色体显性遗传的心肌疾病,表现为右室逐渐扩大,室壁变薄,心肌组织逐步被脂肪组织或纤维脂肪组织所代替和填充(随疾病进展可累及左室壁),直至心室颤动等恶心律失常[2, 9, 19-22]。
1989年Wolf等[23]最先通过磁共振证实了ARVC患者心肌内脂肪的存在。CMR在诊断和评估ARVC方面具有优势,因其可准确区分正常心肌组织与纤维脂肪组织,并精确测定右室结构与功能。根据2010年修订后的美国官方技术标准,将心脏超声、右室造影或CMR下发现右室活动异常列入诊断ARVC的主要标准之一,心肌脂肪浸润虽为影像学表现之一但未被列入标准。尽管Nakajima等[24]利用心电图门控选取收缩末期与舒张中期的心脏CT影像综合评价右室结构与功能,指出CT对 ARVC的诊断有较高的灵敏度和特异度,但CT较CMR时间分辨率低。随着辐射量较小的MDCT逐渐被广泛采用,美国2010年的专家共识已推荐其用于对ARVC的评估[22],尤其适用于有CMR禁忌证的患者(如ICD植入术后)。
早期研究通过心室造影发现,ARVC患者中右室基底部、右室流出道及右室心尖部所围成的区域常为脂肪浸润,近50%的患者出现此区域心肌变薄甚至室壁瘤,故该区域被称为“发育不良三角”(triangle of dysplasia)。病理解剖及影像学均证实纤维脂肪组织一般由心外膜向心内膜进展,因此电生理检查发现ARVC的室性心动过速基质多位于心外膜[9, 21-22]。但EAT直接与心肌相接触,现阶段仅凭影像学手段较难区分EAT与脂肪浸润。
Cochet等[19]对比了36名ARVC患者与36名年龄与性别匹配的非ARVC患者的MDCT影像,以右室游离壁脂肪体积和右室游离壁体积的比值代表脂肪浸润情况,发现其诊断价值较右室容积大,且与右室容积、ε波出现、V1~V3导联T波倒置以及PKP2基因变异正相关。Komatsu等[21]在ARVC患者中比对MDCT下的心外膜脂肪分布与三维标测电解剖图的心室局部异常电活动分布存在较好的关联性,有指导消融靶点的潜在意义。
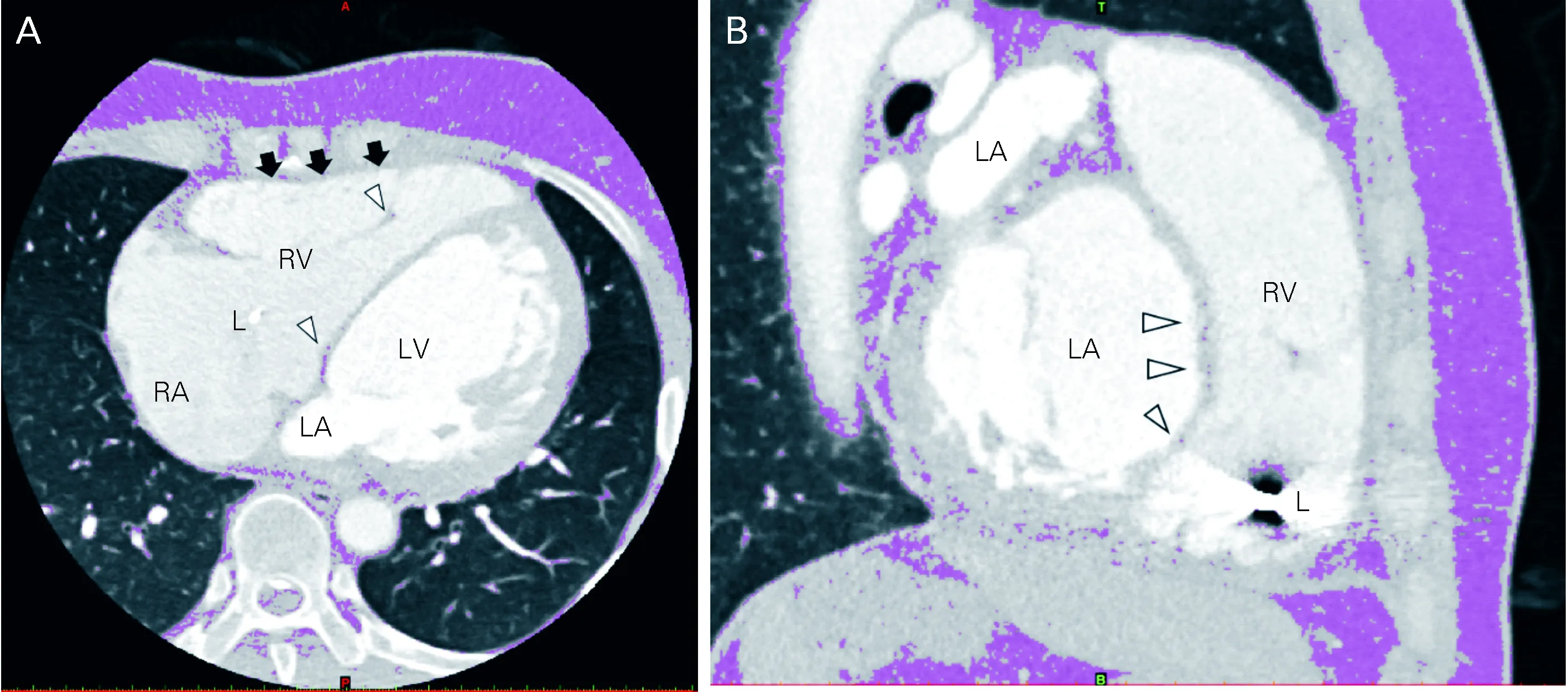
1例59岁女性患者,5年前入院心脏超声示左室扩大,右室壁节段活动异常,根据2010年美国官方技术标准诊断为ARVC并植入ICD。冠状动脉CT增强横断位(A)与矢状位(B)见左心室及右室明显扩大,右室呈扇贝形,右室壁心肌变薄(A图黑色箭头所示),室间隔内和右室肌小梁可见脂肪浸润(A图和B图白色箭头所示)。图中脂肪组织由紫色标注,设置CT衰减值为-190至-30HU。LA=左房,RA=右房,LV=左室,RV=右室,L处所示为ICD电极
4.2缺血性心肌病 与ARVC相似,脂肪组织与ICM之间的关联也逐渐被认识。Baroldi等[25]通过解剖证实,心肌细胞缺血5~6 h后即可见细胞内脂滴形成,随时间进展心肌瘢痕内正常心肌细胞逐渐减少,并被纤维与脂肪组织所替代。心肌的急性及慢性缺血均可导致室性心动过速等严重心律失常:急性期室性心动过速的机制主要是坏死心肌自律性异常;而慢性期或愈合期的室性心动过速则主要与瘢痕区折返有关,有研究发现折返周长与心肌脂肪而非瘢痕纤维组织相关[2]。
影像学检查中,心肌钆延迟磁共振显像(late gadolinium-enhanced magnetic resonance imaging, LGE-MRI)能较为清晰地描绘急性期及慢性期瘢痕区,但是空间分辨率低及ICD兼容性问题等限制其在射频消融的应用。心脏CT增强的影像质量与病灶时间相关,即急性期优于慢性期。Habis等[26]在急性心肌梗死的患者中于冠状动脉造影注射碘造影剂后平均约22 min时,行心脏CT可描绘与LGE-MRI大小一致的梗死区;而慢性期的纤维瘢痕细胞外间隙较小,使得碘造影剂难以进入,瘢痕组织难以被充分强化。Crean等[27]使用了冠状动脉直接注入造影剂的方式,即对一名长期ICM伴单形室性心动过速的患者于冠状动脉造影15 min后立即行心脏MDCT,准确地描绘出了心内膜下瘢痕的区域,并成功指导了室性心动过速的消融。
5 未来展望与小结
随着目前影像软硬件的不断发展,CT下研究心脏脂肪将更精确、快捷且深入。目前关于EAT与房颤的大型研究仍有限且混杂因素较多。EAT能指导房颤消融,从动物实验[28-29]至临床中[14]均有所实践,其机制目前被认为与EAT内的GPs分布有关,但目前影像学无法直接观察GPs的分布。另外,目前已有团队尝试通过EAT为靶点进行房颤药物干预的研究。Soucek等[30]对38名已行环肺静脉隔离的房颤患者予以3个月内的大剂量阿托伐他汀(80 mg/d)治疗后发现心脏表面脂肪体积显著减少。Pokushalov等[31]选取了30名既往有阵发性房颤病史并拟接受冠状动脉搭桥术的患者,于术中对心脏表面脂肪垫注射肉毒毒素后,随访1年后发现治疗组术后房颤发生少于空白对照组。但由于EAT与房颤之间的作用机制仍未完全阐述,更多有关干预方式的研究仍有待进行。而ARVC与ICM中,脂肪指导室性心律失常消融治疗尚处于起步阶段。
心脏CT是研究心脏脂肪与心律失常疾病之间关系的重要影像学手段,未来对于消融和其他临床干预也具有潜在指导意义。
1 Machida H, Tanaka I, Fukui R, et al. Current and novel imaging techniques in coronary CT[J]. Radiographics, 2015,35(4):991
2 Samanta R, Pouliopoulos J, Thiagalingam A, et al. Role of adipose tissue in the pathogenesis of cardiac arrhythmias[J]. Heart Rhythm, 2016,13(1):311
3 贾伟平. 中国人代谢综合征的现状及临床特征[J]. 中华内分泌代谢杂志, 2006,22(3):增录3S
4 Thanassoulis G, Massaro JM, Hoffmann U, et al. Prevalence, distribution, and risk factor correlates of high pericardial and intrathoracic fat depots in the Framingham heart study[J]. Circ Cardiovasc Imaging, 2010,3(5):559
5 Marwan M, Achenbach S. Quantification of epicardial fat by computed tomography: why, when and how[J]? J Cardiovasc Comput Tomogr, 2013,7(1):3
6 Fang M, Chen Y, Wang J. Epicardial adipose tissue: the accomplice implicated in the genesis and maintenance of atrial fibrillation[J]. Chin Med J (Engl), 2014,127(14):2 700
7 He Y, Ma N, Tang M, et al. The differentiation of beige adipocyte in pericardial and epicardial adipose tissues induces atrial fibrillation development[J]. European Review for Medical and Pharmacological Sciences, 2017,21(19):4 398
8 Wong CX, Ganesan AN, Selvanayagam JB. Epicardial fat and atrial fibrillation: current evidence, potential mechanisms, clinical implications, and future directions[J]. Eur Heart J, 2016
9 Kimura F, Matsuo Y, Nakajima T, et al. Myocardial fat at cardiac imaging: how can we differentiate pathologic from physiologic fatty infiltration[J]? Radiographics, 2010,30(6):1 587
10 Thanassoulis G, Massaro JM, O'Donnell CJ, et al. Pericardial fat is associated with prevalent atrial fibrillation: the Framingham Heart Study[J]. Circ Arrhythm Electrophysiol, 2010,3(4):345
11 Mahabadi AA, Lehmann N, Kalsch H, et al. Association of epicardial adipose tissue and left atrial size on non-contrast CT with atrial fibrillation: the Heinz Nixdorf Recall Study[J]. Eur Heart J Cardiovasc Imaging, 2014,15(8):863
12 Canpolat U, Aytemir K, Ozer N, et al. Relationship between the epicardial fat thickness and total atrial conduction time in patients with lone paroxysmal atrial fibrillation[J]. Int J Cardiol, 2015,185:106
13 Cicek Y, Dogan S, Durakoglugil ME, et al. The relationship between epicardial adipose tissue and P wave and QT dispersions[J]. Turk Kardiyoloji Dernegi arsivi : Turk Kardiyoloji Derneginin Yayin Organidir, 2015,43(7):621
14 闫倩, 刘兴鹏. 消融心房脂肪垫治疗心房颤动的研究现状[J]. 心血管病学进展, 2009,30(3):352
15 Nakatani Y, Kumagai K, Minami K, et al. Location of epicardial adipose tissue affects the efficacy of a combined dominant frequency and complex fractionated atrial electrogram ablation of atrial fibrillation[J]. Heart Rhythm, 2015,12(2):257
16 Hatem SN, Redheuil A, Gandjbakhch E. Cardiac adipose tissue and atrial fibrillation: the perils of adiposity[J]. Cardiovasc Res, 2016,109(4):502
17 Guillem MS, Climent AM, Rodrigo M, et al. Presence and stability of rotors in atrial fibrillation: evidence and therapeutic implications[J]. Cardiovascular Research, 2016,109(4):480
18 Nakahara S, Hori Y, Kobayashi S, et al. Epicardial adipose tissue-based defragmentation approach to persistent atrial fibrillation: its impact on complex fractionated electrograms and ablation outcome[J]. Heart Rhythm, 2014,11(8):1 343
19 Cochet H, Denis A, Komatsu Y, et al. Automated quantification of right ventricular fat at contrast-enhanced cardiac multidetector CT in arrhythmogenic right ventricular cardiomyopathy[J]. Radiology, 2015,275(3):683
20 Indik JH, Dallas WJ, Gear K, et al. Right ventricular volume analysis by angiography in right ventricular cardiomyopathy[J]. Int J Cardiovasc Imaging, 2012,28(5):995
21 Komatsu Y, Jadidi A, Sacher F, et al. Relationship between MDCT-imaged myocardial fat and ventricular tachycardia substrate in arrhythmogenic right ventricular cardiomyopathy[J]. J Am Heart Assoc, 2014,3(4):e000935
22 Te Riele AS, Tandri H, Sanborn DM, et al. Noninvasive multimodality imaging in ARVD/C[J]. JACC Cardiovasc Imaging, 2015,8(5):597
23 Wolf JE, Rose-Pittet L, Page E, et al. Detection of parietal lesions using magnetic resonance imaging in arrhythmogenic dysplasia of the right ventricle[J]. Arch Mal Coeur Vaiss, 1989,82(10):1 711
24 Nakajima T, Kimura F, Kajimoto K, et al. Utility of ECG-gated MDCT to differentiate patients with ARVC/D from patients with ventricular tachyarrhythmias[J]. J Cardiovasc Comput Tomogr, 2013,7(4):223
25 Baroldi G, Silver MD, De Maria R, et al. Lipomatous metaplasia in left ventricular scar[J]. Can J Cardiol, 1997,13(1):65
26 Habis M, Capderou A, Sigal-Cinqualbre A, et al. Comparison of delayed enhancement patterns on multislice computed tomography immediately after coronary angiography and cardiac magnetic resonance imaging in acute myocardial infarction[J]. Heart, 2009,95(8):624
27 Crean AM, Spears DA, Suszko AM, et al. High-resolution 3D scar imaging using a novel late iodine enhancement multidetector CT protocol to guide ventricular tachycardia catheter ablation[J]. J Cardiovasc Electrophysiol, 2013,24(6):708
28 熊焰, 杨缙, 张波,等. 射频消融心外膜脂肪垫治疗犬肺静脉左房交界处起源的心房颤动[J]. 中国心脏起搏与心电生理杂志, 2008,22(6):543
29 张小琴, 侯月梅, 娜几娜,等. 窦房结脂肪垫对犬右上肺静脉电生理特性影响的研究[J]. 中国心脏起搏与心电生理杂志, 2008,22(2):153
30 Soucek F, Covassin N, Singh P, et al. Effects of atorvastatin (80 mg) therapy on quantity of epicardial adipose tissue in patients undergoing pulmonary vein isolation for atrial fibrillation[J]. Am J Cardiol, 2015,116(9):1 443
31 Pokushalov E, Kozlov B, Romanov A, et al. Long-term suppression of atrial fibrillation by botulinum toxin injection into epicardial fat pads in patients undergoing cardiac surgery: one-year follow-up of a randomized pilot study[J]. Circ Arrhythm Electrophysiol, 2015,8(6):1 334

