感染鸭源小鹅瘟病毒QH-L01株樱桃谷雏鸭病理学研究
陈 兵,徐 婧,,罗启慧,,黄 超,刘文涛,,吴 洪,陈镜妃,陈 苹,高 琪,马文静,陈正礼,,*
(1.四川农业大学 动物医学院,实验动物疾病模型实验室,四川 成都 611130;2.四川农业大学 动物疫病与人类健康四川省重点实验室,四川 成都 611130)
感染鸭源小鹅瘟病毒QH-L01株樱桃谷雏鸭病理学研究
陈 兵1,徐 婧1,2,罗启慧1,2,黄 超1,刘文涛1,2,吴 洪2,陈镜妃1,陈 苹1,高 琪1,马文静1,陈正礼1,2,*
(1.四川农业大学 动物医学院,实验动物疾病模型实验室,四川 成都 611130;2.四川农业大学 动物疫病与人类健康四川省重点实验室,四川 成都 611130)
摘 要:探究人工感染条件下,鸭源小鹅瘟病毒QH-L01株对樱桃谷雏鸭各器官组织病理学变化的影响,以期阐明QH-L01的病理发生规律及特征。实验组以每只0.2mL(106.54ELD50)的剂量肌肉接种30只2日龄樱桃谷肉鸭鸭源小鹅瘟病毒,对照组的鸭接种等量的灭菌生理盐水,分别在1、3、6、9d观察各组织器官的病理变化。感染后1d,先出现肺点状出血,部分肺小叶扩张,十二指肠、回肠和盲肠等肠道组织绒毛上皮细胞坏死脱落。感染后3d,脑、肾、胸腺、法氏囊出现病理变化,十二指肠、回肠和盲肠等肠道组织绒毛和黏膜层轻度坏死、脱落。感染后6d,脾脏淋巴细胞增多,十二指肠、回肠和盲肠等肠道组织绒毛和黏膜层中度坏死、脱落。感染后9d,各组织病变减轻或者恢复正常。整个感染期死亡率为20%。
关键词:鸭源小鹅瘟病毒;樱桃谷肉鸭;病理变化;损伤
鸭短喙与侏儒综合征(beak atrophy and dwarfism syndrome,BADS),是由鸭源小鹅瘟病毒(duck-origin goose Parvovirus,D-GPV)引起的以樱桃谷雏鸭生长不良、胫骨短而厚、上下喙变短、舌头外伸为特征的疾病[1]。该病是近年来我国樱桃谷鸭新发生的一种疾病,据学者研究,其病原为小鹅瘟病毒变异株,与小鹅瘟病毒经典株、番鸭细小病毒相比,该病毒感染率和死亡率均较低[2-3]。1971年,法国首次报道番鸭中有该病的发生[4]。此后在我国台湾也暴发BADS疫情[5]。2015年,江苏、安徽、四川等地最早报道该病的发生[6]。随后的3年间,BADS发病区域不断扩大,给中国樱桃谷肉鸭养殖企业造成了巨大的经济损失。目前,有关D-GPV对樱桃谷鸭的病理学研究大多仅限于自然病例报道[6-7]。自然病例具有随机单一性和不可控的多重感染和继发感染,同时发病程度因个体差异而存在较大不同,导致病理变化不具有代表性,同时也不能发现病毒侵染损害器官的作用规律。为此,拟通过人工感染的可控方式感染樱桃谷雏鸭,并动态选取各器官进行组织病理学观察,以期阐明D-GPV的病理发生规律及特征,旨在为D-GPV人工感染樱桃谷雏鸭的致病机制研究提供科学的理论依据,也为本病的临床诊断和综合防治提供进一步的科学依据。
1 材料与方法
1.1 实验材料
1.1.1 病原
鸭源小鹅瘟病毒QH-L01株,由本实验室于2016年从四川邛崃某樱桃谷鸭场分离鉴定得到[8],樱桃谷鸭胚尿囊液ELD50为10-6.54·0.2mL-1。
1.1.2 主要试剂及仪器
4%(质量分数)多聚甲醛,75%(体积分数)乙醇、85%(体积分数)乙醇、95%(体积分数)乙醇、100%(体积分数)乙醇、苏木素、伊红、二甲苯、苯蜡、蜡、包埋蜡、超薄切片机。
1.2 实验方法
1.2.1 实验动物分组及处理
60只健康的2日龄樱桃谷雏鸭,购买于成都新太丰农业开发有限公司。随机分为2组:实验组30只,每只肌肉注射鸭胚尿囊液0.2mL(106.54ELD50);空白对照组30只,每只肌肉注射生理盐水0.2mL。
1.2.2 被检材料采取
实验组雏鸭分别于QH-L01株感染后1、3、6、9d剖杀取材,并进行系统的病理学检查,每次随机抽取5只雏鸭,颈动脉放血处死,快速采取心脏、肝脏、脾脏、肺脏、肾脏、腺胃、十二指肠、空肠、回肠、胰腺、盲肠、法氏囊、胸腺、大脑、食道等组织器官,迅速用4%多聚甲醛溶液固定。对照组在相同时间剖杀2只,并取同样脏器。
1.2.3 剖检观察
对D-GPV感染的雏鸭进行剖检检查,记录病理解剖学变化。
1.2.4 病理组织学观察
经4%多聚甲醛缓冲液固定后的组织块,常规石蜡包埋、切片(5μm),苏木素-伊红染色,进行病理组织学观察。
2 结果与分析
2.1 主要临床症状
将QH-L01接种2日龄健康樱桃谷雏鸭。感染后1d,部分鸭张口呼吸;感染后3d,部分鸭呼吸困难,抑郁,精神委顿,拉稀,鼻孔多有分泌物,1只患鸭死亡;感染后6d,4只患鸭死亡,实验组较对照组生长缓慢,3只鸭见胫骨稍肿胀;感染后9d,1只患鸭死亡,实验组患鸭较对照组瘦小。对照组樱桃谷雏鸭均未出现典型的临床症状。发病死亡鸭统计结果见表1。
表1死亡鸭统计表
Table1Statistic number of dead ducks

组别Groups雏鸭数Ducklings发病数Incidence number发病率Incidence rate/%死亡数Death number死亡率Mortality rate/%对照组 Control group300000实验组 Experimental group3030100620
2.2 鸭源小鹅瘟病毒感染雏鸭器官剖检结果
QH-L01株感染雏鸭后,肺、肝、小肠、盲肠及脾脏均表现出明显的病理变化,主要表现为出血、充血及实质细胞坏死。出血、充血表现为组织器官被膜或者黏膜面血管数量增多,实质细胞坏死主要体现为胰腺、脾等器官体积缩小,表面局部色泽暗淡,呈褐色。
肺。感染后1d,肺脏呈鲜红色、质地柔软;感染后3~6d,肺体积缩小,肺脏充血,切面有稀薄泡沫血液流出;感染后9d,肺脏病理剖检未见明显的异常。
肝。感染后1d,肝脏呈淡黄色,稍肿大,表面光滑;感染后3~6d,肝脏体积肿大,局部肝脏呈褐色,被膜紧张,表面有出血点或出血斑;感染后9d,肝脏病理剖检未见明显的异常。
脾。感染后1d,脾脏为粉红色,背面平,腹面凹,呈不规则圆形;感染后3~6d,脾脏颜色暗淡,局部呈现褐色,体积缩小;感染后9d,脾脏未见明显的病理剖检变化。
肾。感染后1d,肾脏呈红褐色长条扁豆状,质地柔软;感染后3~6d,肾脏表面散在有出血点,质脆易碎;感染后9d,肾脏病理剖检未见明显的异常。
腺胃。感染后1~9d,腺胃病理剖检未见明显的异常。
胰腺。感染后1d,胰腺呈淡黄色;感染后3~6d,胰腺呈苍白色,质地易碎,长度稍变短,体积缩小;感染后9d,胰腺呈苍白色。
十二指肠。感染后1d,十二指肠可见肠道轻度肿胀,浆膜面潮红,有散在出血点;感染后3~6d,十二指肠严重肿胀,黏液性分泌物增多,部分鸭可见肠腔积液,有少量脱落的肠上皮细胞的坏死物;感染后9d,十二指肠剖检的病理学变化逐渐减轻。
回肠。感染后1d,回肠病理剖检未见明显的异常;感染后3~6d,回肠肿胀、充血,有稍许黄色液体附着在黏膜表面,局部出血斑;感染后9d,空肠轻度肿胀,程度变轻。
盲肠。感染后1d,盲肠未见明显的病理剖检变化;感染后3~6d,盲肠肿胀,肠腔积液呈褐色,黏液性分泌物增多,黏膜面潮红,有充血或瘀血斑;感染后9d,盲肠症状稍减轻。
法氏囊。感染后1d,法氏囊呈白色,褶皱明显;感染后3~6d,法氏囊体积略有缩小,质地变软;感染后9d,法氏囊未见明显的病理剖检变化。
胸腺。感染后1~9d,胸腺病理剖检未见明显的变化。
脑。感染后1d,未见明显的病理学形态变化;感染后3~6d,局部轻微脑膜充血,稍肿胀;感染后9d,仅可见脑膜稍肿胀。
心、食管、气管、空肠、胸腺。感染后1~9d,均未见明显的病理剖检变化。
对照组樱桃谷雏鸭组织器官病理剖检未见明显的异常。
2.3 鸭源小鹅瘟病毒感染雏鸭器官组织病理学变化
肺脏。感染后1d,肺呈点状出血,部分肺小叶扩张;感染后3d,肺萎缩,肺小叶数量显著减少,结构紊乱,肺小叶管腔代偿性扩张(图1);感染后6d,肺有灶性间质细胞增生,肺小叶数量减少;感染后9d,肺呈灶性出血、肺毛细管数量显著减少,肺小叶腔扩张。
十二指肠。感染后1d,十二指肠肠绒毛顶端上皮细胞坏死;感染后3~6d,十二指肠肠绒毛中度坏死脱落;感染后9d,十二指肠上皮细胞糜烂。
回肠。感染后1d,绒毛顶端轻度坏死脱落;感染后3~6d,绒毛顶端上皮坏死,固有层淋巴细胞数量增加;感染后9d,回肠绒毛坏死,甚至消失,大量炎性细胞浸润。
盲肠。感染后1d,盲肠结构正常;感染后3~6d,盲肠局部黏膜顶端坏死、脱落,淋巴细胞增多;感染后9d,盲肠固有层细胞增多,结构基本正常。
结直肠。感染后1d,结直肠结构正常;感染后3~6d,结直肠黏膜顶端糜烂、脱落;感染后9d,结构基本正常。
肝。感染后1d,肝脏结构正常,肝细胞内含大量胚胎时期吸收卵黄形成的脂肪滴;感染后3d,肝细胞肿胀,少量肝细胞坏死;感染后6d,肝索结构紊乱;感染后9d,肝索单行排列,肝血窦清晰可见。
脾。感染后1d,脾结构正常,红髓白髓界限分明;感染后3~6d,可见脾小结和淋巴细胞增多;感染后9d,淋巴细胞增多。
肾。感染后1d,肾结构正常,肾小管和集合管清晰可见;感染后3~6d,肾轻度萎缩,局部出血;感染后9d,肾轻度萎缩,肾小管管径变小。
胰腺。感染后1d,胰腺结构正常,可见胰岛形成团索,其间有丰富的有空毛细血管;感染后3~6d,可见胰腺轻度肿胀;感染后9d,胰腺腺管结构不清,胰腺结构紊乱。
脑。感染后1d,脑组织轻度水肿,脑膜出血;感染后3~6d,可见脑膜下炎性细胞浸润;感染后9d,局部脑膜下轻度炎性细胞浸润。
法氏囊。感染后1d,法氏囊结构正常;感染后3~6d,法氏囊淋巴滤泡淀粉样变,部分滤泡皮髓质分界不清;感染后9d,法氏囊结构恢复正常。
此外,心、食管、空肠、胸腺,感染后1~9d,病理剖检均未见明显的异常。对照组樱桃谷雏鸭组织器官未见明显的组织病理学变化。

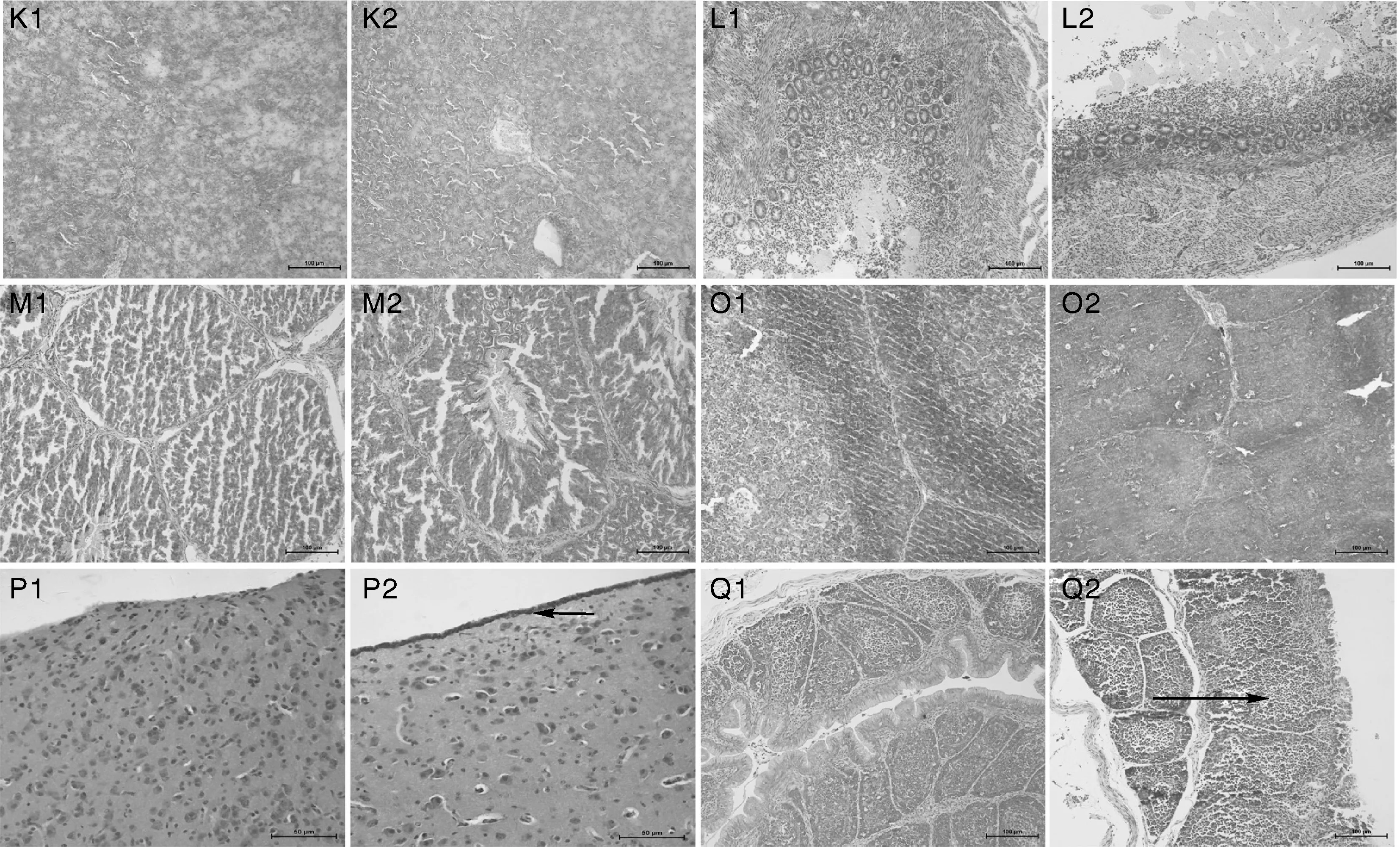
A,3d肺 400×,肺小叶数量显著减少,结构紊乱(箭头所示,下同);B,3d十二指肠200×,肠绒毛中度坏死脱落;C,3d空肠 400×,结构正常;D,3d回肠 400×,绒毛顶端上皮坏死;E,3d盲肠 400×,局部黏膜顶端坏死、脱落;F,6d结直肠 400×,黏膜顶端糜烂、脱落;G,6d心400×,结构正常;H,6d肝400×,结构正常;I,6d脾400×,脾小结和淋巴细胞增多;J,3d肾400×,肾轻度萎缩,局部出血;K,3d胰200×,轻度肿胀;L,6d食管200×,结构正常;M,3d腺胃200×,结构正常;O,6d胸腺200×,结构正常;P,6d脑400×,脑膜下炎性细胞浸润;Q,3d法氏囊200×,法氏囊淋巴滤泡淀粉样变。A1~Q1为对照组;A2~Q2为实验组。HE染色。A,3d Lung 400×,the number of pulmonary lobule decreased significantly and the structure was disordered(indicated by the arrows,the same as below);B,3d Duodenum200×,duodenal villus appeared necrosis and shedding;C,3d Jejunum 400×,normal structure;D,3d Ileum 400×,epithelial necrosis of the villous apex of ileum;E,3d Rectum 400×,apical necrosis and shedding of local mucosa;F,6d Colorectal 400×,apical erosion and shedding of mucosa;G,6d Heart 400×,normal structure;H,6d Liver 400×,normal structure;I,6d Spleen 400×,splenic nodules and lymphocyte was increased;J,3d Kidney 400×,mild renal atrophy and local hemorrhage;K,3d Pancreas200×,mild swelling of pancreas;L,6d Esophagus200×,normal structure;M,3d Proventriculus200×,normal structure;O,6d Thymus200×,normal structure;P,6d Brain 400×,infiltration of inflammatory cells in the meninges;Q,3d Bursa fabricius200×,amyloidosis of the lymphatic follicles of the bursa of fabricius.A1-Q1 were control groups;A2-Q2 were experiment groups.HE staining.图1 不同时间各组织/器官病理切片Fig.1 Tissue/organ pathology slices at different time
3 讨论
BADS是近年来主要影响樱桃谷肉鸭生产的流行性疾病之一,其病原是鸭源小鹅瘟病毒。已报道的分离株有SDLC01株[9]、AH-D15株[6]、SD株[10]、SBDS-GPV M15株[11]等。本研究所用的QH-L01株系本实验室2015年7月分离自临床表现BADS症状的患鸭,并且在2日龄樱桃谷鸭上成功复制出该病临床症状。
汪开毓[12]采用口服接种方式研究人工感染小鹅瘟的病理形态学变化,杨金龙[13]发现口服和注射小鹅瘟病毒,对小鹅瘟病毒在体内的增殖分布影响较小。为保证感染的统一性和接种剂量的准确性,本研究采用2日龄樱桃谷肉鸭,每只肌肉注射0.2mL(106.54ELD50)QH-L01。感染后患鸭临床症状主要表现为呼吸困难、委顿、拉稀、鼻孔有分泌物,病理变化最突出的特征是肺萎缩、肺小叶数量显著减少、十二指肠肠道绒毛上皮细胞坏死脱落。殷冬冬等[6]的动物回归实验结果显示,感染鸭脑实质血管充血,肾、脾等有炎性细胞浸润。陈浩等[7]对临床14日龄发病鸭进行组织切片,结果显示,胸腺组织水肿,肾小管间质出血,肾小管腔狭窄等病理变化。武世珍等[14]对患鸭血液指标研究发现,感染鸭肾脏功能不全,肠道有不同程度损伤。本研究中,脑、肾、脾和胸腺出现的病理变化与前述报道相似,但本实验中肺、十二指肠、回肠、盲肠的病理变化更为明显。由此推测,肺、十二指肠、回肠、盲肠、脑、肾等组织是该病毒的主要靶器官,但仍需配合荧光定量PCR和免疫组化等实验来进行病毒定量和定位研究。
从不同时期剖杀雏鸭的组织学变化来看:感染前期(1d),主要损伤肺、肾、十二指肠;感染中期(3—6d),主要损伤脑、肾,但同时刺激胸腺、法氏囊和脾淋巴细胞增殖;感染后期(9d),肺、肾等部分受损伤器官功能逐渐恢复。临床报道[6,10]显示,患鸭表现出生长发育迟缓,推测其可能的原因为患鸭感染前期肠道绒毛坏死脱落,导致后期机体吸收营养物质能力下降。部分患鸭在接种QH-L01后第3天出现死亡,死因推测为接种QH-L01株病毒后,引起患鸭肺萎缩、呼吸困难,从而导致死亡。宁康等[15]临床发现,感染D-GPV引起的患鸭死亡率较低,可能的原因是D-GPV在浸染樱桃谷鸭过程中,刺激樱桃谷鸭体内胸腺、法氏囊和脾等免疫器官淋巴细胞增多,使其机体免疫功能增强,进而可以杀灭肺、肾和脑等组织/器官中鸭D-GPV或者抵抗组织/器官中D-GPV的侵染。据陈翠腾等[16]报道,D-GPV和鹅细小病毒(GPV)同源性在95.6%以上。但研究发现,本病毒除引起肠道病变外,前期还引起肺出现严重病理变化,但导致肺出现病变的具体原因还有待进一步研究。
值得注意的是,机体组织/器官出现损伤是多种原因相互作用的结果。病毒作为一种生物因子,可产生毒素和代谢产物引起组织损伤,也可通过炎症反应、变态反应引起损伤[17]。本实验中肺、肠道及脑等组织出现的损伤是由病毒在细胞内增殖或者产生毒素还是病毒入侵引起机体炎性抵抗造成的损伤,还需做进一步研究。
:
[1] YU K,MA X,SHENG Z,et al.Identification of goose-origin parvovirus as a cause of newly emerging beak atrophy and dwarfism syndrome in ducklings[J].JournalofClinicalMicrobiology,2016,54(8):1999-2006
G,W,SAMOREK-SALAMONOWICZ E.Genetic variance of Derzsy’s disease strains isolated in Poland[J].Journal of Molecular &Genetic Medicine,2009,3(2):210-216.
[3] WANG S,CHENG X X,CHENG S Y,et al.Phylogenetic analysis of VP1 gene sequences of waterfowl parvoviruses from the Mainland of China revealed genetic diversity and recombination[J].Gene,2015,578(1):124-131.
[4] PALYA V,ZOLNAI A,BENYEDA Z,et al.Short beak and dwarfism syndrome of mule duck is caused by a distinct lineage of goose parvovirus[J].AvianPathology,2009,38(2):175-180.
[5] LU Y,LIN D,LEE Y,et al.Infectious bill atrophy syndrome caused by parvovirus in a co-outbreak with duck viral hepatitis in ducklings in Taiwan[J].AvianDiseases,1993,37(2):591-596.
[6] 殷冬冬,唐井玉,王瑞,等.新型鸭源细小病毒安徽株AH-D15株的分离鉴定[J].中国预防兽医学报,2016,38(7):528-531.
YIN D D,TANG J Y,WANG R,et al.Isolation and identification of a newly emerged duck derived Parvovirus[J].ChineseJournalofPreventiveVeterinaryMedicine,2016,38(7):528-531.(in Chinese with English abstract)
[7] 陈浩,窦砚国,唐熠,等.樱桃谷肉鸭短喙长舌综合征病原的分离鉴定[J].中国兽医学报,2015,35(10):1600-1604.
CHEN H,DOU Y G,TANG Y,et al.Isolation and identification of the pathogen of beak atrophy and dwarfish syndrome in cherry valley duck[J].ChineseJournalofVeterinaryScience,2015,35(10):1600-1604.(in Chinese with English abstract)
[8] 陈兵,徐婧,罗启慧,等.樱桃谷肉鸭源细小病毒QH-L01株的分离鉴定及VP1基因序列分析[J].中国兽医科学,2017,47(7):909-914.
CHEN B,XU J,LUO Q H,et al.Isolation,identification and analysis of VP1 gene of a Cherry Valley duck-origin parvovirus strain QH-L0[J].ChineseVeterinarvScience,2017,47(7):909-914.(in Chinese with English abstract)
[9] CHEN H,DOU Y,TANG Y,et al.Isolation and genomic characterization of a duck-origin GPV-related parvovirus from Cherry Valley ducklings in China[J].PLoSOne,2015,10(10):e0140284.
[10] 崔元,王建昌,李玉保,等.鸭短喙-侏儒综合征及其病原的初步研究[J].中国预防兽医学报,2016,38(5):348-351.
CUI Y,WANG J C,LI Y B,et al.Case study on duck short beak and dwarfism syndrome[J].ChineseJournalofPreventiveVeterinaryMedicine,2016,38(5):348-351.(in Chinese with English abstract)
[11] 肖世峰,程晓霞,陈仕龙,等.短喙与矮小综合征鹅细小病毒对樱桃谷鸭的致病性研究[J].中国预防兽医学报,2016,38(9):690-694.
XIAO S F,CHENG X X,CHEN S L,et al.Pathogenicity of short beak goose parvovirus in Cherry Valley ducks[J].ChineseJournalofPreventiveVeterinaryMedicine,2016,38(9):690-694.(in Chinese with English abstract)
[12] 汪开毓.人工感染小鹅瘟的病理形态学研究[J].畜牧兽医学报,1998,29(4):377-384.
WANG K Y.Pathomorphological study on experimental gosling plague[J].ActaVaterinariaetZootechnicaSinica,1998,29(4):377-384.(in Chinese with English abstract)
[13] 杨金龙.小鹅瘟强毒在人工感染雏鹅体内侵染规律及对消化道菌群结构影响的分子解析[D].雅安:四川农业大学,2009.
YANG J L.Dynamic distribution of GPVinvivoand molecular analysis on structure of the intestinal flora after infected GPV[D].Ya’an:Sichuan Agricultural University,2009.(in Chinese with English abstract)
[14] 武世珍,靖吉强,李舫,等.鸭短喙长舌综合征的血液生化指标测定与分析[J].黑龙江畜牧兽医,2016(18):97-98.
WU S Z,JING J Q,LI F,et al.Determination and analysis of blood biochemical indices in short beaked and long-tongue syndrome duck[J].HeilongjiangAnimalScienceandVeterinaryMedicine,2016(18):97-98.(in Chinese)
[15] 宁康,王丹,王府民,等.樱桃谷北京鸭短喙和侏儒综合征的初步研究[J].中国兽医杂志,2015,51(10):7-10.
NING K,WANG D,WANG F M,et al.Preliminary studies on short beak and dwarfism syndrome of Cherry Valley Pekin duck[J].ChineseJournalofVeterinaryMedicine,2015,51(10):7-10.(in Chinese with English abstract)
[16] 陈翠腾,万春和,傅秋玲,等.樱桃谷肉鸭源鹅细小病毒的分离与鉴定[J].中国家禽,2015,37(23):47-49.
CHEN C T,WAN C H,FU Q L,et al.Isolation and identification of Cherry Valley duck-origin goose parvovirus[J].ChinaPoultry,2015,37(23):47-49.(in Chinese)
[17] 马学恩.家畜病理学[M].4版.北京:中国农业出版社,2007:33-34.
Pathologicalstudyonduck-origingooseParvovirusstrainQH-L01infectionofCherryValleyduck
CHEN Bing1,XU Jing1,2,LUO Qihui1,2,HUANG Chao1,LIU Wentao1,WU Hong2,CHEN Jingfei1,CHEN Ping1,GAO Qi1,MA Wenjing1,CHEN Zhengli1,2,*
(1.LaboratoryofAnimalDiseaseModel,CollegeofVeterinaryMedicine,SichuanAgriculturalUniversity,Chengdu611130,China;2.KeyLaboratoryofAnimalDiseaseandHumanHealthofSichuanProvince,SichuanAgriculturalUniversity,Chengdu611130,China)
Abstract:In the present study,the histopathological changes of various organs of Cherry Valley ducklings were explored under the condition of artificial infection,to clarify the pathogenesis and characteristics of duck-origin goose Parvovirus strain QH-L01.Thirty Cherry Valley ducks in experimental group were intramuscularly inoculated with 0.2mL of 106.54ELD50duck-origin goose Parvovirus strain,and the ducks in the control group were intramuscularly inoculated with 0.2mL of sterilized normal saline per duck,to observe the pathological changes of various tissues/organs in each infective stage at 1,3,6,9d,respectively.On the 1stday after infection,the lungs appeared punctate hemorrhage,partial lobular expansion,and intestinal tissue villous epithelial cells necrosed.On the 3rdday after infection,brain,kidney,thymus,bursa fabricius showed pathological changes,and villus of duodenum and ileum slight necrosed,mucosa layer of cecum appeared slight necrosis.On the 6thday after infection,lymphocytes in spleen increased,moderate necrosis was detected in villus of duodenum,ileum and mucosa layer of cecum.On the 9thday after infection,the lesions were reduced or returned to normal.The mortality rate was 20% during the whole infection period.
Key words:duck-origin goose Parvovirus;cherry valley duck;pathological change;damage
中图分类号:S855.3
A
文章编号:1004-1524(2018)06-0932-07
收稿日期:2017-09-25
基金项目:国家科技支撑计划(2014BAI03B01);国家重大科学仪器设备开发专项(2013YQ49085906)
作者简介:陈兵(1990—),男,四川遂宁人,硕士研究生,研究方向为实验动物疾病模型研究。E-mail:cbing13@163.com
,陈正礼,E-mail:chzhli75@163.com
10.3969/j.issn.1004-1524.2018.06.07
(责任编辑卢福庄)

