人源肺癌循环肿瘤细胞系在不同品系小鼠上肺转移能力研究
阙祖俊,董昌盛,罗 斌,田建辉
(1上海中医药大学附属龙华医院,2上海市中医药研究院中医肿瘤研究所,上海200032)
0 引言
肺癌是发病率和死亡人数增长最快,对人类健康和生命威胁最大的恶性肿瘤之一[1-2],而转移是导致癌症患者死亡的最主要原因[3],针对早期肺癌术后患者进行及早干预进而预防肺癌转移是提高总体生存期的关键[4]。研究肺癌的转移机制进而阻断肺癌的复发转移对于提高临床疗效具有重要意义,因此,急需建立符合临床病理实际发病特征的肺癌转移模型。循环肿瘤细胞(circulating tumor cells,CTCs)是指从原发灶或转移灶脱落,在血液和淋巴管中循环的细胞[5],它与肺癌的转移具有十分密切的关系,在肺癌的预后、临床分期及疗效评价等方面具有重要意义[6-7]。以CTCs为靶点的药物研发和治疗策略的制订很可能成为预防肺癌转移的关键。故本实验采用人源肺癌循环肿瘤细胞(CTC-TJH-01),通过在不同品系小鼠上建立尾静脉注射肺转移模型,为研究肺癌转移机制及抗肺癌转移药物的筛选提供理想的动物模型。
1 材料和方法
1.1 仪器和试剂荧光倒置显微镜(DMI3000B),德国莱卡公司;CO2培养箱(STERI-CYCLE i160),美国Thermo公司;Eppendorf冷冻离心机(5804R),德国艾本德公司;F12K培养基,胎牛血清,胰蛋白酶,美国Gibco公司。
1.2 实验动物和细胞C57BL/6小鼠、Nude小鼠和NOD/SCID小鼠,雄性,体质量18~22 g,4~6周龄,各10只,购自并饲养于上海南方模式生物科技发展有限公司[生产许可证号:SCXK(沪)2014-0002;使用许可证号:SYXK(沪)2013-0035]。CTC-TJH-01细胞由课题组分离培养与建系。
1.3 实验方法
1.3.1 细胞培养 将CTC-TJH-01细胞置于含10%胎牛血清的F12K完全培养基中,在37℃、50 mL/L CO2、70%湿度的恒温细胞培养箱中培养、传代,取对数生长期的细胞用于后续实验[8]。
1.3.2 小鼠肺转移模型的建立 将对数生长期的CTC-TJH-01细胞消化、计数,用0.9%的生理盐水调整细胞浓度为1×107个/mL,通过尾静脉注射100 μL的CTC-TJH-01细胞悬液接种于C57BL/6小鼠、Nude小鼠和NOD/SCID小鼠体内,每组10只。
1.3.3 小鼠肺转移情况观察 CTC-TJH-01细胞接种于小鼠体内后,每隔两周处死每组一只小鼠,取肺脏组织,在解剖学显微镜下观察肺部成瘤情况,计算转移灶数目。然后用中性福尔马林固定,制作石蜡切片,进行H&E染色,观察肺脏组织及转移灶情况。
1.3.4 病理组织切片检查 处死小鼠后取出肺脏标本,浸泡于10%的中性福尔马林中固定48 h,常规石蜡包埋切片,H&E染色,染色切片于光学显微镜下观察肺组织及转移灶形态变化并拍照。
1.4 作图分析实验数据采用GraphPad Prism5和Adobe Photoshop CS4软件进行作图。
2 结果
2.1 CTC-TJH-01细胞在NOD/SCID小鼠上肺转移率100%将CTC-TJH-01细胞通过尾静脉注射接种于NOD/SCID小鼠体内后第8周,首次在小鼠肺脏发现转移灶,在第10周将剩余小鼠全部处死,发现肺部成瘤率为100%(图1A、1B)。通过对转移灶进行H&E染色发现肿瘤细胞排列紧密、细胞核较大且深染(图1C、1D)。表明NOD/SCID小鼠可用于肺转移模型的建立和抗转移药物的筛选。
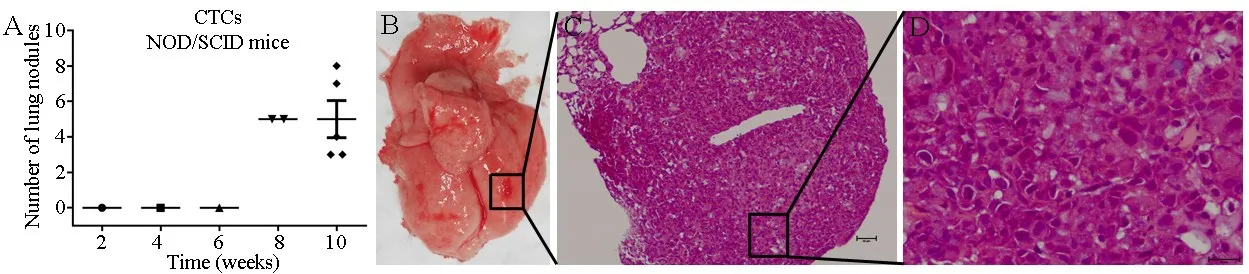
图1 CTC-TJH-01细胞在NOD/SCID小鼠上的肺转移模型
2.2 CTC-TJH-01细胞在Nude小鼠肺部不成瘤将CTC-TJH-01细胞通过尾静脉注射接种于Nude小鼠后,即使在第20周,在小鼠肺部仍未发现转移灶(图2)。其原因可能是Nude小鼠体内存在的B淋巴细胞和NK细胞对CTC-TJH-01细胞发生了排斥作用,清除了外周血中的CTCs,从而抑制了CTCs的转移。
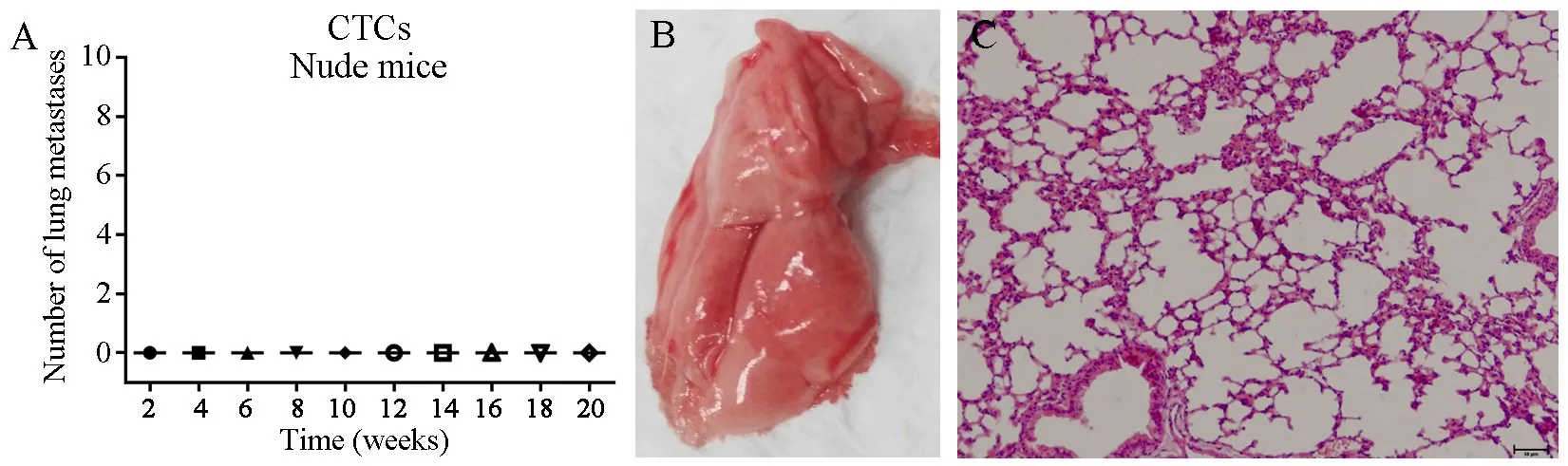
图2 CTC-TJH-01细胞在Nude小鼠上的肺转移模型
2.3 CTC-TJH-01细胞在C57BL/6小鼠肺部不成瘤将CTC-TJH-01细胞通过尾静脉注射接种于C57BL/6小鼠,直到第20周,在小鼠的肺部均未发现转移灶,由于免疫排斥作用,CTC-TJH-01细胞在C57BL/6小鼠上不具有肺转移能力(图3)。
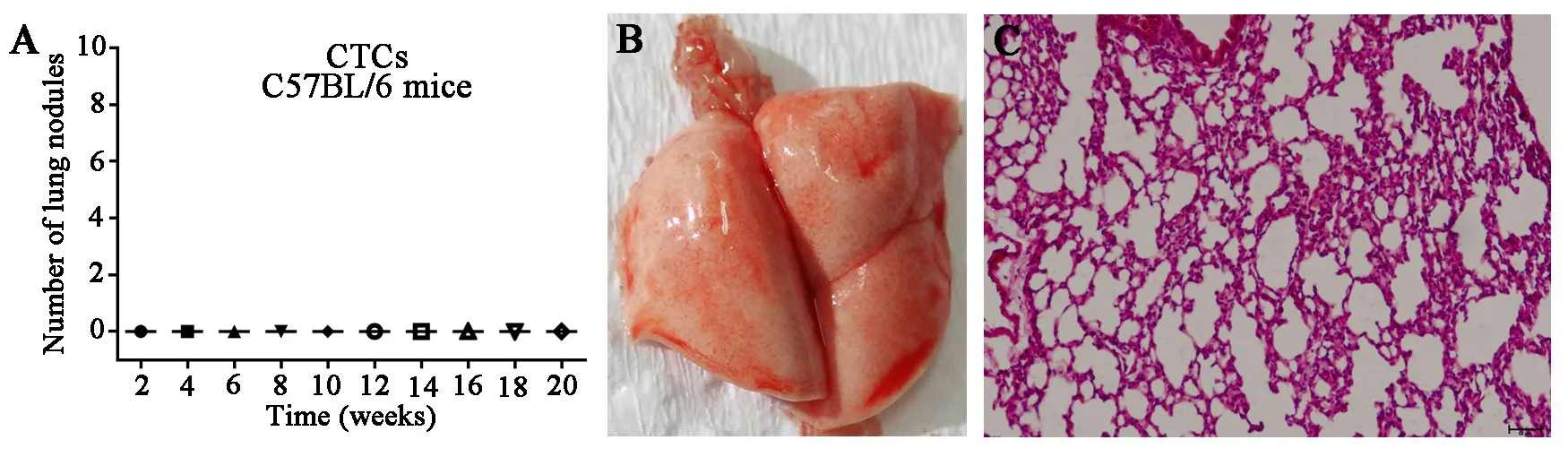
图3 CTC-TJH-01在C57BL/6小鼠上的肺转移模型
3 讨论
转移是导致肺癌死亡的主要原因,而当前干预疗效不佳的原因是临床往往参考肿瘤原发灶病理用药,而在转移中起到关键作用的CTCs并未得到重视,因此肺癌早期预防转移的干预并未体现精准医学的指导理念。研究组前期发现早期肺癌患者即高表达CTCs[9],并在IIa期女性肺腺癌患者外周血提取并建立了CTC-TJH-01细胞系[10],采用外显子测序分析,证实其来源于原发肿瘤[11]。初步发现与原代肺癌细胞系相比,该CTCs对紫杉醇和顺铂的耐药性更强,初步提示了术后化疗效果不佳的原因[12]。因此,体外抗转移药物的筛选应该以CTCs系为主开展,因为其表型已经发生改变,并与肺癌细胞系具有很大差异。然而,当前的人源肿瘤异种移植模型主要是建立的皮下移植瘤模型[13-16],并不能用于抗转移药物的筛选,因此,急需建立符合临床实际发病特征的肺癌转移模型。
本课题组长期探索肺癌的临床前动物模型的构建,认为模拟肺癌发病的实际病理过程和特征是成功与否的关键。本研究选用不同免疫背景的C57BL/6小鼠、Nude小鼠和NOD/SCID小鼠,在相同的实验条件下采用尾静脉注射将CTC-TJH-01细胞接种到小鼠体内,但由于小鼠品系、免疫背景和生理病理特点不同,其肺部成瘤率也存在很大差异。研究发现CTCTJH-01细胞在NOD/SCID小鼠上接种第10周后即可100%成瘤,而在 Nude小鼠和 C57BL/6小鼠上CTCs不成瘤。其可能的原因是人源肺癌循环肿瘤细胞具有较强的免疫原性,在小鼠体内激发了免疫排斥反应。因为C57BL/6小鼠为免疫功能正常小鼠,具有正常水平的T、B淋巴细胞和NK细胞;Nude小鼠由于无胸腺,故T淋巴细胞比例极低,但具有正常功能的B淋巴细胞和NK细胞,而NOD/SCID小鼠是联合免疫缺陷小鼠,其体内表达极低的T、B淋巴细胞和NK细胞,因其免疫力更低,更容易接受异种移植。
本研究表明当小鼠体内存在B淋巴细胞和NK细胞时,对人源肺癌循环肿瘤细胞具有较强的排斥作用,可显著抑制小鼠肺部成瘤。Zahidunnabi等[17]研究也发现将人源乳腺癌细胞接种到NOD/SCID小鼠体内,并同时接种NK细胞后可显著抑制乳腺癌的生长和转移。此外,Vikis等[18]研究发现肿瘤细胞在不同品系小鼠上的生长和转移差异与T细胞的功能相关。因此,在建立人源循环肿瘤细胞肺转移模型的实验研究中,NOD/SCID小鼠可满足实验研究所需的条件,是较为理想的动物模型。本研究初步确立了CTCs尾静脉注射后的成瘤时间和干预节点,并提出成瘤率可以作为转移干预的疗效评价指标。
本研究采用人源肺癌循环肿瘤细胞系建立的肺癌转移模型,其目的是尽可能模拟临床发病的实际情况,为筛选抗转移药物提供工具,但也存在仍待完善之处。首先,该模型未能体现人体免疫系统与肿瘤之间的相互作用,因此也不能用于抗转移免疫治疗药物的研发,但可用于DC-CIK或CAR-T等细胞免疫治疗研究。其次,由于CTCs的异质性问题,筛选抗转移药物的过程中未必能够精准靶向真正引起转移发生的CTCs亚群细胞,这也是目前该领域的主要瓶颈。最后,由于个体差异和肺癌患者接受不同的治疗,CTCs细胞系存在着不同的突变基因和表型,单一CTCs细胞株不能满足于研发针对CTCs的靶向药物。
综上所述,本研究表明不同遗传背景的小鼠可显著影响人源肺癌循环肿瘤细胞的转移,而将CTCs通过尾静脉注射接种到NOD/SCID小鼠体内,能够建立肺癌转移动物模型,且动物肺部成瘤时间较长,可为研究肺癌转移机制和抗转移药物的筛选提供较好的实验平台。
[1]Siegel RL,Miller KD,Jemal A.Cancer statistics,2017[J].CA Cancer J Clin,2017,67(1):7-30.
[2]Chen W,Zheng R,Zhang S,et al.Cancer incidence and mortality in China in 2013:an analysis based on urbanization level[J].Chin J Cancer Res,2017,29(1):1-10.
[3]Chaffer CL,Weinberg RA.A perspective on cancer cell metastasis[J].Science,2011,331(6024):1559-1564.
[4]Rusch VW,Chansky K,Kindler HL,et al.The IASLC mesothelioma staging project:Proposals for the M descriptors and for revision of the TNM stage groupings in the forthcoming(eighth)edition of the TNM classification for mesothelioma[J].J Thorac Oncol,2016,11(12):2112-2119.
[5]Massagué J,Obenauf AC.Metastatic colonization by circulating tumour cells[J].Nature,2016,529(7586):298-306.
[6]Ilie M,Hofman V,Long-Mira E,et al.“Sentinel” circulating tumor cells allow early diagnosis of lung cancer in patients with chronic obstructive pulmonary disease[J].PLoS One,2014,9(10):e111597.
[7]Dorsey JF,Kao GD,MacArthur KM,et al.Tracking viable circulating tumor cells(CTCs)in the peripheral blood of non-small cell lung cancer(NSCLC)patients undergoing definitive radiation therapy:pilot study results[J].Cancer,2015,121(1):139-149.
[8]阙祖俊,罗 斌,周之毅,等.金复康“扶助正气、清透伏毒”预防肺癌转移的细胞学机制研究[J].上海中医药杂志,2016,50(8):70-74.
[9]田建辉,罗 斌,毕 凌,等.非小细胞肺癌循环肿瘤细胞表达规律及其与“伏邪”致病关系的研究[J].上海中医药杂志,2016,50(1):15-19.
[10]Wang Z,Wu W,Wang Z,et al.Ex vivo expansion of circulating lung tumor cells based on one-step microfluidics-based immunomagnetic isolation[J].Analyst,2016,141(12):3621-3625.
[11]Zhang Y,Tang Y,Sun S,et al.Single-cell codetection of metabolic activity,intracellular functional proteins,and genetic mutations from rare circulating tumor cells[J].Anal Chem,2015,87(19):9761-9768.
[12]Pignon JP,Tribodet H,Scagliotti GV,et al.Lung adjuvant cisplatin evaluation:A pooled analysis by the LACE Collaborative Group[J].J Clin Oncol,2008,26(21):3552-3559.
[13]邱业峰,赵志兵,法云智.人源性肿瘤异种移植的小鼠模型在肿瘤精准医学中的应用[J].实验动物科学,2016,33(4):78-83.
[14]李克娟,黄 昊,高 苒,等.人源肿瘤异种移植模型在精准肿瘤医学中的研究进展[J].中国比较医学杂志,2017,27(1):91-98.
[15]顾 蓓,冯海凉,刘玉琴.不同品系小鼠瘤株跨系移植后肿瘤生长及转移情况[J].中华肿瘤杂志,2013,35(7):486-490.
[16]殷婷婷,朱学军.患者来源肿瘤异种移植模型研究的新进展[J].中国肿瘤生物治疗杂志,2017,24(11):1320-1325.
[17]Zahidunnabi D,Terunuma H,Obha K,et al.Potential role of NK cells in tumor growth and metastasis of breast cancer cells in NOD/SCID/γcnull(NOG)mice:Implication of immune therapy[ J].Cancer Res,2005,65:1105.
[18]Vikis HG,Jackson EN,Krupnick AS,et al.Strain-specific susceptibility for pulmonary metastasis of sarcoma 180 cells in inbred mice[J].Cancer Res,2010,70(12):4859-4867.

