组织培养诱导的玉米F1杂交种印迹基因的表达变异研究
吕睿丽,杨 巍,刘 宝,张美善
(1.吉林农业大学农学院,吉林 长春 130118; 2.东北师范大学表观遗传学教育部重点实验室,吉林 长春 130024)
通过有性生殖产生的子代继承了来自父、母双亲本的两套染色体组.按照孟德尔遗传规律,子代中来自双亲本的等位基因应均等表达.虽然绝大多数基因遵循这个表达规律,但在哺乳动物和开花植物中,也有少部分基因只表达源自某一亲本的等位基因,而另一亲本的等位基因完全或部分沉默,即子代基因组根据亲本来源选择表达(择亲表达),这种现象称为基因组印迹,具有这种特殊表达模式的基因称为印迹基因[1].植物中无论是正交还是反交,印迹基因均只有来自某一亲本的等位基因表达.只有来自母本等位基因表达(父本等位基因沉默)的基因称为母本印迹基因(maternally expressed imprinted gene,MEG);只有来自父本等位基因表达(母本等位基因沉默)的基因称为父本印迹基因(paternally expressed imprinted gene,PEG)[1-2].随着高通量转录组测序技术的普及应用,人们已从拟南芥、水稻、玉米、高粱和蓖麻等植物中识别出了几百个印迹基因[3-7].Zhang等[8]和Waters等[5]从以玉米自交系B73和Mo17为亲本材料制备的F1正反杂交种授粉后10 ~14 d的胚乳中,分别获得了179个(68个MEG和111个PEG)和100个(54个MEG和46个PEG)印迹基因.开花植物基因组印迹的发生部位主要是发育种子的胚乳,印迹基因主要在种子器官特异表达[3-8].Waters等[5]分析了71个印迹基因在不同组织中的表达情况,发现其中31个基因(20个MEG和11个PEG)显示胚乳特异表达或优先表达,说明MEG更倾向于胚乳特异表达模式.
印迹基因可被热胁迫诱导表达.拟南芥印迹基因SDS具有胚乳特异表达、在营养器官沉默的表达特性.当植株受到热胁迫时,拟南芥幼叶中SDS基因会被胁迫刺激而激活表达;胁迫越强,诱导表达效果也越显著.SDS基因的诱导表达有利于植株抵抗胁迫[9].
在组织培养过程中,植物外植体在含有植物激素的培养基中失去原有的分化状态,形成无规律的细胞团,即愈伤组织.对于植物来说,组织培养是强胁迫[10].许多研究表明,组织培养能够诱导产生可遗传的遗传变异和表观遗传变异,称为体细胞克隆变异.植物体细胞克隆变异可导致基因组中很多基因的表达模式发生改变[10-12].
本实验以玉米F1正反杂交种幼胚为外植体,诱导和继代培养愈伤组织;选取前人在文献中报道的20个玉米印迹基因(10个MEG和10个PEG)[5,8],研究了在不同继代培养时间(0,3,5,9和12个月)的愈伤组织中发生的印迹基因的表达变异,以为体细胞克隆变异机制及印迹基因功能研究提供理论参考.
1 材料与方法
1.1 植物材料
玉米自交系亲本B73(B)和Mo17(M)种植于吉林农业大学试验地.以人工授粉方法制造F1正反杂交种BM(B73 × Mo17,B73为母本、Mo17为父本)和MB(Mo17 × B73,Mo17为母本、B73为父本).授粉后18 d,从田间选取BM和MB的穗,迅速拿到实验室,用镊子取胚和胚乳,用液氮冷冻,储存于-70℃冰箱备用.叶片材料取自3叶期植株.不同植物材料的取样均设置3个重复.
1.2 愈伤组织的诱导和继代培养
取授粉后18 d的玉米幼嫩种子,先用表面活性剂清洗(去除表面张力),再用自来水冲洗干净,在超净工作台上用70%的酒精进行表面消毒30 s,无菌水冲洗2次后用0.1%的HgCl2溶液浸泡灭菌8 min,然后用无菌水反复冲洗5~6次.在超净工作台上用镊子剥去种皮,取出幼胚,将幼胚盾片朝上分别接种于N6E诱导培养基(N6 3.99 g/L + 2,4-D 2 mg/L + 肌醇 0.1 g/L + 脯氨酸 2.76 g/L + 水解酪蛋白 0.1 g/L + 3 %蔗糖 + 0.68 %琼脂,pH=5.8)和马铃薯培养基(马铃薯用200 g/L无菌水煮沸20 min后过滤,加5 %蔗糖、0.68 %琼脂,调pH=5.8);每个三角瓶中接种10个幼胚,置于25℃人工气候箱进行暗培养.约15 d后长出愈伤组织,把一部分愈伤用液氮冷冻,储存于-70℃冰箱(0继代时间愈伤组织).同时,将愈伤组织分别转移到N6继代培养基(N6 3.99 g/L + 2,4-D 2 mg/L + 肌醇 0.1 g/L + 3%蔗糖 + 0.68 %琼脂,pH=5.8)和马铃薯继代培养基(马铃薯用200 g/L无菌水煮沸20 min 后过滤,加5 %蔗糖、0.68 %琼脂,pH=5.8),置于25℃培养箱中暗培养.继代频率为每隔14~20 d继代一次,每2~3个月取愈伤组织冷冻,并储存于-70℃冰箱,直到用于总RNA提取.愈伤组织的取样设置3次重复,每个重复的愈伤组织分别取自不同的三角瓶.
1.3 总RNA提取和反转录
总RNA提取按照Invitrogen公司Trizol试剂说明书进行.取1 μL总RNA,用NanoDrop 2000超微量分光光度计(Thermo Scientific,http://www.nanodrop.com)测定RNA浓度和质量.各样品RNA质量浓度为0.5~1.5 μg/μL,D(260)/D(280)=1.9~2.0,符合反转录反应要求.另外,用经DEPC处理的水制备1.0%琼脂糖凝胶,鉴定RNA的完整性.
取提取的总RNA 2 μg,用DNaseⅠ(TransGen Biotech)进行去基因组DNA处理,以Oligo(dT)为下游引物进行反转录,具体方法参照TransGen公司反转录试剂盒(TransGen Biotech,http://www.transgen.com.cn)说明书进行.
从Zhang等和Waters等[5,8]报道的玉米印迹基因中随机选出20个印迹基因,用Primer Premier 5.0软件设计引物(见表1).同时,以玉米肌动蛋白基因Actin(ID:GRMZM2G126010)设计参照引物进行PCR,调整各个样品的起始量进行均一化.Actin基因的正反向引物序列分别为CCTGAAGATCACCCTGTGCT和GCAGTCTCCAGCTCCTGTTC.PCR反应参数为:95℃初始变性2 min;然后,95℃30 s,60℃40 s,72℃40 s,25~30次循环(对不同引物,根据预实验结果调整循环数);最后72℃延伸8 min.PCR反应体系为20 μL,使用的试剂购自Takara公司.RT-PCR产物用1.5%琼脂糖进行凝胶电泳.基因功能注释信息查询NCBI数据库(https://www.ncbi.nlm.nih.gov/)和MaizeGDB(https://www.maizegdb.org/)(见表2).

表1 玉米印迹基因RT-PCR引物序列
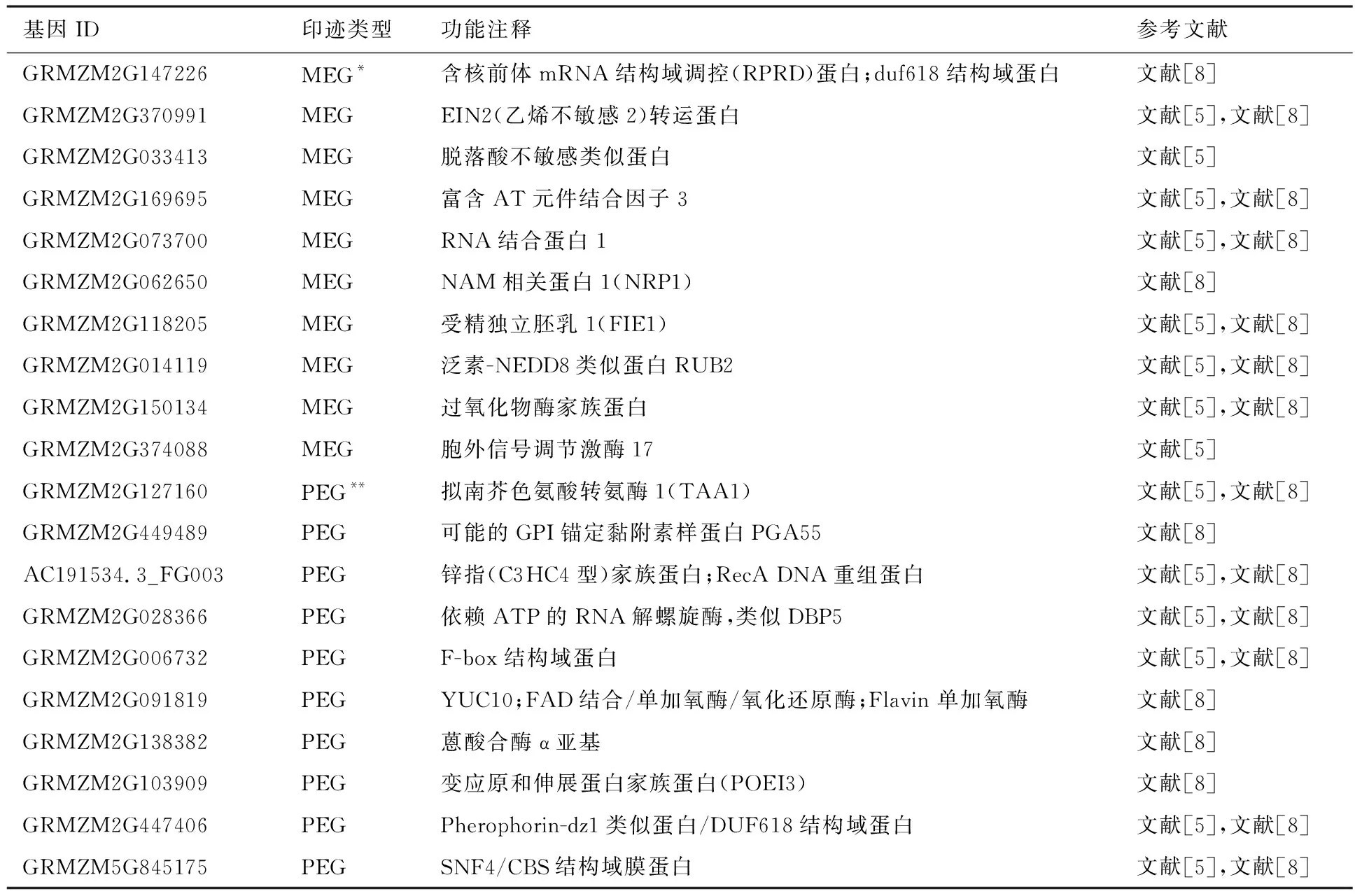
表2 玉米印迹基因功能注释信息和参考文献
注:*表示MEG为母本印迹基因;**表示PEG为父本印迹基因.
2 结果与分析
2.1 不同继代培养时间玉米愈伤组织中母本印迹基因的表达变异
本研究用于组织培养的基因型为玉米两个正反F1杂交种:B73 × Mo17(BM)和Mo17 × B73(MB).由于许多印迹基因只在种子器官表达,在营养器官沉默,本试验把种子器官(胚、胚乳)作为实材,把营养器官(叶片)作为参照.首先检测在5个不同继代培养时间(0,3,5,9,12个月)愈伤组织中10个玉米MEG的表达情况,结果发现有4个MEG出现不同程度的表达变异.其中,胚乳特异表达的GRMZM2G147226基因在继代培养9个月(BM)和12个月(BM和MB)的愈伤中出现微弱的激活表达;胚、胚乳特异表达的GRMZM2G370991基因在0继代培养时间的BM愈伤组织、继代培养9个月(MB)和12个月(BM和MB)的愈伤中出现微弱的激活表达(见图1、表3).除了激活表达,印迹基因的体细胞克隆表达变异也出现了基因沉默变异,如在胚、胚乳和叶片中都有表达的GRMZM2G033413基因,在继代培养9个月(MB)和12个月(BM和MB)的愈伤中出现了基因沉默的现象.GRMZM2G169695基因则在继代培养3个月和5个月的愈伤中出现了基因沉默的现象(见图1、表3).从正反杂交种之间的变异情况来看,只有2个基因(GRMZM2G147226和GRMZM2G370991)在个别年龄的愈伤组织中存在差异.
另外,有6个MEG未显示任何变异.其中,具有胚乳或(和)胚特异表达特性(叶片中不表达)的5个MEG(GRMZM2G073700,GRMZM2G062650,GRMZM2G118205,GRMZM2G014119和GRMZM2G150134),在各个时期愈伤组织中都没有任何激活;而GRMZM2G374088基因则在不同器官及不同时期愈伤组织中都显示了高表达(见图1、表3).
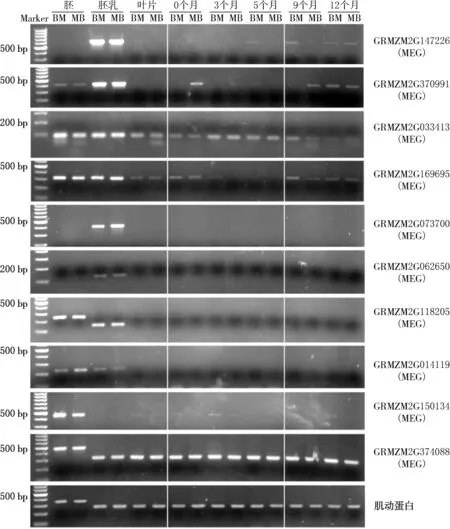
图1 10个玉米母本印迹基因(MEG)在不同继代培养时间愈伤组织中的表达结果

表达模式愈伤组织有无变异及变异类型母本印迹基因(MEG)父本印迹基因(PEG)胚乳特异表达有变异,愈伤表达激活GRMZM2G147226GRMZM2G127160GRMZM2G449489胚、胚乳特异表达有变异,愈伤表达激活GRMZM2G370991AC191534.3_FG003GRMZM2G028366胚、胚乳和叶片均表达有变异,愈伤表达沉默GRMZM2G033413GRMZM2G169695GRMZM2G006732胚乳特异表达无变异,愈伤不表达GRMZM2G073700GRMZM2G062650GRMZM2G091819胚、胚乳特异表达无变异,愈伤不表达GRMZM2G118205GRMZM2G014119胚特异表达无变异,愈伤不表达GRMZM2G150134胚、胚乳和叶片均表达无变异,愈伤表达GRMZM2G374088GRMZM2G138382GRMZM2G103909GRMZM2G447406GRMZM5G845175
2.2 不同继代培养时间玉米愈伤组织中父本印迹基因的表达变异
对10个玉米父本印迹基因(PEG)在正反F1杂交种BM和MB 5个不同继代培养时间(0,3,5,9,12个月)的愈伤组织中表达情况的分析表明,有50%的PEG出现了不同程度的表达变异,而且相对于MEG,PEG的基因表达变异更加明显.具体来说,有2个PEG (GRMZM2G127160和GRMZM2G449489)只在胚乳中特异表达,而在胚和叶片中不表达,但是在9个月和12个月继代培养的愈伤组织中都有少量激活表达(见图2、表3);2个胚和胚乳特异表达的PEG(AC191534.3_FG003和GRMZM2G028366)分别在5个月MB和9,12个月继代培养的愈伤组织中出现了明显的激活表达(见图2、表3);在胚、胚乳和叶片中都有表达的基因GRMZM2G006732在不同时期的愈伤组织中均出现了基因沉默,或表达极其微弱(见图2、表3).
在无变异的5个PEG中,只有GRMZM2G091819属胚乳特异表达基因,另外4个PEG(GRMZM2G138382,GRMZM2G103909,GRMZM2G447406和GRMZM5G845175)在不同器官及不同时期的愈伤中都有表达,尤其是GRMZM2G447406和GRMZM5G845175基因在不同器官及不同时期愈伤组织中均有相似的较高表达(见图2、表3).
3 讨论
在近年来常用的mRNA含量测定技术中,虽然荧光实时定量PCR方法的应用越来越广泛,但事实上,如果只需评估样品之间基因表达水平的相对差异,半定量RT-PCR(semi quantitative reverse transcription PCR,SqRT-PCR)技术则完全可以满足实验要求.与经典的检测基因的表达方法如Northern印迹、RNA酶保护分析等相比,半定量RT-PCR法具有专一性好、快速简便、费用低等优点.尤其是在需要检测不同器官之间表达差异显著的基因时,比起荧光实时定量PCR方法,半定量RT-PCR方法能够更直观地显示基因表达是否存在器官特异性,以及是否发生激活或沉默.本实验的研究目的是为了检测玉米印迹基因在不同培养时间的愈伤组织中的表达变异,而印迹基因在不同组织之间表达差异显著,所以本研究采用了半定量RT-PCR方法分析了基因表达.
本文的研究结果表明,玉米印迹基因的表达变异在继代培养9个月和12个月时明显增加,这与前人的研究结果相似.薛美凤等[13]报道,愈伤组织的培养时间是造成体细胞克隆变异和再生植株表型变异的一个重要原因,随着胚性愈伤组织选择培养时间的延长和继代次数的增多,愈伤细胞感受的胁迫越来越强,体细胞胚变异频率逐渐升高.

图2 10个玉米父本印迹基因(PEG)在不同继代培养时间愈伤组织中的表达结果
从基因功能注释来看,在发生表达变异的4个MEG中,有2个MEG(GRMZM2G370991和GRMZM2G033413)分别被注释为EIN2(乙烯不敏感2)转运蛋白和脱落酸不敏感类似蛋白(见表2).乙烯和脱落酸是两种“逆境激素”,在植物遇到逆境胁迫时含量增加,以便植物抵抗不良的环境条件.愈伤细胞经历离体培养和植物激素等化学物质刺激的“强胁迫”,可能激活与抗逆激素相关的编码基因,这也说明玉米印迹基因除了在种子发育过程中起重要作用以外,在抗胁迫过程中也可能起一定作用.
[参 考 文 献]
[1] GEHRING M.Genomic imprinting:insights from plants[J].Annual Review of Genetics,2013,47:187-208.
[2] SHA K.A mechanistic view of genomic imprinting[J].Annual Review of Genomics and Human Genetics,2008,9:197-216.
[3] HSIEH T F,SHIN J,UZAWA R,et al.Regulation of imprinted gene expression in Arabidopsis endosperm[J].Proceedings of the National Academy of Sciences of the United States of America,2011,108(5):1755-1762.
[4] LUO M,TAYLOR J M,SPRIGGS A,et al.A genome-wide survey of imprinted genes in rice seeds reveals imprinting primarily occurs in the endosperm[J].PLoS Genetics,2011,7(6):e1002125.
[5] WATERS A J,MAKAREVITCH I,EICHTEN S R,et al.Parent-of-origin effects on gene expression and DNA methylation in the maize endosperm[J].The Plant Cell,2011,23(12):4221-4233.
[6] XU W,DAI M,LI F,et al.Genomic imprinting,methylation and parent-of-origin effects in reciprocal hybrid endosperm of castor bean[J].Nucleic Acids Research,2014,42(11):6987-6998.
[7] ZHANG M,LI N,HE W,et al.Genome-wide screen of genes imprinted in sorghum endosperm,and the roles of allelic differential cytosine methylation[J].Plant Journal,2016,85(3):424-436.
[8] ZHANG M,ZHAO H,XIE S,et al.Extensive,clustered parental imprinting of protein-coding and noncoding RNAs in developing maize endosperm[J].Proceedings of the National Academy of Sciences of the United States of America,2011,108(50):20042-20047.
[9] SANCHEZ D H,PASZKOWSKI J.Heat-induced release of epigenetic silencing reveals the concealed role of an imprinted plant gene[J].PLoS Genetics,2014,10(11):e1004806.
[10] SMULDERS,KLERK.Epigenetics in plant tissue culture[J].Plant Growth Regulation,2011,63:137-146.
[11] NGEZAHAYO F,XU C,WANG H,et al.Tissue culture-induced transpositional activity of mPing is correlated with cytosine methylation in rice[J].BMC Plant Biology,2009,9:91.
[12] ZHANG M,XU C,YAN H,et al.Limited tissue culture-induced mutations and linked epigenetic modifications in F hybrids of sorghum pure lines are accompanied by increased transcription of DNA methyltransferase and 5-methylcytisine glycosylases[J].Plant Journal,2009,57(4):666-679.
[13] 薛美凤,郭余龙,李名扬,等.长期继代对棉花胚性愈伤组织体胚发生能力及再生植株变异的影响[J].西南农业学报,2002,15(4):19-21.

