儿童肾病综合征血清TGF-β1、CXCL16及血脂水平变化探析*
卢 洁
成都市第二人民医院 检验科(成都 610017)
肾病综合征(NS)典型病理特征为肾小球滤过膜通透性提高,表现出蛋白尿显著增多、高血脂症等综合征[1]。临床上90%左右NS为原发性NS(PNS),其中超过85%为微小病变型,多对糖皮质激素敏感,即激素敏感型NS(SSNS)[2]。NS发病机制尚不明确,可能与细胞免疫、炎症等有关[3]。转化生长因子β1(TGF-β1)为一种常见细胞因子,可调节细胞增殖、分化及凋亡,可促炎症发生,诱导细胞外基质(ECM)聚集,导致多脏器纤维化[4]。CXC趋化因子配体16(CXCL16)为有趋化功能的细胞因子之一,可溶性CXCL16对CD4+T细胞、CD8+T细胞等多种细胞有趋化作用[5],且B细胞、巨噬细胞等多种因子可表达CXCL16[6],可见CXCL16与免疫反应、炎症反应密切相关。目前关于儿童NS与血清TGF-β1或CXCL16水平关系的相关研究报道较少。本研究旨在分析儿童NS血清TGF-β1、CXCL16和血脂水平的变化情况,现报道如下。
1 资料与方法
1.1 临床资料
选取2016年1月至2017年12月成都市第二人民医院收治的NS患儿150例作为病例组。纳入标准:1)均符合PNS相关诊断标准[7],且经血生化相关检查证实;2)均为初诊患儿;3)既往均未应用糖皮质激素或免疫抑制剂;4)均配合完成相关检查;5)资料完整。排除标准:1)继发性或先天性NS;2)有肾病家族史;3)患免疫性疾病、肿瘤、血液性疾病;4)其他原因引发的高血脂症者;5)肾功能异常、高血糖者。其中男96例,女54例;年龄2.0~13.5(6.25±1.02)岁;病例组活动期患儿100例,缓解期患儿50例(均为活动期随访到缓解期)。选择同期在该院作健康体检的正常儿童60例为对照组,男40例,女20例;年龄2~14(6.34±1.10)岁。病例组患儿和对照组儿童在性别、年龄等基本资料方面比较,差异无统计学意义(P>0.05),具有可比性。
1.2 方法
病例组活动期患儿血尿标本采集前均未接受激素、免疫抑制剂干预。清晨空腹抽取各组受试者静脉血6 mL,常规离心,离心速度3 000 r/min,离心半径17 cm,离心5 min后提取血清保存于-20 ℃冰箱中。采用迈瑞BS-220全自动生化分析仪测定总胆固醇(TC)、甘油三酯(TG)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)等血脂指标及血清白蛋白(ALB)水平,分别采取酶法与溴甲酚绿法;酶联免疫吸附法(ELISA)测定血清TGF-β1、CXCL16水平,ELISA试剂盒由上海恒远生物科技有限公司生产,按照说明书操作。另外收集病例组活动期患儿24 h尿液,记录尿量,通过比色法测定其24 h尿蛋白定量,试剂盒由上海信裕生物科技有限公司提供。
1.3 统计学方法
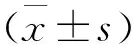
2 结果
2.1 各组血清TGF-β1、CXCL16水平比较
病例组活动期患儿血清TGF-β1、CXCL16水平均明显高于病例组缓解期患儿和对照组儿童,差异有统计学意义(P<0.05);病例组缓解期患儿上述指标与对照组儿童比较,差异均无统计学意义(P>0.05)(表1)。
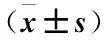
表1 各组儿童血清TGF-β1、CXCL16水平比较
注:与对照组比较,*P<0.05;与病例组缓解期比较,#P<0.05
2.2 各组血脂指标和血清ALB水平比较
病例组活动期患儿TC、TG、LDL-C水平均明显高于病例组缓解期患儿和对照组儿童;ALB水平均明显低于病例组缓解期患儿和对照组儿童,差异有统计学意义(P<0.05);病例组缓解期患儿上述指标与对照组儿童比较,差异均无统计学意义(P>0.05)(表2)。

表2 各组儿童血脂指标、血清ALB水平比较
注:与对照组比较,*P<0.05;与病例组缓解期比较,#P<0.05
2.3 血清TGF-β1、CXCL16水平和24 h尿蛋白定量、ALB、血脂相关性分析
Pearson相关分析表明,病例组活动期NS患儿血清TGF-β1、CXCL16分别与24 h尿蛋白定量、TC、TG、LDL-C呈正相关,与ALB呈负相关(P<0.05)(表3)。

表3 病例组活动期患儿血清TGF-β1、CXCL16水平与24 h尿蛋白定量、ALB、血脂的关系(r)
注:*P<0.05
3 讨论
PNS典型特征为高脂血症与低蛋白血症,前者多通过血脂指标评价,后者则以血清ALB为常见指标。临床上血脂指标包括TC、TG、LDL-C、HDL-C等,TC、TG、LDL-C中任一项或多项指标上升提示高脂血症,血脂中以TC、TG为主要成分,前者可促胆汁酸、细胞浆膜合成,后者以体内能量代谢参与为主。LDL-C属于血中胆固醇运载主要载体之一,借助自由基促使脂质过氧化物等物质产生,且其自身载脂蛋白B之赖氨酸可氧化修饰,之后其会被巨噬细胞的清道夫受体摄取,促胆固醇形成、聚集。本研究结果显示,相比正常儿童,病例组活动期患儿TC、TG、LDL-C水平均明显升高,而HDL-C无明显变化,提示TC、TG、LDL-C可能参与NS发病。同时,血脂指标方面比较,病例组缓解期患儿与对照组儿童比较,差异均无统计学意义,而缓解期患儿均由活动期随访到缓解期,说明TC、TG、LDL-C对儿童NS病情有一定的评估作用,特别是NS活动期。本研究发现,病例组活动期患儿血清ALB水平比对照组儿童及病例组缓解期儿童均明显降低,提示NS活动期血清ALB明显降低,表现出低蛋白血症症状,而经治疗随访到缓解期时患儿症状明显改善。
研究[8]表明,脂质对系膜细胞有刺激作用,促其和单核细胞相互影响,诱导单核细胞分泌释放出相关炎症因子。可见PNS患儿高血脂症表现时多伴炎症。TGF-β1被公认为是主要致纤维化因子,分布在染色体19q3上,外显子7个,其与炎症反应、肾纤维化等均相关[9]。庞楚越等[10]研究表明SSNS急性期血清TGF-β1水平上升,缓解期TGF-β1水平接近正常。刘涛等[11]研究发现SSNS活动期外周血单个核细胞TGF-β1 mRNA表达比正常儿童及缓解期显著高,提示TGF-β1参与NS发生、进展过程,其机制可能为TGF-β1引发肾间质纤维化、促细胞凋亡等。虽然检测方法不同,但本研究结果与之相符。趋化因子与炎症、免疫应答密切相关。CXCL16包括膜结合型与分泌型两种形式,前者在细胞表面跨膜式表达,不仅能发挥细胞表面之黏附分子作用,而且能发挥其清道夫受体的生物作用。膜结合型CXCL16于解整合素样金属蛋白酶10影响下会脱落成可溶型,有趋化活性,对T细胞、NKT细胞(均能表达CXCR6)有招募作用[12]。研究[13-14]表明可溶性足细胞源性CXCL16对T细胞、系膜细胞有趋化作用,诱导系膜细胞增殖。研究[15]发现,PNS患儿CXCL16水平上升,对疾病活动有较好的反映作用。本研究结果发现,NS活动期患儿血清CXCL16水平比缓解期患儿、正常儿童均明显升高,提示CXCE16与NS发病有关,其机制尚不明确,可能与其对足细胞损伤介导有关。
本研究对NS活动期血清TGF-β1、CXCL16与24 h尿蛋白定量、血脂、ALB的相关性进行分析发现,TGF-β1、CXCL16均与24 h尿蛋白定量、TC、TG、LDL-C呈正相关,与ALB呈负相关,提示TGF-β1、CXCL16均参与NS发病,与NS活动密切相关,同时TGF-β1、CXCL16与相关指标的关系保持一致性,说明二者具有相关性,共同参与疾病发生、发展过程。目前临床治疗PNS以激素干预为主,但部分患儿对激素不敏感,有研究重点分析激素敏感型NS相关指标,本研究不足之处为未根据激素敏感与否分组,有待日后通过大样本、多中心研究进一步分析。
综上所述,NS活动期患儿血清TGF-β1、CXCL16水平升高,TGF-β1、CXCL16与血脂相关指标、24 h尿蛋白定量、ALB均相关,监测血清TGF-β1、CXCL16可用于儿童NS病情活动评估。
[1]中华医学会儿科学分会肾脏学组. 激素耐药型肾病综合征诊治循证指南(2016)[J]. 中华儿科杂志, 2017, 55(11):805-809.
[2]全国儿童常见肾脏病诊治现状调研工作组. 我国儿童激素敏感、复发/依赖肾病综合征诊疗现状的多中心研究[J]. 中华儿科杂志, 2014, 52(3):194-200.
[3]周发为, 游文忠, 覃仕锋, 等. 小儿激素敏感型肾病综合征血清中IL-4、IL-5、TGF-β与IL-10水平变化及意义[J]. 中国免疫学杂志, 2014, 30(5): 673-676.
[4]Scharpfenecker M,Floot B,Russell N S,etal. The TGF-β co-receptor endoglin regulates macrophageinfiltration and cytokine production in the irradiated mousekidney [J]. Radiother Oncol,2012,105(3):313-320.
[5]朱艳姬, 李倩, 孙书珍. 原发性单纯型肾病综合征患儿血清CXCL16和干扰素γ的检测及临床意义[J]. 中国实用儿科杂志, 2013, 28(10): 790-792.
[6]Izquierdo M C, Martin-Cleary C, Fernandez-Fernandez B,etal. CXCL16 in kidney and cardiovascular injury[J]. Cytokine Growth Factor Rev, 2014, 25(3): 317-325.
[7]刘光陵, 何旭. 小儿肾病综合征的诊断与治疗[J]. 中国全科医学, 2007, 10(20): 1709-1711.
[8]任娜, 王艳, 焦宏, 等. 儿童原发性肾病综合征激素治疗前后血清蛋白及血脂的变化特点[J]. 山西医科大学学报, 2018, 49(1): 59-62.
[9]Hsieh T J, Hsieh P C, Tsai Y H,etal. Melamine induces human renal proximal tubular cell injury via transforming growth factor-β and oxidative stress[J]. Toxicol Sci, 2012, 130(1): 17-32.
[10] 庞楚越, 张一, 段相国, 等. 激素敏感型肾病综合征患儿血清IL-10、IL-21和TGF-β1水平变化及临床意义[J]. 宁夏医科大学学报, 2017, 39(9): 1012-1015.
[11] 刘涛, 张碧丽, 王健. 儿童原发性肾病综合征外周血TGF-β_1及IL-18mRNA检测的临床意义[J]. 临床儿科杂志, 2015, 33(6): 520-524.
[12] Abel S, Hundhausen C, Mentlein R,etal. The transmembrane CXC-chemokine ligand 16 is induced by IFN-gamma and TNF-alpha and shed by the activity of the disintegrin-like metalloproteinase ADAM10[J]. J Immunol, 2004, 172(10): 6362-6372.
[13] Gutwein P, Abdel-Bakky M S, Schramme A,etal. CXCL16 is expressed in podocytes and acts as a scavenger receptor for oxidized low-density lipoprotein[J]. Am J Pathol, 2009, 174(6): 2061-2072.
[14] Schramme A, Abdel-Bakky M S, K mpfer-Kolb N,etal. The role of CXCL16 and its processing metalloproteinases ADAM10 and ADAM17 in the proliferation and migration of human mesangial cells[J]. Biochem Biophys Res Commun, 2008, 370(2): 311-316.
[15] Zhen J, Li Q, Zhu Y,etal. Increased serum CXCL16 is highly correlated with blood lipids, urine protein and immune reaction in children with active nephrotic syndrome[J]. Diagn Pathol, 2014, 9:23.

