早发抑郁患者功能磁共振成像*对下脑区静息态自发活动与疾病严重程度的相关性研究
李 鹏 王长明 李 峰 李先斌 周 艳 王传跃*
抑郁症是一种常见的精神疾病,其发病机制尚不明确,可能与年龄、性别、神经发育异常、社会生活事件以及生存周围环境有关[1]。目前的研究主要集中在分子生物学以及基因遗传学等方向,近年来,功能磁共振成像(functional magnetic resonance imaging,fMRI)技术的发展对抑郁症的研究提供了新的思路,抑郁症的严重程度与脑区功能的异常变化可能相关[2]。作为抑郁症的一种可能亚型,早发性抑郁症(early-onset depression,EOD)是一种以抑郁首次发作年龄来划分的群体,其在疾病的严重程度、治疗难度以及预后评估均表现出与成年抑郁不同的特征[3-4]。而对于EOD患者特殊群体的研究尚不够深入,故通过静息态功能MRI相关研究探索该疾病的可能发生机制。
低频振幅(amplitude low frequency fluctuation,ALFF)、比率低频振幅(fractional amplitude of low frequency fluctuation,fALFF)作为可反映静息状态中大脑脑区自发活动的成熟指标,已大量应用于对精神类疾病的研究[5-7]。本研究应用静息态低频振幅、比特低频振幅联合应用的方法,与汉密尔顿抑郁量表(Hamilton depression scale,HAMD)分数进行相关性分析,初步探索静息态下异常活动脑区与抑郁症严重程度的相关性。
1 资料与方法
1.1 一般资料
选取2014-2016年在首都医科大学附属北京安定医院门诊以及住院的20例EOD患者并纳入EOD组,其中男性13例,女性7例;年龄18~55岁,平均年龄(30.65±10.75);HAMD-17[9]总分为24~37分,平均(28.3±3.2)分。另选取年龄、性别、受教育程度等方面与EOD组相匹配的20名健康体检者纳入健康对照组,其中男性13名,女性7名;年龄18~55岁,平均年龄(30.50±10.51)。本研究为非干预性研究,将按照符合世界医学协会赫尔辛基宣言、[国际协调会议(International Conference on Harmonization,ICH)与临床试验管理规范(good clinical practice,GCP),ICH/GCP]的伦理原则以及非干预性研究使用法律下进行。两组受试者年龄、受教育年限差异均无统计学意义。所有受试者均签署知情同意书并表示自愿参加,受试者的个人信息均在保密前提下使用,研究者保障被试者充分足够了解该非干预事件的性质、目的、潜在风险和获益,保障被试者随时可退出该研究的权利。
1.2 纳入与排除标准
(1)纳入标准:①EOD组患者符合《疾病和有关健康问题的国际统计分类》第10版[8](ICD-10)中重度抑郁障碍诊断标准,目前处于发作期;②首次发作年龄为12~25岁,右利手,性别不限,初中及以上文化水平;③近3个月来未行无抽搐电休克治疗(Mmodified Eelectroconvulsive Ttherapy,MECT)。
(2)排除标准:①EOD组患者既往存在轻躁狂或躁狂发作者;②既往或现患抑郁发作以外精神疾病者;③存在MRI检查禁忌者;④存在严重自杀倾向者;⑤存在神经系统疾病者;⑥妊娠期妇女。
1.3 仪器设备
采用MAGNETOM Trio型3.0T磁共振成像系统(德国Siemens公司)。
1.4 影像学数据采集及预处理
1.4.1 数据采集
(1)EOD组和健康对照组均行静息态功能磁共振扫描,并采用同一台磁共振成像系统,按顺序完成T1像、定位图像、三维(three dimensional,3D)解剖结构像及fMRI扫描,扫描时受试者应保持清醒安静、头部固定,闭眼平卧,避免主被动思维及接受任务,仪器在使用前需进行稳定性及其他相关测试,待机器运行平稳后对受试者进行头部扫描。
(2)扫描检查的时间约为26 min,128层矢状位扫描,层厚为1.33 mm,层间距为1 mm,层内分辨率为256×192,脉冲重复时间(repetition time,TR)为2 530 ms,回波时间(echo time,TE)为3.39 ms,翻转角(flip angle,FA)为7°,视野(field of view,FOV)=256 mm×256 mm。静息态fMRI扫描采用梯度回波-平面回波T2加权序列,33层轴位扫描,层厚/层间隔=3.5 mm/0.7 mm,脉冲TR/TE/FA=2 000 ms/30 ms/90°,FOV=232 mm×232 mm,数据矩阵=64×64,扫描时间为480 s。
1.4.2 数据预处理和ALFF、fALFF值的计算
所有数据均采用DPARSF软件行预处理。①原始资料图像以医学数字成像及通信(digital imaging and communication of medicine,DICOM)格式重建;②去掉受试者扫描前10个时间点序列,以防止机器预热初始信号不稳定造成的偏差;③剩余数据顺序进行时间校正,减少获取时间上的差异;头动校正,排除头动>3 mm、转动>3°的受试者2名;④空间校正,将所有受试者图像配准至蒙特利尔神经科学研究所,高斯平滑,平滑核为4 mm×4 mm×4 mm,平滑处理以提高信噪比;⑤所有静息态数据均进行去除线性漂移及滤波处理,滤波的频率带宽为0.01~0.08 Hz,排除机器以及受试者呼吸心跳的高频噪音,处理后的波段被认为可以反映静息态下的脑自发活动[10]。选取全脑为种子点,计算ALFF值[11]。将此范围的低频振幅求和,再除以0.01~0.08 Hz频段的振幅总和,所得值即为fALFF值[12]。
1.5 统计学方法
采用REST1.8软件将EOD组和健康对照组的ALFF及fALFF值均进行单样本t检验,通过RestImage Calculator软件对各自的结果并集后计算出感兴趣区,缩小样本比对范围。然后顺序对EOD组和健康对照组各自的ALFF/fALFF值进行双样本t检验,其中性别、年龄及教育年限均为协变量,剔除其对试验的不良影响,经蒙特卡洛模拟的AlphaSim校正,以P<0.05为脑区差异有统计学意义(多重比较校正)。对存在统计学意义差异脑区的ALFF值和fALFF分别与HAMD-17量表总分做相关分析,并得到相关性系数图,从而评估早发抑郁患者自发活动功能异常的脑区对疾病严重程度的影响。

表1 EOD组脑自发低频振幅活动与HAMD-17评分的相关性
2 结果
2.1 EOD组脑自发低频振幅活动与HAMD-17评分的相关性比较
EOD组患者的右侧颞中回、左侧背外侧额上回、右侧岛叶、左侧枕上回及ALFF值随着HAMD-17评分增加而逐渐增强,而在右侧颞上回颞级、左侧颞中回颞级及左侧海马区域随着HAMD-17评分增加而减弱(如图1所示)。
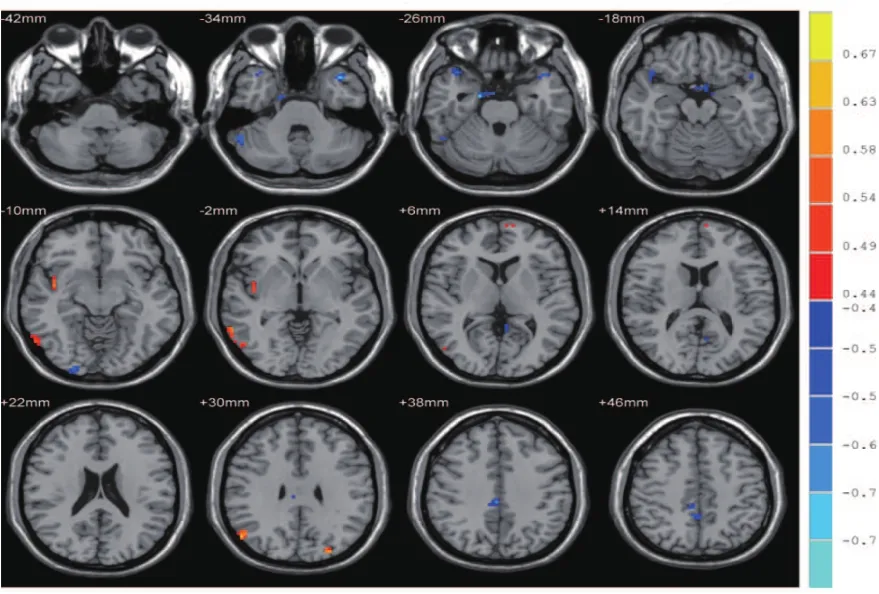
图1 EOD组脑自发低频振幅活动与HAMD-17评分相关性
两组比较差异有统计学意义(AlphaSim校正,P<0.05,cluster size>378 mm3,蒙特卡罗校正),坐标轴为定位该脑区的空间位置。见表1。
2.2 EOD组脑自发比率低频振幅活动与HAMD-17评分的相关性比较
EOD患者的右侧岛叶、左侧扣带回、右侧扣带回、左侧眶部额中回、左侧额中回的fALFF值随着HAMD-17评分增加而逐渐增强,在右侧距状裂、右侧舌回、右侧梭状回、右侧缘上回区域随着HAMD-17评分增加而逐渐减弱,差异有统计学意义(AlphaSim校正,P<0.05,cluster size>405 mm3,蒙特卡罗校正),见表2,如图2所示。

图2 EOD组脑自发比率低频振幅活动与HAMD-17评分相关性
3 讨论
静息态功能MRI研究目前已被大量应用在神经精神类疾病中,研究表明,抑郁症存在脑结构及功能异常[13]。低频振幅作为脑区自发活动的指标,反映了局部脑区基于血氧水平信号相对于基线的波动变化幅度,该指标不依赖外在信息,能敏感反应脑区活动。而HAMD-17的分数高低能表明患者抑郁的严重程度。本研究联合应用低频振幅与比率低频振幅的方法,探索异常脑区与早发抑郁症患者疾病严重程度的关系,其结果存在重合,也存在部分不一致,因此有必要进行相关探讨。本研究中,在扣带回、岛叶、枕上回及额中回、背外侧额上回等前额叶区域,随着疾病严重程度的增强,该区域的脑自发活动亦增高。扣带回是边缘系统的组成部分,边缘系统和抑郁症发生存在相关。抑郁症患者的前扣带回背侧以及背外侧前额叶的活动较正常健康对照组明显减低,重度抑郁发作期患者的扣带回功能被过分激动增强,老年抑郁患者的扣带回功能较正常健康对照组明显降低[14-16]。上述研究均表明,扣带回参与抑郁症的发病,同样,扣带回自发活动的增强是早发性抑郁的标志之一。岛叶在维持人体自主神经功能方面存在重要作用,如控制运动,维持内环境平衡以及感觉意识方面。岛叶自发活动增强可以解释早发抑郁症患者的躯体焦虑症状以及自主神经功能紊乱等现象。有研究表明,首发抑郁症患者岛叶的ALFF值较正常对照组脑区明显升高,其可能与抑郁症患者的激越攻击行为相关[17]。

表2 EOD组病例脑自发比率低频振幅活动与HAMD-17评分的相关性
枕叶区域的功能异常是抑郁症发生的可能机制[18]。Zhang等[19]研究表明,首发抑郁患者的枕叶区域,较健康对照组的节点度降低;同样有研究[20]表明,抑郁症患者的枕上回及额中回的脑网络模块较健康对照组存在显著下降,均提示枕叶功能受损与患者的抑郁程度相关,同样枕叶功能异常可能是早发抑郁症存在的发病机制。额上回、背外侧额上回及额中回均为前额叶的重要组成部分,背外侧额上回是与人类情感和认知功能密切相关脑区,既往研究表明,首发抑郁症组额中回和背外侧额上回ALFF值明显降低[21-22]。Chen等[23]研究表明,双相抑郁患者中背外侧额上回的节点介数中心度属性值较对照组下降,提示该脑区在大脑信息传导活动中的重要性发生下降。本研究中早发抑郁患者病情越重,其背外侧额上回的自发活动越强,其可能与早发抑郁患者代偿性提高该脑区活动相关,需进一步探索研究。额中回可能在抑郁症的额叶边缘系统的病理模式中具有作用[24]。有研究表明,抑郁症患者左侧额中回及右侧额上、中回的灌注减低,提示前额叶可能是抑郁症患者首先受累脑区,同时也表明抑郁症患者的代谢异常和脑血流改变并不同步,前额叶发生的代谢异常极有可能早于血流灌注改变,其原因可能与抑郁症分子生物学改变有关[25]。不同年龄起病的抑郁症患者额中回和右侧小脑灰质体积差异存在统计学意义,不同年龄发病的抑郁症患者可能具有不同的发病机制[26]。本研究中早发抑郁患者的前额叶同样存在明显受损,支持以往研究,表明在疾病的初期,患者的前额叶可能就已经发生受损。
本研究中,相关脑区与疾病的严重程度呈负相关。有研究报道,抑郁症患者的左侧颞中回存在异常的自发神经活动[27-29]。这与本研究结果一致,表明抑郁症患者颞叶皮质功能的减低可能与抑郁严重程度相关,但由于该脑区的相关研究较少,其脑区具体作用和是否均有生物学意义需进一步研究。舌回与海马存在相应连接,舌回的主要功能是参与视觉中的记忆加工及信息处理,在视觉感应与内省间刺激的信息整合中提供相应功能。既往对该区域的研究不多,抑郁症患者右侧舌回的葡萄糖摄取低于正常人,提示抑郁症的发病机制可能与该区域的代谢异常相关[29]。海马、海马旁回及杏仁核是人类记忆、学习功能的中枢。有研究提示,右侧海马旁回功能连接与抑郁程度呈显著的负相关,且失眠会使海马、海马旁回及杏仁核等区域受损,将患者暴露于过度应急状态,导致记忆、执行能力及焦虑等认知功能损害[30]。这与本研究的结果一致,这也提示早发抑郁患者同样存在海马区域的损伤。在静息态中,梭状回、颞中回、顶下小叶等脑区异常激活;这些异常脑区相互作用,从而完成负性情绪的加工,使抑郁症患者出现自我过度关注和负性认知偏向[31-32]。早发抑郁患者的负性情绪体验,可能与此机制相关。
本研究应用两项算法计算早发抑郁症的异常脑区与疾病程度的相关性,且两项指标的结果均存在一致性,验证了早发抑郁是抑郁症的一种亚型假说,并揭示了早发抑郁症的某些受损脑区可能与疾病严重程度有关,为进一步探索早发抑郁症提供了研究方向。同时,两组算法存在少量不一致,可能与样本量少,未考虑药物因素及复发因素等有关,这也为将来进一步探索该疾病的发病机制指明了研究方向。
[1]沈渔邨.精神病学[M].5版.北京:人民卫生出版社,2010.
[2]Yao Z,Wang L,Lu Q,et al.Regional homogeneity in depression and its relationship with separate depressive symptom clusters:a resting-state fMRI study[J].J Affect Disord,2009,115(3):430-438.
[3]Zisook S,Lesser I,Stewart JW.Effect of age at onset on the course of major depressive disorder[J].Am J Psychiatry,2007,164(10):1539-1546.
[4]Gollan J,Raffety B,Gortner E.Course profiles of early and adult-onset depression[J].J Affect Disord,2005,86(1):81-86.
[5]Guo WB,Liu F,Xue ZM,et al.Alterations of the amplitude of low-frequency fluctuations in treatment-resistant and treatment-response depression:A resting-state fMRI study[J].Prog Neuropsychopharmacol Biol Psychiat ry,2012,37(1):153-160.
[6]Yan R,Yan ZJ,Tang H,et al.The difference of fractional amplitude of low frequency fluctuation between first-episode and recurrent depressed patients: a resting-state functional magnetic resonance imaging study[J].J Clin Psychiatry,2013,23(3):145-148.
[7]Guo W,Liu F,Xue Z,et al.Decreased interhemispheric coordination in treatmentresistant depression:a resting-state fMRI study[J].Plos One,2013,8(8):e71368.
[8]Saxena S,Saraceno B.The ICD-10 classification of mental and behavioural disorders[M].Journal of Data Acquisition and Processing:WHO,1993.
[9]汤毓华.汉密尔顿抑郁量表[J].中国心理卫生杂志,1999,13(增刊):220-223.
[10]Biswal B,Yetkin FZ,Haughton VM,et al.Functional connectivity in the motor cortex of resting human brain using echo-planar MRI[J].Magn Reson Med,1995,34(4):537-541.
[11]Zang YF,He Y,Zhu CZ,et al.Altered baseline brain activity in children with ADHD revealed by resting-state functional MRI[J].Brain Dev,2007,29(2):83-91.
[12]Zou QH,Zhu CZ,Yang Y,et al.An improved approach to detection of amplitude of lowfrequency fluctuation(ALFF)for restingstate fMRI:Fractional ALFF[J].J Neurosci Methods,2008,172(1):137-141.
[13]郭宗君,刘世恩,高振波,等.应用神经决策学方法探讨精神心理相关疾病发病机制的思考[J].中华诊断学电子杂志,2015,3(2):122-127.
[14]张庆娥,王丽,李科,等.基于相干局部一致性方法的抑郁症静息态脑功能研究[J].中华精神科杂志,2014,47(1):1-6.
[15]Lisiecka D,Carballedo A,Fagan AJ,et al.P02-53-Overactivation of the middle cingulate cortex and the caudate nucleus as neural correlates of the familial liability to major depressiive disorder[J].Eur Psychiatry,2011,26(11):648-652.
[16]Andreescu C,Tudorascu DL,Butters MA,et al.Resting state functional connectivity and treatment response in late-life depression[J].Psychiatry Res,2013,214(3):313-321.
[17]Yong N,Wu F,Hu H,et al.Resting-state fMRI study on alteration of amplitude of low frequency fluctuation and its relationship with aggressive behaviors in first-episode major depressive disorder patients[J].Acad J Second Mil Med Univers,2015,36(3):261-267.
[18]Haldane M,Cunningham G,Androutsos C,et al.Structural brain correlates of response inhibition in Bipolar Disorder I[J].J Psychopharmacol,2008,22(2):138-143.
[19]Zhang J,Wang J,Wu Q,et al.Disrupted brain connectivity networks in drug-naive,firstepisode major depressive disorder[J].Biol Psychiatry,2011,70(4):334-342.
[20]陈超,郝熠,王丽,等.抑郁症首次发病未治疗患者脑网络模块化研究[J].中华精神科杂志,2016,49(4):210-215.
[21]Matsubara T,Matsuo K,Nakashima M,et al.Prefrontal activation in response to emotional words in patients with bipolar disorder and major depressive disorder[J].Neuroimage,2014,85(Pt 1):489-497.
[22]Qiu T,Dai R,Liu Y.Amplitude of lowfrequency fluctuation in first-episode depressed patients on resting-state functional magnetic resonance imaging[J].J Data Acquisit Process,2015,30(5):940-947.
[23]陈建淮,姚志剑,赵可,等.双相抑郁患者脑白质网络介数中心度属性研究[J].中华行为医学与脑科学杂志,2015,24(8):694的-697.
[24]Abe O,Yamasue H,Kasai K,et al.Voxel-based analyses of gray/white matter volume and diffusion tensor data in major depression[J].Psychiatry Res,2010,181(1):64-70.
[25]Fu C,Zhang H,Shi D,et al.Correlation of region blood perfusion and glucose metabolism of the prefrontal lobes with clinical features in patients with first-episode depression[J].Zhonghua Yi Xue Za Zhi,2015,95(37):3017.
[26]沈宗霖,程宇琪,李凌江,等.不同年龄首次抑郁发作的成年抑郁症患者脑灰质体积研究[J].中华精神科杂志,2017,50(3):193-200.
[27]Xu J,Rees G,Yin X,et a1.Spontaneous neuronal activity predicts intersubject variations in executive control of attention[J].Neumscience,2014,263:181-192.
[28]Li D,Huang X,Wu Q,et al.Brain functions in major depressive disorder:a resting-state functional magnetic resonance imaging study[J].Sheng Wu Yi Xue Gong Cheng Xue Za Zhi,2010,27(1):16-19.
[29]周群,朱彦,李月峰.PET/CT观察首发与复发抑郁症患者神经细胞18F-FDG摄取代谢的差异[J].中华神经医学杂志,2017,16(5):498-502.
[30]王恩锋,刘立亚,张红菊,等.伴有抑郁症状原发性失眠患者静息态磁共振脑默认网络评价[J].中华神经科杂志,2015,48(11):1000-1006.
[31]Bourke C,Douglas K,Porter R.Processing of facial emotion expression in major depression:a review[J].Aust N Z J Psychiatry,2010,44(8):681-696.
[32]Wang L,Hermens DF,Hickie IB,et al.A systematic review of resting-state functional-MRI studies in major depression[J].J Affect Disord,2012,142(1-3):6-12.

