次氯酸钠对水中腐殖酸结构及光学特性的影响
任 东,王 涛,陈 芳,王 彬,黎云祥 * (.西华师范大学,环境科学与工程学院,四川 南充 637009;.西南科技大学,环境与资源学院,四川 绵阳 600)
近年来,随社会经济快速发展和城镇化水平不断提高,排入环境水体的污水处理厂出水逐年增多,并且约有四分之一的原水得不到有效稀释[1].相应地,随出水进入环境水体的溶解性有机质(DOM)成为了受纳水体中 DOM 的主要组成部分[2].尽管污水处理厂出水 DOM 通常是一些生物难降解有机物,如腐殖性 DOM 等,但该类DOM 仍具有较高的光学活性和化学活性[3-4],能显著改变环境水体中各种有机和无机污染物的迁移、转化、生物有效性以及生态毒性等[5-7].例如,污水处理厂出水 DOM 能通过光化学反应生成多种活性氧物质[8]、控制Cu2+和Ag+的形态及蚤类生长毒性[9-10]、促进或抑制有机污染物光降解[11].
前期研究表明,污水处理厂出水 DOM 的环境行为与其自身的疏水性、极性和分子量等理化性质密切相关[7-10].然而,与天然有机质(主要来自于动植物残体腐解过程)不同,污水处理厂出水DOM的结构和性质会受到各污水处理工艺的控制,如高级氧化等工艺[11-12].薛爽等[13]对A/O、曝气生物滤池和A2/O工艺影响DOM理化性质的研究表明,A2/O会显著增大DOM中疏水性和过渡亲水性组分的芳香性,而曝气生物滤池还会显著增强亲水性 DOM组分的芳香性.无独有偶,李海波等采用荧光光谱技术对不同污水处理工艺改变 DOM 组成进行研究时也发现,不同处理工艺对 DOM 中不同组分的改变情况不一样[14].其中,非曝气处理能高效去除类蛋白组分,而好氧工艺对 DOM 中的类蛋白和类富里酸组分均具有较高的去除效率.针对高级氧化处理工艺改变DOM 组成和性质的研究也在开展,但主要集中于臭氧氧化工艺[15],而有关其他氧化处理过程影响DOM结构和性质的研究并未多见.
在众多氧化消毒药剂中,NaOCl因具有较强氧化性、廉价易得、便于储藏运输和持续消毒能力等优点,常被广泛用作氯化消毒的活性组分.然而,NaOCl氧化作用对DOM形态、结构及理化特性的改变目前仍不为我们所知.因此,本研究拟采用腐殖酸作为污水处理厂出水 DOM 的代表物,采用元素分析和光谱分析等多元化表征技术探讨NaOCl对该类DOM的组成、结构和光学特性的影响及其规律,以期丰富污水氧化处理工艺对 DOM 结构和性质影响的研究,并为污水处理厂出水 DOM 的环境行为及效应评估提供必要的基础信息.
1 材料与方法
1.1 实验材料
腐殖酸(灰分<0.5%);NaOCl(活性氯含量为6.0wt%)、NaOH和HCl购买自国药集团化学试剂有限公司;色谱纯CH3OH和CH3CN、三氟乙酸(TFA)、呋喃甲醇(FFA)、对苯二甲酸(TPA)和2,4,6-三甲基苯酚(TMP)均购自 Sigma-Aldrich,纯度均>97%.实验用水为超纯水(>18.2MΩ·cm).
1.2 实验方法
1.2.1 腐殖酸及其溶液制备 按前期研究已建立的方法[7],从升钟湖底泥(采集于2017年7月)中提取HA,并制备其工作溶液.
1.2.2 腐殖酸氧化实验 向 TOC浓度为500.0mg/L的HA溶液中加入NaOCl,调节各反应体系体积为40mL,NaOCl与HA的浓度比分别为0,2,5,10,15,20.0µmol/mg.调节各反应体系 pH=7.5±0.2后于25℃下反应24h,终止反应,测定各溶液TOC含量,并取其适量真空冷冻干燥后避光保存.获得的 HA分别标记为 HA0、HA2、HA5、HA10、HA15和HA20.为得到足量的HA并确保实验操作的准确性,重复上述实验2次.
1.2.3 腐殖酸光敏化性能实验 取各 HA溶液配制含TPA、FFA和TMP的溶液30.0mL,各物质浓度分别为5.0mg/L、1.0mmol/L、30.0µmol/L和 100.0µmol/L,调节各溶液 pH=7.5±0.2后进行光照实验.于设定时刻下取样 0.5mL,定量分析2-hTPA的生成量、FFA和TMP的减少量,测定结果分别用于描述 HA生成 HO⋅、1O2和3HA*的活性.其中,光照实验于 XPA-7模拟太阳光化学反应仪(λ>290nm)上进行,实验过程中控制各反应体系温度为(25±0.5)℃,并与空气相通.于上述条件下重复各实验2次以上.
1.3 分析方法
1.3.1 腐殖酸结构组成特征表征 采用前期研究已建立的方法[7],在有机元素分析仪(Elementar Vario)上完成各HA元素组成表征.HA的分子量采用高压排阻色谱分析:配制浓度为50.0mg/L的HA溶液,取各HA溶液0.5mL于高效液相色谱仪(Agilent 1260)上进行分析,测试参数如下:色谱柱为 YMC60(300mm×60mm)硅胶柱,检测波长为260nm,流动相由 KH2PO4-K2HPO4-KCl三元体系组成,流速为0.8mL/min.
不同氧化程度 HA官能团及结构特征采用傅里叶变换红外光谱表征.首先,将干燥的HA与120℃下脱水24h的KBr粉末按1:150(w/w)混匀,于玛瑙研钵中研至细粉;然后,将样品于 150Kpa下压制样片约90s;最后,将样片于Varian 640-IR光谱仪上测试.光谱测定时以KBr样片扣除背景,扫描波数范围为 4000~400cm−1(精度<0.1cm−1), 分辨率为4cm−1,扫描次数为24次.

表1 紫外-可见光谱特征指数计算方法及指示意义Table 1 Calculation methods and significance of UV-vis spectral characteristic index
1.3.2 腐殖酸光谱特征表征 按前期建立的方法[7],于 UV-vis分光光度计(SHIMADZU UV-2600)上测试各HA的UV-vis吸光特性,并按表1计算各光谱特征指数.HA的三维荧光光谱采用Hitachi F-7000光谱仪测试,具体参数设置如下:HA浓度为20.0mg/L,pH=7.5±0.2,激发光源为150W 氙灯,激发光和发射光的狭缝带通均为5nm,扫描速度为 2400nm/min,激发波长(λEx)=200~600nm 和发射波长(λEm)=200~700nm.荧光特征指数(FI)和腐殖化指数(HI)分别由式(1)和(2)计算获得.
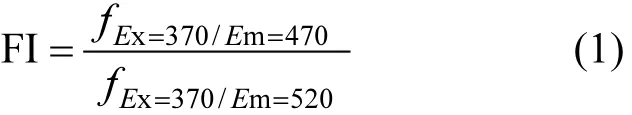
式中:FI代表荧光指数;fEx=370/Em=470和fEx=370/Em=520分别为370nm激发光下,HA在470nm和520nm处的发射光强度.

254nm 激发下 435~480nm 内的发射光强度;为 254nm 激 发 下 300~345nm内的发射光强度.
1.3.3 高效液相色谱定量分析 于高效液相色谱仪上定量分析2-hTPA、FFA和TMP,分析方法如表 2所示.其中,色谱柱为 CORTECSTM-C18(2.7µm,4.6mm×100mm)反相柱,柱温为 25℃.
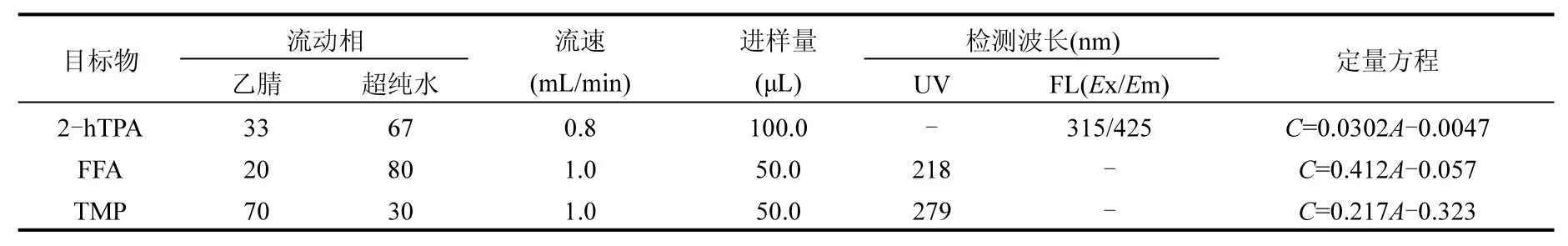
表2 2-hTPA、FFA和TMP的高效液相色谱检测方法Table 2 High performance liquid chromatography detection methods for 2-hTPA, FFA and TMP
2 结果与讨论
2.1 腐殖酸结构组成变化
2.1.1 分子量变化 随NaOCl剂量增加,腐殖酸排阻色谱图中6.9min左右的吸收峰迅速消失,并且其最大吸收峰的出峰时间不断延后;与HA0相比,HA20的出峰时间延迟了约 1.2min(图 1).因此,NaOCl氧化作用显著减小了HA的分子量,这与Cai等发现化学氧化剂能将大分子HA分解成小分子组分相一致[17].同时,HA0排阻色谱图中11.3min左右的吸收峰也不断减小,但该吸收峰的变化可能是由小分子组分矿化引起,这与 HA溶液TOC随NaOCl剂量增大而线性减小的变化趋势([TOC]=−7.165[NaOCl]+500,r2=0.966)相吻合.总的来讲,随NaOCl剂量增加,HA排阻色谱的最大吸收峰显著增高变窄,即NaOCl氧化使HA分子量分布更为集中.这可能与NaOCl逐级氧化降解HA相关,即小分子易氧化组分(如小分子羧酸等)可直接被矿化成CO2,而大分子难氧化组分须被分解成小分子后才能被矿化去除.
2.1.2 元素组成变化 不同氧化程度的 HA均主要由 C、O、H、N、S元素和少量灰分组成,其中C和O元素的含量最高(表3),这与滇池、太湖等湖泊表层沉积物中 HA的元素组成和分布相一致[18-19],也与Bittar等对藻源DOM元素组成表征结果相似[20].然而,与 Suwannee河 HA的元素组成相比[21],研究所用的 HA则表现出更高的O含量和更低的C含量.因此,实验所采用的HA属内源“年轻”型有机质.

图1 原始及氧化腐殖酸的高压排阻色谱Fig.1 High-pressure exclusion chromatography of the pristine and oxidized HA
由表3可知,随氧化程度增加,HA的C元素含量先减少后增加,与O元素含量变化趋势恰好相反,这与HA的氧化和矿化过程密切相关.Kang等指出,H/C和(O+N)/C能分别指示HA的芳香结构丰度和极性大小,芳香结构含量随H/C值增大而减小,极性随(O+N)/C值增大而增大[22].因此,在NaOCl氧化分解HA过程中,HA的芳香性先减小后增大,而极性则先增大后减小,并且含氧组分在HA极性控制中起着主导作用.

表3 原始及氧化HA的元素组成及原子比分析Table 3 Elemental composion and atom ratios analysis of the pristine and oxidized HA
2.1.3 结构变化 不同氧化程度 HA的红外光谱表征结果如图2所示.HA0在3396cm−1附近表现出的强烈吸收峰源于醇羟基、羧基和酚羟基中O—H,以及少量胺基和酰胺基中N—H的伸缩振动;在 2935和 2853cm−1处的吸收峰主要是由—CH2—结构中的 C—H 对称和非对称振动引起的.1647和 1535cm−1分别显示了芳香族不饱和C=C骨架,以及酮类、醌类和酰胺类的C=O结构.另外,HA0在 1049cm−1处还表现出了芳香族醚和多糖类物质中 C—O结构的低强度伸缩振动吸收峰.这些特征吸收峰均与 HA本身是一种异质性混合物相吻合[23],也与文献报道的HA结构特征相一致[24-25].因此,本研究提取的有机质确实为腐殖酸.此外,由图 2还可以看出,随 NaOCl剂量增加,HA的—OH结构和脂肪性结构均逐渐减少,这主要是由于这两种结构相对不稳定,会被NaOCl直接氧化去除;HA的C=O和C=C结构则在氧化反应过程中呈现出先增加后减少的变化趋势,这与 HA中稳定性组分须先被氧化后才能被去除这一过程相关.

图2 原始及氧化HA的傅里叶变换红外吸收光谱Fig.2 Fourier transform infrared spectra of the pristine and oxidized HA
2.2 腐殖酸抗氧化性变化
如图3a所示,随NaOCl剂量增加,HA抗氧化能力呈非线性减小,而HA含量则呈线性减小.一方面,HA是异质性混合物,其中的抗氧化结构分布不均;另一方面,HA的部分抗氧化性主要源于酚和半醌类物质[26-27],这些物质在被彻底矿化前须经过氧化这一过程.因此,在 NaOCl氧化过程中,HA的抗氧化能力改变与其含量变化呈非线性相关(r=0.9678,P<0.05).为了探明 HA 抗氧化性改变的原因,进一步分析了氧化反应过程中单位质量 HA中羧基和酚羟基含量的变化,结果如图3b所示.未氧化HA的—COOH和—OHpH含量分别为4.37mmol/g和0.92mmol/g;随HA氧化程度加深,—COOH 和—OHpH含量均不断增加,这与李静等在研究臭氧氧化水中黄腐酸时所发现的规律相似[15].值得注意的是,在氧化反应过程中,—OHpH含量变化趋势与 HA抗氧化性变化趋势相反.这意味着,HA抗氧化性减小还可能与其他还原性组分的减少有关.

图3 NaOCl氧化作用对HA浓度和没食子酸当量浓度(a),以及羧基和酚羟基含量的影响(b)Fig.3 Effects of NaOCl oxidation on the concentration,gallic acid equivalent concentration (a), carboxyl and phenolic hydroxyl content (b) of the HA
2.3 腐殖酸光学特性变化
2.3.1 UV-vis吸光特性 研究发现,不同氧化程度的HA在220~700nm内均表现为无特异性吸收,吸光能力均随波长增大呈指数模式衰减(图 4),这与前期报道的 DOM 吸光特性相似[7,20,28].由此可见,单纯的UV-vis吸收光谱不能辨别各 HA中光吸收结构的差异,因此本文采用二阶导数分光光度法对不同氧化程度 HA的UV-vis吸收光谱进行了分析,结果如图 4所示.前期研究指出,在 UV-vis吸收光谱中,HA 在265~295nm 范围内的吸光特性与带羟基、羰基和羧基等官能团的芳香结构相关;380~420nm 范围内的吸光特性与其缔合芳香结构密切相关[28-29].因此,NaOCl氧化致使HA中芳香结构减少是其UV-vis吸光能力衰减的重要原因之一.
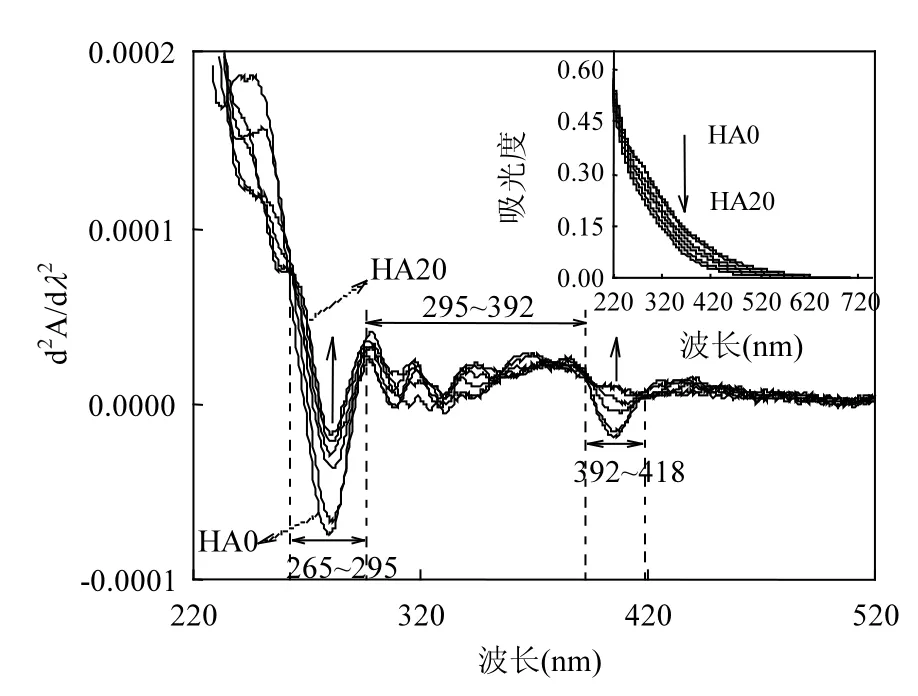
图4 不同HA的UV-vis吸收光谱及其二阶吸收光谱Fig.4 UV-vis absorption spectra and its second derivative form of the pristine and oxidized HA
为确定 HA结构和组成与其 UV-vis吸光特性变化间的相关性,研究进一步计算了各UV-vis吸收光谱特征值,结果如表 4所示.其中,SUVA254由 8.728下降到了 6.731,而 S275~295和 S350~400则分别增大了 45%和 73%.由这些特征值的指示意义(表 1)可知,NaOCl氧化减小了HA的分子量和芳香度.E2/E3增大和SR减小的变化趋势则分别指示着HA的分子量减小和电子复合结构受损,这与不同氧化程度HA分子量检测结果相一致,也是其吸光能力逐渐衰减的另一重要原因.
2.3.2 荧光特性 不同 HA的三维荧光表征结果如图5所示.HA0在 λEx/λEm=280nm/520nm 附近表现出集中的荧光峰,这与文献报道的类腐殖酸荧光响应范围一致[30].然而,随 NaOCl剂量增加,HA的荧光响应不断向类富里酸荧光响应区(λEx/λEm=240~270nm/370~500nm)移 动[14].同 时 ,部分大分子HA被分解成小分子物质,HA分子及其团聚体内部的相互作用减弱[31].因此,HA的荧光响应随 NaOCl剂量增加逐渐增强.与HA0相比,HA20的荧光指数(FI)增大了约 56%,但其腐殖化指数(HI)并未发生改变(表3),这与NaOCl的无选择性氧化作用相关.
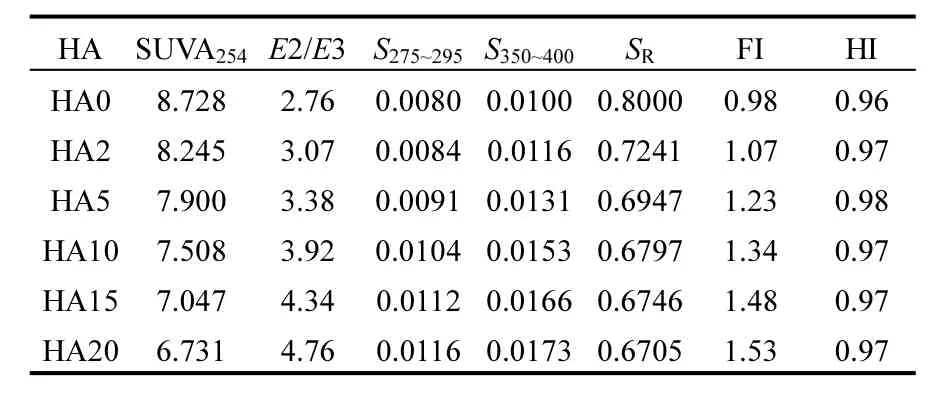
表4 各腐殖酸的紫外-可见和荧光光谱特征指数Table 4 Characteristic index of UV-vis and fluorescent spectra for the different HA
2.4 光敏化特性
前期研究指出,HA的光敏化特性对许多污染物的环境转化具有重要诱导作用[7,22].其中,HA光化学反应生成HO⋅、1O2和3HA*是其诱导污染物光化学转化的主要原因[5,19,32].因此,本文对不同氧化程度 HA(5.0mg/L)作用下,TPA(HO⋅捕捉剂)、FFA(1O2捕捉剂)和 TMP(3HA*捕捉剂)的光降解动力学进行了探讨(图 6a).随 HA氧化程度加深,TPA、FFA和 TMP光降解速率不断增加,即当 NaOCl与 HA的浓度比小于 20.0µmol/mg时,HA的光敏化活性因其部分氧化而逐渐增大.与 HA0溶液中各捕捉剂光降解速率相比,HA20溶液中 2-hTPA的生成速率提高了约 57%,FFA和TMP的降解速率分别提高了约40%和64%.一方面,NaOCl投加量较小,且有足够的反应时间,实验结束时并未检测到残留的次氯酸根;另一方面,不同浓度NaCl对HA0溶液中TPA、FFA和TMP光降解速率无影响(图 6b).因此,TPA、FFA和TMP光降解速率变化确实是由HA组成、结构及光学特性变化引起的,而非离子强度和氯离子作用所致.根据NaOCl改变HA组成、结构和光学特性的研究结果,可将 HA表观光敏化活性增强的原因归纳为以下几个方面:(1)HA分子量减小并分布均匀化,导致 HA分子及其团聚体内部的相互作用减弱,入射光量子利用率提高;(2)HA的抗氧化结构被NaOCl氧化作用破坏,其对污染物光降解过程中产生的氧化性中间体的还原作用减弱;(3)HA组成中的活性物质淬灭性组分减少,活性物质寿命和稳态浓度增加,从而增大了HA的表观光敏化活性.
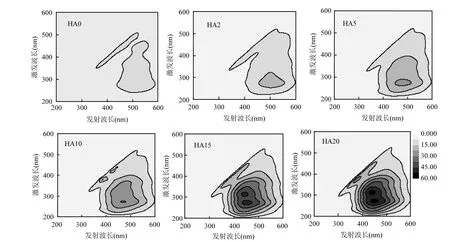
图5 不同氧化程度HA的三维荧光光谱Fig.5 3-Dimensional fluorescence spectra of HA with different oxidation degree
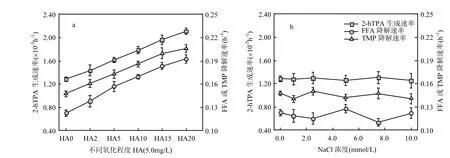
图6 光照下不同氧化程度HA溶液(a)和不同NaCl浓度HA0溶液(b)中2-hTPA生成速率及FFA和TMP降解速率Fig.6 Formation rate of 2-hTPA and degradation rate of FFA and TMP in the oxidized HA solutions (a) and HA0solutions with different NaCl concentration (b) under irradiation
3 结论
3.1 在弱碱性水环境条件下,NaOCl不仅能氧化去除部分 HA中小分子组分,而且能有效减小HA的分子量,使其分子量分布变得更为集中.3.2 NaOCl氧化作用使HA的组成、元素分布及分子结构都发生了显著变化.其中,脂肪酸、芳香酸和醇类等含氧组分随 HA氧化程度加深先增加后减少,从而使得 HA的极性呈现出先增大后减小的变化趋势.
3.3 当 NaOCl与 HA的浓度比由 0逐渐增至20.0µmol/mg时,HA的 HI值未发生变化,即 HA的腐殖化特性不受 NaOCl氧化作用的影响.但是,NaOCl的氧化作用能显著减小HA的吸光能力、抗氧化能力和芳香度,并增大其荧光发光强度和表观光敏化活性,如增大HO•、1O2和3HA*的稳态浓度等.
[1]Brooks B W, Riley T M, Taylor R D. Water quality of effluent-dominated ecosystems: ecotoxicological, hydrological,and management considerations [J]. Hydrobiologia, 2006,556(1):365–379.
[2]虞敏达,何小松,檀文炳,等.城市纳污河流有色溶解有机物时空演变特征 [J]. 中国环境科学, 2016,36(1):133–142.
[3]Dong M M, Rosario-Ortiz F L. Photochemical formation of hydroxyl radical from effluent organic matter [J]. Environmental Science & Technology, 2012,46(7):3788–3794.
[4]Bodhipaksha L C, Sharpless C M, Chin Y P, et al. Role of effluent organic matter in the photochemical degradation of compounds of wastewater origin [J]. Water Research, 2017,110:170–179.
[5]Shon H, Vigneswaran S, Snyder S A. Effluent organic matter(EfOM) in wastewater: constituents, effects, and treatment [J].Critical Reviews in Environmental Science and Technology,2006,36(4):327–374.
[6]Bodhipaksha L C, Sharpless C M, Chin Y P, et al. Triplet photochemistry of effluent and natural organic matter in whole water and isolates from effluent-receiving rivers [J]. Environmental Science & Technology, 2015,49(6):3453-3463.
[7]任 东,杨小霞,马晓冬,等.DOM 结构特征及其对 17β-雌二醇光降解的影响 [J]. 中国环境科学, 2015,35(5):1375–1383.
[8]Zhang D, Yan S, Song W. Photochemically induced formation of reactive oxygen species (ROS) from effluent organic matter [J].Environmental Science & Technology, 2014,48(21):12645–12653.
[9]Gunsolus I L, Mousavi M P S, Hussein K, et al. Effects of humic and fulvic acids on silver nanoparticle stability, dissolution, and toxicity [J]. Environmental Science & Technology, 2015,49(13):8078–8086.
[10]龙良俊,王里奥,余纯丽,等.改性污泥腐殖酸的表征及其对 Cu2+的吸附特性 [J]. 中国环境科学, 2017,37(3):1016–1023.
[11]虞敏达,何小松,檀文炳,等.城市纳污河流有色溶解有机物时空演变特征 [J]. 中国环境科学, 2016,36(1):133–142.
[12]Mostafa S, Rosario-Ortiz F L. Singlet oxygen formation from wastewater organic matter [J]. Environmental science &technology, 2013,47(15):8179–8186.
[13]薛 爽,金乌吉斯古楞,陈忠林,等.冬季不同污水处理工艺对溶解性有机物的去除 [J]. 中国环境科学, 2015,35(2):410–419.
[14]李海波,孙 晨,刘晓玲,等.三维荧光光谱解析城市污水有机物的去除特征 [J]. 中国环境科学, 2016,36(8):2371–2379.
[15]李 静,曲久辉,刘会娟,等.臭氧氧化水中黄腐酸过程中有机物的形态变化 [J]. 中国科学(B辑:化学), 2008,38(1):67–71.
[16]Helms J R, Stubbins A, Ritchie J D, et al. Absorption spectral slopes and slope ratios as indicators of molecular weight, source,and photobleaching of chromophoric dissolved organic matter [J].Limnology and Oceanography, 2008,53(3):955–969.
[17]Cai W, Liu J, Zhang X, et al. Generation of dissolved organic matter and byproducts from activated sludge during contact with sodium hypochlorite and its implications to on-line chemical cleaning in MBR [J]. Water Research, 2016,104:44–52.
[18]林 樱,吴丰昌,白英臣,等.我国土壤和沉积物中富里酸标准样品的提取和表征 [J]. 环境科学研究, 2011,24(10):1142–1148.
[19]Ren D, Huang B, Yang B, et al. Mitigating 17α-ethynylestradiol water contamination through binding and photosensitization by dissolved humic substances [J]. Journal of Hazardous Materials,2017,327:197–205.
[20]Bittar T B, Stubbins A, Vieira A A, et al. Characterization and photodegradation of dissolved organic matter (DOM) from a tropical lake and its dominant primary producer, the cyanobacteria Microcystis aeruginosa [J]. Marine Chemistry,2015,177:205–217.
[21]Batista A P S, Teixeira A C S, Cooper W J, et al. Correlating the chemical and spectroscopic characteristics of natural organic matter with the photodegradation of sulfamerazine [J]. Water Research, 2016,93:20–29.
[22]Kang S, Xing B. Phenanthrene sorption to sequentially extracted soil humic acids and humins [J]. Environmental Science &Technology, 2005,39(1):134–140.
[23]Ren D, Huang B, Xiong D, et al. Photodegradation of 17αethynylestradiol in dissolved humic substances solution: Kinetics,mechanism and estrogenicity variation [J]. Journal of Environmental Sciences, 2017,54:196–205.
[24]Polak J, Bartoszek M, Żądło M, et al. The spectroscopic studies of humic acid extracted from sediment collected at different seasons [J]. Chemosphere, 2011,84(11):1548–1555.
[25]Traversa A, D’orazio V, Mezzapesa G N, et al. Chemical and spectroscopic characteristics of humic acids and dissolved organic matter along two Alfisol profiles [J]. Chemosphere, 2014,111:184–194.
[26]Aeschbacher M, Graf C, Schwarzenbach R P, et al. Antioxidant properties of humic substances [J]. Environmental Science &Technology, 2012,46(9):4916–4925.
[27]Walpen N, Schroth M H, Sander M. Quantification of phenolic antioxidant moieties in dissolved organic matter by flowinjection analysis with electrochemical detection [J].Environmental Science & Technology, 2016,50(12):6423–6432.
[28]江 韬,梁 俭,张慕雪,等.三峡库区消落带水体CDOM中电荷转移配合物对其紫外-可见吸收光谱的影响 [J]. 环境科学,2016,37(2):580–587.
[29]Chen J, Gu B, Leboeuf E J, et al. Spectroscopic characterization of the structural and functional properties of natural organic matter fractions [J]. Chemosphere, 2002,48(1):59–68.
[30]Jacquin C, Lesage G, Traber J, et al. Three-dimensional excitation and emission matrix fluorescence (3DEEM) for quick and pseudo-quantitative determination of protein- and humiclike substances in full-scale membrane bioreactor (MBR) [J].Water Research, 2017,118:82–92.
[31]Ren D, Huang B, Xiong D, et al. Photodegradation of 17α-ethynylestradiol in dissolved humic substances solution:Kinetics, mechanism and estrogenicity variation [J]. Journal of Environmental Sciences, 2017,54:196–205.
[32]Klapstein S J, Ziegler S E, Risk D A, et al. Quantifying the effects of photoreactive dissolved organic matter on methylmercury photodemethylation rates in freshwaters [J]. Environmental Toxicology and Chemistry, 2017,36(6):1493–1502.

