兽用抗生素磺胺二甲嘧啶对麦田NH3挥发的影响
张敬沙,庞炳坤,吴 杰,李志琳,蒋静艳 (南京农业大学资源与环境科学学院,江苏 南京 210095)
NH3是土壤氮素循环的产物,氮肥施入土壤后,有机氮经微生物矿化作用转化成无机氮,然后经一系列复杂的动力学过程,土壤中的铵氮最终以氨气形式从土壤表层扩散到大气中[1].NH3挥发是农田氮素损失的一个重要途径,也是大气中NH3的重要来源之一[2].NH3挥发会导致氮肥利用率下降,且大气中的NH3可随干湿沉降重新回到地表,大量氮素进入地表水体或土壤后可造成水体富营养化和土壤酸化等环境问题[3].NH3氧化或与OH自由基反应最终生成N2、N2O、NOx等含氮化合物[4],加剧全球变暖.最新的一项研究结果表明,相比SO2和NOx的释放,NH3挥发与空气中 PM2.5的时空变化之间有着更为密切的联系,NH3在 PM2.5污染的形成过程中扮演着重要角色[5].NH3挥发引起的环境问题不容忽视,减少NH3挥发的任务迫在眉睫.
我国是抗生素生产和使用大国,近年来,随着集约化畜牧业的发展,兽用抗生素被大规模使用[6].进入到动物体内的兽用抗生素大多不能被吸收,约有 60%~90%以兽药母体形式通过粪尿液排出,随粪便的施用进入到土壤,部分抗生素降解缓慢,导致土壤抗生素高残留[7-9].土壤抗生素残留会胁迫植物、微生物等代谢活动,进而对土壤氮循环产生影响[7,10-11].如 Ma等[12]研究结果表明较小剂量水平的磺胺间甲氧嘧啶就会对微生物群落及其代谢多样性产生较强的抑制作用.磺胺类药物残留对土壤呼吸也有着显著的影响[10],对土壤硝化与铵化有一定的促进作用[13]. Kotzerke等[7]的室内研究发现,随着猪粪处理中磺胺嘧啶浓度的增加,NH4+-N含量有显著增加的趋势,可能是高浓度磺胺嘧啶抑制了铵氧化古菌和铵氧化细菌的活性;此外,磺胺二甲嘧啶也可通过抑制反硝化细菌的增长,降低了河口、海岸沉积物中的反硝化速率,从而影响了沉积物中 NH4+-N/NO3--N 的比例[14].土壤NH4+-N为NH3挥发的底物,抗生素可通过影响土壤氮循环相关微生物活动,改变土壤 NH4+-N含量而最终影响到 NH3挥发.目前关于抗生素胁迫条件下土壤NH3挥发特征及其影响机制的研究鲜见报道.
磺胺类药物是兽药抗生素中使用最广泛的品种之一[15],我国磺胺类抗生素环境暴露浓度为100~46700µg/kg[16],有的农田土壤磺胺类抗生素含量范围高达 5.85~33.37mg/kg[17].一般猪粪中磺胺类抗生素的暴露浓度高于家禽粪便和牛粪[16].因此本文选用了磺胺类的抗生素磺胺二甲嘧啶,通过田间原位观测试验,分别以农家猪粪和常规复合肥为基肥作为对比,并根据土壤中磺胺类抗生素暴露浓度范围,设置了低、中、高(5,15,30mg/kg)3个不同浓度磺胺二甲嘧啶处理,探究在不同浓度抗生素胁迫条件下的 NH3挥发规律及其影响机制,以期了解兽用抗生素的环境污染生态效应,为正确估算农田NH3挥发总量、改善环境问题作技术支撑,同时为减少农田氮素损失提供科学的依据.
1 材料与方法
1.1 试验区概况
试验观测于2016年12月~2017年6月,在江苏省南京市江宁区淳化街道南京农业大学实验田(118°59′E,31°57′N)进行.该地区属于亚热带季风气候,年平均温度15.4°C,整个小麦生长季的降雨量为 557.8mm.土壤有机碳含量为 18.28g/kg,全氮为 1.45g/kg, pH值为 7.61,土壤容重为1.15g/cm3.
1.2 试验设计
本试验选择的小麦供试品种为扬麦 3号,供试抗生素为磺胺二甲嘧啶(SMZ).基肥分为常规复合肥和猪粪2种氮肥.复合肥的N:P2O5:K2O比例为 15:15:15,猪粪是经堆置的不含兽用抗生素的农户散养猪排泄物,堆置后的猪粪全氮为0.56%,全磷为 0.41%,全钾为 0.57%.试验共设 9个处理,分别为:不施肥不添加抗生素(CK);以复合肥为基肥,分别添加 0、5、15、30mg/kg土的磺胺二甲嘧啶(CF、CF+SMZ5、CF+SMZ15、CF+SMZ30);以猪粪为基肥,分别添加 0,5,15,30mg/kg土的磺胺二甲嘧啶(CM、CM+SMZ5、CM+SMZ15、CM+SMZ30).除 CK 外,所有处理追肥均为尿素.抗生素随基肥一同施入,追肥时不再添加抗生素.两种基肥处理分别模拟研究土壤已有抗生素残留常规施肥条件及抗生素随有机粪源进入土壤后的NH3挥发变化情况.
小麦于2016年12月9日播种,2017年6月2日收获.整个小麦生育期N:P2O5:K2O施肥比例为 2:1:1.所有施肥处理氮肥总量均为 200kgN/hm2,按基肥:追肥=1:1比例分别于2016年12月10日和2017年2月24日撒施.其中猪粪处理的磷钾肥以过磷酸钙(P2O5,12%)和氯化钾(K2O,60%)形态在施猪粪时进行补充.
试验田采用微区设计,微区面积为 3m×2m,每个处理设置3个重复,随机排列.各区之间设有80cm宽,30cm高的田埂,并用塑料薄膜覆盖,以防止水肥串流.除抗生素和施肥管理外,其他农田管理措施均与当地常规管理一致.
1.3 样品采集及测定方法
土壤NH3挥发的测定采用通气法[18].NH3挥发收集装置由高12cm,内径15cm的PVC管制成.采样时将PVC管插入土壤中2cm,分别将两块提前浸润过磷酸甘油溶液(5%磷酸+4%丙三醇)的海绵(直径16cm,厚度2cm)放入PVC管中.上层海绵与管顶部相平,吸收空气中的NH3,防止其进入装置,下层海绵距离土壤表面5cm,用于吸收土壤挥发的NH3,两块海绵之间的距离约为1cm.在每个微区随机放置 1个收集装置,于施肥后当天开始收集土壤 NH3挥发,一般捕集 6h后取样.取样时将收集装置下层海绵取出,并迅速装入塑料自封袋密封,同时将 PVC管随机更换位置,以便下次采样.施肥后一周每隔 2d采一次,之后每周收集2次,直至监测到的NH3挥发与CK无显著差异为止.将采集的海绵带回实验室,分别装入500mL塑料瓶中,加入 300mL 1.0mol/L的 KCl溶液,使海绵完全浸于其中,振荡 1h,过滤,用连续流动分析仪(型号:AA3,SEAL Analytical,产地:英国)测定浸取液中的 NH4+-N,根据测得的NH4+-N含量和采集装置的横截面积及每次连续采集的时间计算土壤的NH3-N挥发速率.
土壤NH3挥发速率计算公式为:
NH3挥发速率(kgN/(hm2⋅d))=(C⋅V)/(A⋅D) ⋅10-2
式中:C为每个捕获装置单次测得的 NH4+-N浓度, mgN/L;V为浸提液体积,L;A为PVC管横截面积,m2;D为每次采集时间,d.
NH3挥发累积量计算公式为:
M=Σ(F(N+1)+FN)×0.5×(t(N+1)-tN)
式中: M为NH3挥发累积量,kgN/hm2;F为NH3挥发速率,kgN/(hm2⋅d);N为采样次数;t为采样时间距初次采样的天数,d;
NH3挥发损失率(%)=(ET-ECK)/N×100
式中:ET为各施肥处理单位面积的 NH3挥发量,kgN/hm2;ECK为CK处理的单位面积NH3挥发量,kgN/hm2;N为单位施氮量,kgN/hm2.
每次采样同时,用 MP-406Ⅲ型土壤水分温度测定仪(南通中天精密仪器有限公司)测定5cm深度的土壤温度和土壤水分(体积比),根据土壤容重将体积水分换算成土壤空隙含水量(WFPS).
施肥后,每周用土钻采集 0~10cm 土壤样品,每小区多点采样制成混合样,以便测定土壤NH4+-N、NO3--N含量及pH值和脲酶活性变化.土壤样品采用2mol/L KCl溶液浸提后,用连续流动分析仪测定土壤NH4+-N、NO3--N含量.土壤脲酶活性的测定采用靛酚蓝比色法[19],其活性以24h后1g土壤中NH3-N的毫克数表示.参照李彦文等[20]的方法对土壤中磺胺二甲嘧啶残留量进行测定.实验开始前及小麦收获后的土壤有机质、全氮采用土壤农化分析的常规方法测定.土壤pH值采用1:2.5的土水比制成土壤悬液,用电位计法测定.
1.4 数据处理
实验结果用算数平均值和标准误差表示.运用Excel 2010和Spss19.0软件进行数据的统计分析,采用origin 9.0软件进行作图分析.
2 结果
2.1 磺胺二甲嘧啶对小麦生长季NH3挥发速率的影响
整个NH3挥发观测期,各处理NH3挥发速率变化趋势基本一致(图1).为更好地了解各处理之间的NH3挥发速率动态变化,将NH3挥发监测时间分为两个阶段,基肥阶段(2016-12-11~2017-02-06)和追肥阶段(2017-02-24~2017-04-07).从图1可以看出,各施肥处理均在基肥第2d出现一个较小的峰值,峰值大小顺序为:CM+SMZ5>CM>CM+SMZ15>CM+SMZ30>CF>CF+SMZ15>CF+SMZ5>CF+SMZ30,之后均处于较低水平,且猪粪处理的NH3挥发速率均高于复合肥处理.与基肥期不同,各施肥处理均在追肥后第4d出现最大的NH3挥发速率峰值.以复合肥为基肥的处理中,CF+SMZ15处理的 NH3挥发速率峰值最大,为3.57kgN/(hm2·d);以猪粪为基肥的处理中,CM+SMZ30处理的 NH3挥发速率峰值最大,为4.92kgN/(hm2·d),明显高于其他浓度抗生素处理.
以处理和每次独立观测时间对 NH3挥发速率作二因子方差分析,结果表明,基肥阶段各处理之间的NH3挥发速率无显著差异(P>0.05),而每次独立观测时间之间的 NH3挥发速率有极显著差异(P<0.01).追肥阶段,各处理及每次独立观测时间之间的NH3挥发速率均有极显著差异(P<0.01).从图 1中可以看出,基肥为复合肥和猪粪处理中,CF+SMZ15处理和CM+SMZ30处理表现为明显的促进作用.同浓度SMZ与不同基肥混施处理中,CF+SMZ30与 CM+SMZ30之间、CF+SMZ5与CM+SMZ5之间的NH3挥发速率均在基肥阶段达到显著差异(P<0.05),在追肥阶段达到极显著差异(P<0.01),而CF+SMZ15与CM+SMZ15处理之间在整个观测期均无显著差异(P>0.05).
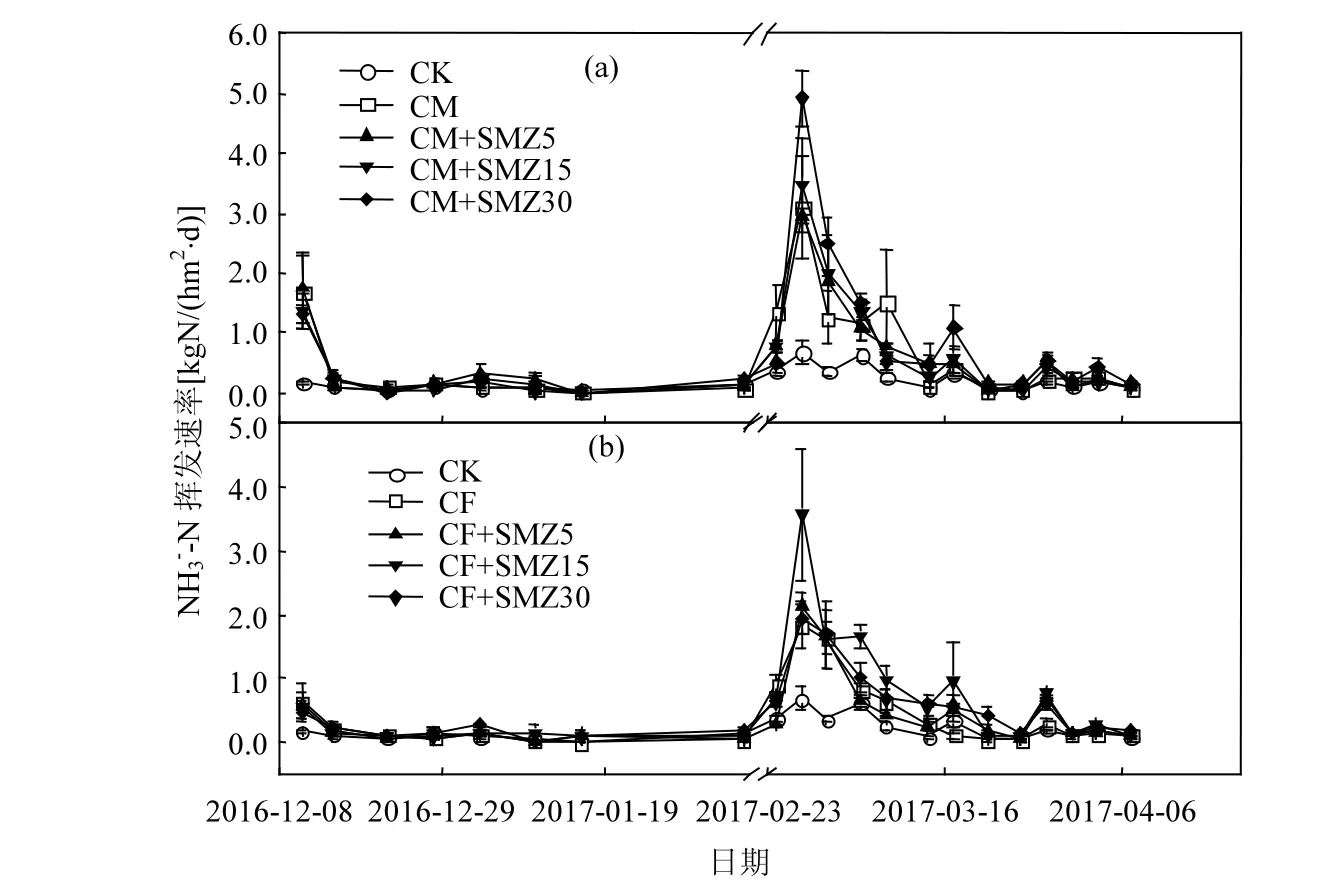
图1 小麦生长季NH3挥发的季节性动态变化Fig.1 Seasonal variations in NH3 volatilization during the wheat growing season
2.2 磺胺二甲嘧啶对小麦土壤NH3挥发累积量的影响
表 1为观测期内土壤 NH3挥发累积量.整个观测期,各处理的 NH3挥发累积量达到 14.98~48.82kgN/hm2,CM+SMZ30处理的NH3挥发累积量最高,达到 48.82kgN/hm2.其中追肥阶段达到10.17~39.37kgN/hm2,明显高于基肥阶段的 4.82~10.86kgN/hm2,追肥阶段 NH3挥发累积量占整个生育期的 67.89%~81.99%,可知整个观测期内,NH3挥发累积主要发生在追肥阶段.基肥阶段,各浓度 SMZ处理与同种基肥零抗生素处理之间的NH3挥发累积量均无显著差异(P>0.05);追肥阶段,CF+SMZ15和CM+SMZ30处理均显著增加了NH3挥发累积量(P<0.05).整个观测期内,所有抗生素处理在均值水平上均增加了 NH3挥发累积量,其中 CF+SMZ15、CF+SMZ30处理显著增加了NH3挥发累积量(P<0.05),分别是CF处理的1.7、1.4倍;相比于CM处理,CM+SMZ30处理也显著增加了NH3挥发累积量(P<0.05),是CM的1.3倍.
同浓度抗生素与不同基肥混施处理,在追肥阶段除了CF+SMZ15与CM+SMZ15之间无显著差异(P>0.05)外,CF+SMZ5与 CM+SMZ5、CF+SMZ30与 CM+SMZ30之间均有显著差异(P<0.05),猪粪处理的NH3挥发累积量显著高于复合肥处理;基肥阶段,各猪粪处理的NH3挥发累积量也均高于复合肥处理,但均未达到显著性(P>0.05).施肥处理均显著增加了 NH3挥发累积量(P<0.05),引起氮素损失.以复合肥为基肥的处理中,CF+SMZ15引起的NH3-N损失最大,为13.9%,其他处理大小顺序为:CF+SMZ30>CF+SMZ5>CF; CF+SMZ30、CF+SMZ15和CF+SMZ5处理所导致的NH3-N损失比分别是CF的2.0、2.5和1.2倍.以猪粪为基肥的处理中,CM+SMZ30处理引起的氮损失最大,为 16.9%,其他处理氮损失大小顺序为:CM+SMZ5>CM+SMZ15>CM;CM+SMZ30、CM+SMZ15和CM+SMZ5处理所导致的NH3-N损失比分别是CM的1.5、1.1和1.1倍.此结果说明对土壤NH3挥发的促进效应,SMZ与复合肥的协同处理要高于与猪粪的同步处理,虽然同浓度 SMZ处理(除 CF+SMZ15与CM+SMZ15外)中,猪粪处理引起的NH3-N损失绝对值均大于复合肥处理.

表1 小麦生长季NH3挥发累积量Table 1 Cumulative NH3volatilization during the wheat-growing season
3 讨论
3.1 磺胺二甲嘧啶对与麦田NH3挥发相关因子的影响
影响农田 NH3挥发的因素有土壤因素、农业措施以及气候因素等[21].将 SMZ对 NH3挥发显著影响期(也即追肥期)内的 NH3挥发速率与相关因子进行时间加权平均,相关分析结果如图2、3所示.从图 2得知,以复合肥为基肥的处理中,NH3挥发时间加权平均速率与土壤 NH4+-N平均含量在 0.1水平上呈显著正相关(P<0.1),与土壤NO3--N平均含量在0.05水平上呈显著正相关(P<0.05);猪粪处理中,NH3挥发时间加权平均速率与土壤 NH4+-N平均含量没有表现出较强的相关性(P>0.05),而与土壤NO3--N平均含量在0.1水平上呈现显著正相关(P<0.1).
从图 2可以看出,以复合肥为基肥的不同浓度 SMZ处理均明显增加了土壤 NH4+-N和NO3--N含量,而以猪粪为基肥的SMZ处理无明显促进效应,说明在以复合肥为基肥的处理中,SMZ促进土壤NH3挥发,主要是因为其增加了土壤中无机氮的含量,尤其是 NO3--N含量.有研究表明,室内培养条件下,高浓度磺胺嘧啶可能会通过抑制铵氧化古菌和氨氧化细菌而增加土壤NH4+-N含量[7];而SMZ可通过抑制反硝化细菌的生长显著降低反硝化速率[22],此作用亦可增加土壤中 NO3--N 含量.国彬[13]的研究结果也表明,10mg/kg浓度的磺胺类药物残留对土壤铵化和硝化有“激活-恢复”作用;50mg/kg浓度的磺胺类药物残留对土壤铵化和硝化一直呈现“激活”状态.在本研究旱地条件下,土壤以硝化作用为主,NO3--N含量较高,土壤中NH4+-N含量较低,无明显峰值,且土壤NH4+-N与土壤NO3--N呈极显著正相关(P<0.01).因此NH3挥发与NO3--N相关性更强一些.以猪粪为基肥的处理中,不同浓度SMZ处理对无机氮没有显著的促进作用,这是因为猪粪中有机质含量高,提高了土壤的 C/N,土壤微生物作用对无机氮的消耗增大,同时有机质对抗生素吸附能力强,降低了抗生素的有效性,故而SMZ的作用不是很明显.孔维栋等[23]的研究也表明,长期施用猪粪和复合肥的两种土壤中,前者土壤中各类兽药的ED50比后者土壤中低5倍以上.

图2 追肥期NH3挥发时间加权平均速率与土壤NH4+-N、NO3--N时间加权平均含量相关关系Fig.2 Relationship between the time weighted average of NH3 volatilization rate and the time weighted average average content of soil NH4+-N、NO3--N during the topdressing period

图3 追肥期NH3挥发时间加权平均速率与土壤脲酶加权平均活性相关关系Fig.3 Relationship between the time weighted average of NH3 volatilization rate and the time weighted average of soil urease activity during the topdressing period
此外,通过相关分析,未能发现小麦追肥期 NH3挥发时间加权平均速率与土壤脲酶活性平均值之间有明显的直接相关关系(P>0.05,图 3).而本研究团队却在水田条件下发现 NH3挥发速率与脲酶活性之间有显著的直接正相关关系,并且SMZ对脲酶活性表现为明显的促进作用.本研究中,将NH3挥发速率与脲酶活性日测定值作逐次后移滑动分析,发现二者之间有极显著正相关关系(P<0.01,图 4).说明旱田条件下,脲酶在将尿素态氮转化为NH4+-N(土壤产生NH3的底物)时,脲酶活性对NH3挥发的影响出现了滞后效应,滞后时间为2~4d.

图4 追肥期NH3挥发速率与土壤脲酶活性逐次后移滑动相关关系Fig.4 Relationship between NH3 volatilization rate and the backwards moving of soil urease activity during the topdressing period
3.2 不同浓度磺胺二甲嘧啶在同种基肥条件下对麦田NH3挥发的影响
整个观测期内,基肥期温度较低,气体扩散系数低,阻碍了NH3从液相到气相的转移,整体NH3挥发速率较低,追肥期温度回升,且追施尿素在短期内为 NH3挥发提供较多的 NH4+-N,较利于NH3挥发,因此NH3挥发速率较高.然而无论是基肥期还是追肥期,与不施抗生素对比,各浓度水平SMZ处理的NH3累积挥发均值均有所提高,这是因为大多数抗生素均有靶标微生物,其会抑制靶标微生物的活性,而使其他微生物从土壤中获得大量资源,数量激增[6].Hossain等[24]早在1984年就发现一些兽药在抑制其靶标微生物的同时可促进其他微生物的生长.在本实验中抗生素可能是通过抑制了其靶标微生物活性而使土壤氨化细菌和硝化细菌得到生长,提高了土壤无机氮含量,进而促进NH3挥发.
需要重点指出的是,在追肥阶段,CF+SMZ15、CF+SMZ30和CM+SMZ30处理均显著地促进了NH3挥发速率,且显著增加了其累积量(P<0.05).王冉等[25]研究得出,SMZ在自然土壤中的半衰期是 102d,此时土壤中同时存在着 SMZ母体及其代谢产物,经测定,本研究追肥时也即SMZ施入后的第75d, CF+SMZ5、CF+ SMZ15、CF+SMZ30、CM+SMZ5、CM+SMZ15、CM+SMZ30处理中 SMZ的残留量分别为: 0.58±0.00、1.57±0.14、1.72±0.14、0.61±0.06、2.04±0.08、2.16±0.07mg/kg, SMZ母体已经降低至较低水平,表明此时可能是降解产物起主要作用,激活了土壤中与无机氮转化相关的微生物活性.
3.3 磺胺二甲嘧啶在不同基肥条件下对麦田NH3挥发的影响
本研究中,高浓度SMZ30和低浓度SMZ5与不同基肥混施处理之间的 NH3挥发速率无论基肥还是追肥阶段均有显著差异(P<0.05),而中浓度SMZ15与不同基肥处理之间在整个观测期均无显著差异(P>0.05).徐秋桐等[26]研究结果表明,不施肥的情况下,添加抗生素磺胺二甲嘧啶可在一定程度上降低土壤中微生物量碳,而施肥可以提高土壤微生物量碳,且猪粪的提高程度高于复合肥,因此肥源对减缓抗生素效应是有差异的;但中浓度的SMZ与不同基肥处理之间没有显著差异,其具体原因有待进一步探索.此外,本试验结果还表明SMZ对NH3挥发的促进作用复合肥处理高于猪粪处理.这可能是由于,相比于复合肥,猪粪中有机质多,有机质与抗生素之间发生吸附作用,降低了抗生素的生物有效性,最终导致SMZ在猪粪中的效应低于复合肥.
总之,不同浓度的SMZ与氮肥混施均增加了NH3挥发累积量,较高浓度的SMZ达到了显著增加水平,且SMZ与猪粪混施更能促进NH3挥发.随着我国养殖场规模化的加大,畜禽粪便的增多,兽用抗生素大量随畜禽粪便进入农田,造成土壤抗生素污染加重,并进一步影响着土壤氮循环,增加 NH3挥发,形成恶性循环.因此,需大力加强对兽药抗生素的管控及进一步探明不同兽药抗生素对土壤NH3挥发的影响机制,为减缓兽用抗生素的环境污染生态效应提供助力.
4 结论
低(5mg/kg)、中(15mg/kg)、高(30mg/kg) 3种浓度的磺胺二甲嘧啶在复合肥和猪粪处理中均对 NH3挥发有促进作用.其中,复合肥处理中,中浓度磺胺二甲嘧啶促进效应最为明显,猪粪处理中,高浓度的促进效应最为明显,且这种促进作用主要表现在小麦季的追肥期.磺胺二甲嘧啶与复合肥的混施对土壤 NH3挥发的促进效应高于与猪粪的同步混施,其促进机制是磺胺二甲嘧啶明显提高了复合肥处理的土壤铵态氮和硝态氮的含量.
[1]姜珊珊.氮肥减量及不同品种肥料配施对稻麦农田 CH4和N2O(直接和间接)排放的影响 [D]. 南京:南京农业大学, 2017.
[2]倪 康,丁维新,蔡祖聪.有机复合肥长期定位试验土壤小麦季氨挥发损失及其影响因素研究 [J]. 农业环境科学学报, 2009,28(12):2614-2622.
[3]朱兆良,文启孝.中国土壤氮素 [M]. 南京:江苏科技出版社,1992:171-185.
[4]孙志高,刘景双,于君宝,等.湿地土壤 NH3挥发、N2O释放过程及影响因素 [J]. 湿地科学, 2008,6(3):429-439.
[5]Wu Y Y, Gu B J, Jan W E, et al. PM2.5pollution is substantially affected by ammonia emissions in China [J]. Environmental Pollution, 2016,218:86-94.
[6]鲍陈燕.猪粪对抗生素在农田系统中行为的影响 [D]. 杭州:浙江大学, 2016.
[7]Kotzerke A, Sharma S, Schauss K, et al. Alterations in soil microbial activity and N-transformation processes due to sulfadiazine loads in pig-manure [J]. Environmental Pollution,2008,153(2):315-322.
[8]Zhao L, Dong Y H, Wang H. Residues of veterinary antibiotics in manures from feedlot livestock in eight provinces of China [J].Science of the Total Environment, 2010,408(5):1069-1075.
[9]成玉婷,吴小莲,向 垒,等.广州市典型有机蔬菜基地土壤中磺胺类抗生素污染特征及风险评价 [J]. 中国环境科学, 2017,37(3):1154-1161.
[10]Liu F, Tao R, Ying J F, et al. Effects of six selected antibiotics on plant growth and soil microbial and enzymatic activities [J].Environmental Pollution, 2009,157(5):1636-1642.
[11]阮琳琳,林 辉,马军伟,等.土壤中单一及复合抗生素的降解及微生物响应 [J]. 中国环境科学, 2018,38(3):1081-1089.
[12]Ma J W, Lin H, Sun W C, et al. Soil microbial systems respond differentially to tetracycline, sulfamonomethoxine, and ciprofloxacin entering soil under pot experimental conditions alone and in combination [J]. Environment Science Pollution Research, 2014,21(12):7436–7448.
[13]国 彬,姚丽贤,刘忠珍,等.磺胺类兽药对土壤生化功能及氮素的影响 [J]. 土壤, 2012,44(4):596-600.
[14]Hou L J, Yin G Y, Liu M, et al. Eあects of sulfamethazine on denitri fi cation and the associated N2O release in estuarine and coastal sediments [J]. Environmental Science & Technology,2015,49:326−333.
[15]Sarmah A K, Meyer M T, Boxall A B. A global perspective on the use, sales, exposure pathways, occurrence, fate and effects of veterinary antibiotics VAs in the environment [J]. Chemosphere,2006,65(5):725-759.
[16]王 娜.环境中磺胺类抗生素及其抗性基因的污染特征及风险研究 [D]. 南京:南京大学, 2014.
[17]Ji X, Shen Q, Liu F, et al. Antibiotic resistance gene abundances associated with antibiotics and heavy metals in animal manures and agricultural soils adjacent to feedlots in Shanghai; China [J].Journal of Hazardous Materials, 2012,235-236(20):178-185.
[18]王朝辉,刘学军,巨晓棠,等.田间土壤氨挥发的原位测定-通气法[J]. 植物营养与肥料学报, 2002,8(2):205-209.
[19]关松荫.土壤酶及其研究方法 [M]. 北京:中国农业出版社,1986:294-302.
[20]李彦文,莫测辉,赵 娜,等.高效液相色谱法测定水和土壤中磺胺类抗生素 [J]. 分析化学, 2008,36(7):954-958.
[21]Rosendahl I, Siemens J, Kindler R, et al. Persistence of the fluoroquinolone antibiotic difloxac in soil and lacking effects on nitrogen turnover [J]. Environment Quality, 2012,41(4):1275–1283.
[22]Olesen J E, Rubaek G H, Heidmann T, et al. Effect of climate change on greenhouse gas emissions from arable crop rotations[J]. Nutrient Cycling in Agroecosystem, 2004,70(2):147-160.
[23]孔维栋,朱永官.抗生素类兽药对植物和土壤微生物的生态毒理学效应研究进展 [J]. 生态毒理学报, 2007,2(1):1-9.
[24]Hossain A K M, A lexander M. Enhanzing soybean rhizosphere colonization by Rhizobium japonicum [J]. Applied &Environmental Microbiology, 1984,48(3):468-472.
[25]王 冉,刘铁铮,耿志明,等.兽药磺胺二甲嘧啶在土壤中的生态行为 [J]. 土壤学报, 2007,44(2):307-311.
[26]徐秋桐,顾国平,张明奎.适宜水分和养分提高土壤中磺胺二甲嘧啶降解率 [J]. 农业工程学报, 2016,32(1):132-138.

