右美托咪定对创伤应激障碍大鼠疼痛行为及认知功能的影响
张庆洪 冯宇峰 张丽娟
(厦门大学附属第一医院麻醉科,福建 厦门 361003)
创伤后应激障碍(PTSD)核心症状包括创伤性再体验、回避与警觉性增高等〔1〕。经历过创伤事件的人群有5%~15%发展为 PTSD,手术患者PTSD的发生率高达71%〔2〕。如何预防及降低手术患者PTSD一直是临床探讨的话题。右美托咪定是临床常用的麻醉药物,具有镇静、镇痛、抗焦虑作用,还可减少术后躁动。右美托咪定可以通过减轻术中疼痛程度来降低PTSD的发生〔3〕。本研究通过建立PTSD动物模型的方法,观察右美托咪定对创伤应激障碍大鼠疼痛行为及认知功能的影响。
1 材料与方法
1.1动物选择及分组 雄性SD大鼠32只,购自厦门大学动物实验中心(许可证号20160215),8~10周龄,体重250~350 g,本研究报请医院动物伦理委员会批准。随机分为对照组、PTSD组、20 μg右美托咪定组、40 μg右美托咪定组各8只。对照组、PTSD组按1 ml/kg腹腔注射生理盐水,20 μg右美托咪组、40 μg右美托咪定组分别按20 μg/kg和40 μg/kg腹腔给予右美托咪定。生理盐水和右美托咪定在PTSD模型建立后立即给予,连续用药3 d。
1.2PTSD模型建立 应用条件性恐惧实验分析系统建立PTSD模型,通过声音、环境、电刺激来促使大鼠产生恐惧记忆,使条件性刺激控制恐惧反应,并通过僵直行为来检测评定动物恐惧记忆是否形成及其严重程度〔4〕。对照组于第0、1、3天仅给予声音刺激,PTSD组、右美托咪定组于第0、1、3天将大鼠放入斯金纳箱(30 cm×26 cm×22 cm)中,适应5 min后给予30 s、5 kHz、75 db的声音刺激,随后在15 min内给予5次2 mA、2 s的电刺激,并在第7、14、21天将大鼠再次暴露于相同的环境中。
1.3观察指标
1.3.1疼痛行为 分别于干预前、干预后1、3、7、14 d测定各组大鼠热痛阈、机械痛阈值。热缩足反射潜伏期(TWL):采用PL-200测痛仪,以Hargreaves 法记录,将装有大鼠的有机玻璃箱至于6 mm的玻璃板下,适应10 min后,用可移动光束、40%点光强度刺激照射足底中部,从照射开始至大鼠出现抬腿、舔足的时间为TWL。每只大鼠测定3次,间隔5 min,取其平均值。机械性缩足反射阈值(MWT):采用von Frey仪器测定机械痛,用单纤维丝探针在大鼠后爪趾面给予连续增加的压力,大鼠出现抬足或舔足行为时测痛仪上显示的数值为MWT,每只动物测定3次,每次刺激间隔5 min,取其平均值。
1.3.2认知功能 第27天进行水迷宫实验,评估大鼠的空间学习记忆能力。水迷宫实验在120 cm长、50 cm高的圆形水池中进行。将水池分为4个象限,在左上象限中放置直径为10 cm、位于水面下1 cm的平台。实验过程中控制水温在(25±1)℃,将大鼠面向池壁随机从4个不同的象限放入水中,记录大鼠找到平台的潜伏期。若大鼠在60 s内未找到平台,则将其放置在平台上停留15 s。连续训练4 d,第5天撤去平台,记录各组大鼠在目标象限探索时间百分比。
1.4统计学方法 采用SPSS20.0软件进行方差分析及配对t检验。
2 结 果
2.1各组TWL比较 干预前各组大鼠TWL比较差异无统计学意义(P>0.05);干预后1、3、7、14 d,PTSD组、右美托咪定组TWL均明显低于对照组(P<0.05),且40 μg右美托咪组>20 μg右美托咪定组>PTSD组,各组间差异有统计学意义(P<0.05),见表1。
2.2各组MWT比较 干预前各组MWT比较差异无统计学意义(P>0.05);干预后1、3、7、14 d,PTSD组、右美托咪定组MWT均明显低于对照组(P<0.05),且40 μg右美托咪定组>20 μg右美托咪定组>PTSD组,各组间差异有统计学意义(P<0.05),见表2。

表1 各组TWL比较
与对照组比较:1)P<0.05;与PTSD组比较:2)P<0.05;与20 μg右美托咪定组比较:3)P<0.05

表2 各组MWT比较
2.3各组认知功能比较 与对照组比较,其余各组寻找平台潜伏期时间延长,探索时间百分比明显下降(P<0.05);且40 μg右美托咪组<20 μg右美托咪定组
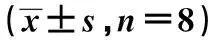
表3 各组认知功能比较
3 讨 论
PTSD的特征为对创伤相关记忆增强产生的过度恐惧〔5〕。PTSD病程慢、治疗效果差,药物治疗只能部分缓解PTSD症状〔6〕。PTSD的发生与创伤性事件密切相关,手术是一种创伤性事件,因此手术患者是PTSD的高发人群。右美托咪定通过抑制交感神经活性发挥镇静、镇痛作用,可使患者血流动力学更稳定,降低术后躁动发生率〔7〕。
疼痛刺激是引起PTSD的原因之一。曹铭辉等〔8〕研究认为,右美托咪定能抑制背根神经节内p-ERK信号通路的激活,有效缓解神经病理性疼痛大鼠的痛觉过敏。张晓燕等〔9〕研究报道,幼鼠结肠降钙素基因相关肽表达与内脏痛敏具有相关性;而汤翠菊等〔10〕则指出,右美托咪定能降低前炎性细胞因子表达,改善乳腺癌骨转移大鼠疼痛行为。本研究结果表明,右美托咪定能有效缓解PTSD大鼠疼痛行为,且大剂量右美托咪定效果更明显。
PTSD的显著特征之一就是恐惧记忆的增强,当患者暴露于急性应激环境中时,出现交感-去甲肾上腺素系统的高反应性,增加PTSD的发生风险〔11〕。右美托咪定主要通过激动α2肾上腺素受体影响脑干蓝斑核而干扰恐惧记忆的获得〔12〕。陈丹丹等〔13〕文献报道,右美托咪啶能够有效缓解ICU患者镇静期应激反应,钱宝民等〔14〕认为,右美托咪定能减缓氯胺酮麻醉致幼龄大鼠海马神经元凋亡。本研究与类似文献报道〔15〕,结果一致提示右美托咪定能改善创伤应激大鼠的认知功能。
4 参考文献
1Allen JP,Crawford EF,Kudler H.Nature and treatment of comorbid alcohol problems and post traumatic stress disorder among American Military Personnel and Veterans〔J〕.Alcohol Res,2016;38(1):133-40.
2詹 惟,潘铁成,李建波,等.中老年创伤后应激障碍的相关因素〔J〕.中国老年学杂志,2012;32(21):4729-31.
3杨娇娇,孙晓茹,张 慧,等.右美托咪定对创伤后应激障碍大鼠焦虑状态和认知功能的影响〔J〕.临床麻醉学杂志,2015;31(8):797-800.
4Verma M,Bali A,Singh N,etal.Investigating the role of nisoldipine in foot-shock-induced post-traumatic stress disorder in mice〔J〕.Fundam Clin pharmacol,2016;30(2):128-36.
5Carletto S,Borghi M,Bertino G,etal.Treating post-traumatic stress disorder in patients with multiple sclerosis:a randomized controlled trial comparing the efficacy of eye movement desensitization and reprocessing and relaxation therapy〔J〕.Front Psychol,2016;7(1):526.
6康延海,蒋湘玲,郭 敏,等.海南省热带地区黎族与汉族PTSD患者血小板5-HT浓度的比较研究〔J〕.海南医学院学报,2013;19(10):1345-8.
7张满和,周秀敏,邢彦杰,等.右美托咪定对创伤性脑损伤大鼠海马神经元自噬的影响〔J〕.中华麻醉学杂志,2015;35(3):373-6.
8曹铭辉,何惠燕,纪风涛,等.右美托咪定缓解神经病理性疼痛大鼠的痛觉过敏并抑制背根神经节内p-ERK信号通路的激活〔J〕.中华实验外科杂志,2011;28(5):789-91,封4.
9张晓燕,吴 斌,杨燕珍,等.幼鼠结肠降钙素基因相关肽表达与内脏痛敏的相关性〔J〕.中国疼痛医学杂志,2011;17(4):237-41.
10汤翠菊,于世英,张 敏.鞘内注射p38MAPK抑制剂对乳腺癌骨转移大鼠疼痛行为及前炎性细胞因子表达的影响〔J〕.中华实验外科杂志,2008;25(1):27-9.
11Angel CM.Resilience,post-traumatic stress,and posttraumatic growth:Veterans′ and active duty military members′ coping trajectories following traumatic event exposure〔J〕.Nurse Educ Today,2016;47:57-60.
12丁旭东,郑宁宁,曹岩岩,等.右美托咪啶预处理对大鼠缺氧缺血性脑损伤的影响〔J〕.中国现代神经疾病杂志,2014;14(5):427-32.
13陈丹丹,王 伟.右美托咪定联合瑞芬太尼TCI对ICU患者镇静期应激反应的影响〔J〕.海南医学院学报,2016;22(8):819-21.
14钱宝民,高清丽,房立峰,等.右美托咪定对创伤性脑损伤大鼠认知功能和海马CA1区氧化应激的影响〔J〕.临床麻醉学杂志,2015;31(8):801-5.
15Bentefour Y,Rakibi Y,Bennis M,etal.Paroxetine treatment,following behavioral suppression of PTSD-like symptoms in mice,prevents relapse by activating the infralimbic cortex〔J〕.Eur Neuropsyychopharmacol,2016;26(2):195-207.

