维药布亚中金雀花碱诱导HepG-2细胞凋亡作用及其衍生物的制备
于蕾,尚东雨,杨经辉,陈志峰,王鑫,姜波,孙永雪,张连芳,季宇彬(.哈尔滨商业大学 生命科学与环境科学研究中心,黑龙江 哈尔滨 50076;2.国家教育部抗肿瘤天然药物工程研究中心,哈尔滨 50076)
维药布亚(SophoraalopecuroidesL.)属于豆科槐属植物,又称苦豆子,全株具有味苦性寒的特点,发挥清热消暑、利尿除湿、抗菌消炎、止痛镇静等作用,在临床上能有效治疗湿热痢疾,喉痛、咳嗽,肠炎泄泻及湿疹等湿热性或血液质性疾病[1]。维药布亚中含有丰富的生物碱类成分,其中金雀花碱(Cytisine)又被称为金雀花酮碱、野靛碱以及乌乐碱,属于喹诺里西啶类生物碱[2]。维药布亚中的生物碱归属于喹诺里西啶类生物碱,这类生物碱具有相似的结构和功能,野决明属和紫藤属等这些不同属的植物中也含有此类生物碱[3]。20世纪60年代初,人类就已经发现此类生物碱具有抑瘤作用,其中维药布亚总碱、苦参碱和槐定碱早已用于临床治疗恶性肿瘤,槐定碱是Ⅰ类抗癌新药[4],而结构相似的金雀花碱抗癌效果在最进研究中才初见端倪。
天然抗肿瘤药物以其作用机制独特、毒副作用低的特点一直是近年来抗肿瘤药物研究的一个热点,通过对天然药物进行化学结构修饰可以提高药物作用强度、提高药物特异性或降低药物毒副作用,或优化其物理化学活性[5]。Rouden J[6]等人对金雀花碱进行化学修饰反应得到了一系列的9-及10-取代金雀花碱衍生物,对其进行亲和力分析实验,结果,两个10-取代衍生物在与α4β2胆碱受体亚型的结合试验中具有比金雀花碱更高的选择性,分别是金雀花碱的3000倍及900倍。合成的9-乙烯基金雀花碱与金雀花碱的生物活性非常相似,同时还可以穿透血脑屏障,提高了金雀花碱的生物活性及利用价值。Houllier N[7]等人合成了一系列新的N-(芳烷基)和N-(芳酰基)-金雀花碱,对其进行大鼠α4β2和α7胆碱受体亚型结合的实验研究,结果表明多数修饰后的衍生物对α4β2胆碱受体亚型具有高亲和性。其中的3个衍生物的钙离子活性及电生理实验结果显示,这三个衍生物对不同的亚型表现出拮抗剂或部分激动剂活性,表明N取代基的金雀花碱衍生物对其活性有很大的影响。本实验通过对金雀花碱进行结构修饰,试图提高金雀花碱的生物活性及利用价值,减小药物副作用,为获得更佳的抗肿瘤衍生物进了初步的研究。
本实验首先通过MTT法对金雀花碱进行体外抗肿瘤实验,发现其具有明显抑制人肝癌HepG-2细胞增殖的活性。在此研究基础上,进一步对金雀花碱作用后HepG-2细胞形态及其超微结构进行观察,确定其是否对细胞生长状态及细胞内的超微结构产生影响。本实验还应用流式细胞仪检测金雀花碱作用后HepG-2细胞凋亡率。此外,本实验采用亲核取代的方法对活泼氢进行取代,得到金雀花碱衍生物N-乙酰基金雀花碱,并采用MTT法检测N-乙酰基金雀花碱对HepG-2细胞的增殖抑制作用并与金雀花碱进行比较。
1 材料与方法
1.1 材料
1.1.1 细胞株
人肝癌HepG-2细胞,由哈尔滨商业大学生命科学与环境科学研究中心提供。HepG-2细胞用含10%胎牛血清的RPMI1640培养液在37 ℃,5%CO2培养箱中培养,取对数生长期的细胞用于实验。
1.1.2 药物及试剂
金雀花碱(纯度>98%,批号:20111101C),陕西大河药业有限责任公司;羟基喜树碱(HCPT,纯度>98%,批号:H109197),阿拉丁试剂有限公司;胰蛋白酶(批号:20130308),美国Sigma药物公司;二甲基亚砜(DMSO)(批号:20120726),天津巴斯夫化工有限公司;RPMI-1640培养基(批号:20130507),GIBCO公司;胎牛血清(批号:20130206),杭州四季青生物工程公司;MTT(溴化四氮唑蓝)(批号:2010212),北京索莱宝科技有限公司;碘化丙啶(PI)(批号:P4170),Sigma公司;RNase A(批号:V900498),Sigma公司;Triton-X-100(批号:V900502),上海华舜生物工程有限公司;枸橼酸钠(分析纯,批号:20120625),北京康普汇维科技有限公司。
1.1.3 实验仪器
ZF-C型三用紫外分光仪,上海康禾光电仪器有限公司;ADVANCE III 600MHz高分辨核磁共振波谱仪,Bruker公司;Olympus-CKI41倒置显微镜,日本Olympus公司;680型全自动酶标仪,美国BIO-RAD公司;JEM-1220透射电子显微镜,日本电子公司。
1.2 方法
1.2.1 MTT法检测金雀花碱对人肝癌HepG-2细胞的生长抑制作用

细胞生长抑制率=( A对照组- A试验组)/ A对照组×100%。
1.2.2 倒置显微镜观察金雀花碱作用后HepG-2的细胞形态
胰酶消化后稀释为浓度为3×105个/mL的细胞悬液,每孔1 mL接种于6孔培养板,培养24 h后,每孔加1 mL不同浓度的药液,金雀花碱实验组的浓度分别为2.5、5、10 mmol/L,阳性药HCPT的浓度为60 μmol/L,空白对照组每孔加1 mL 的RPMI1640培养液,药物作用48 h后,在倒置显微镜下拍照观察其形态变化[10-11]。
1.2.3 透射电子显微镜观察金雀花碱对HepG-2细胞超微结构的影响
取对数生长期的HepG-2细胞,胰酶消化后,以3×105个/mL接种于6孔板,24 h后给药,每个浓度3个平行组,金雀花碱的给药浓度分别为2.5、5、10 mmol/L,阳性药HCPT的浓度为60 μmol/L,空白对照组加等体积的RPMI 1640培养液,作用24 h后,收集细胞,立即用2%戊二醛固定2.5 h,再用锇酸进行双重固定。经乙醇梯度脱水,环氧树脂包埋,超薄切片,醋酸铀、柠檬酸铅双重染色后,透射电镜下观察并拍照[12]。
1.2.4 流式细胞仪检测金雀花碱对HepG-2细胞凋亡率的影响
对数生长期的细胞,稀释终浓度为3×105个/mL,接种于6孔板,培养箱培养24 h,每孔加1 mL不同浓度的药液,每个浓度设3个平行孔,金雀花碱给药组的浓度(2.5、5、10 mmol/L),阳性药HCPT的浓度为60 μmol/L,空白对照组加1 mL的RPMI1640培养液,培养48 h后取出6孔培养板,每孔加入1 mL PBS缓冲液洗3次,1 mL 0.25 %胰蛋白酶消化,悬液移至离心管,1000 rpm、10 min离心收集细胞,PBS重悬并计数,取1×106个重悬的细胞,于4℃冰箱内固定液固定24 h,1000 rpm离心弃固定液,用PBS洗3次,避光条件下加PI染色液(避光条件下称取枸橼酸钠33.4 mg,PI 5 mg,RnaseA 1 mg,加入Trtiton-X-100 0.5 mL,充分混匀)800 μL,混匀,孵育30 min;400目尼龙网过滤,流式细胞仪(Flow Cytometry, FCM)检测[13-14]。
1.2.5 目标化合物的设计与合成及产物对人肝癌HepG-2细胞的生长抑制作用
图1为金雀花碱化学结构式图,3位上的N原子连接的H是活泼氢,所以容易被其他物质取代,本实验在此理论基础下,用Ac2O对其进行亲核取代反应。目标化合物的合成路线如图2。室温、搅拌条件下,向前体化合物金雀花碱(95 mg,0.5 mmol)和乙酸酐(2.0 mL)混合溶液中,加入吡啶(2 mL,0.002 5 mmol),反应24 h,待TLC检测底物金雀花碱消失,搅拌下将反应混合物倒入冰盐水(50 mL)中,真空抽滤得到白色固体,TLC检测所得固体为单一化合物,对产物进行1H-NMR检测。此外,采用MTT法检测金雀花碱衍生物对人肝癌HepG-2细胞的生长抑制作用,实验方法及给药剂量同1.2.1。

图1 金雀花碱化学结构式

图2 金雀花碱衍生物合成路线
1.3 统计学分析

2 结果
2.1 MTT法检测金雀花碱对人肝癌HepG-2细胞的生长抑制作用
实验结果如图3。金雀花碱作用于HepG-2细胞72 h后,随着药物浓度的增加,OD值显著降低,HepG-2细胞的生长抑制率逐渐升高。经计算金雀花碱IC50为5.36 mmol/L。阳性药HCPT对细胞的生长抑制作用显著,72 h的半数抑制浓度IC50为8.56 μmol/L。

图3 金雀花碱作用后HepG-2细胞的生长抑制率
2.2 倒置显微镜观察金雀花碱作用后HepG-2的细胞形态
如图4所示,细胞给药48 h后,在普通倒置显微镜下观察,发现空白对照组细胞会贴壁聚堆生长,细胞饱满,边缘清晰,无漂浮死细胞。HCPT对照组漂浮死细胞较金雀花碱中剂量组少,细胞存在明显的形态学变化。随着金雀花碱剂量的增加细胞体积逐渐变小,细胞逐渐变圆变粗糙,折光性逐渐减弱,贴壁细胞减少,出现悬浮死细胞。中高剂量组细胞多数脱落,有少数细胞体积变大,细胞破裂,呈坏死状。

图4 倒置显微镜观察HepG-2的细胞形态(10×40)注:A.空白对照组;B.阳性对照组;C.低剂量组;D.中剂量组;E.高剂量组
2.3 金雀花碱对HepG-2细胞超微结构的影响
金雀花碱对HepG-2细胞超微结构的影响如图5所示,空白对照组细胞结构清晰,细胞器结构完整,细胞表面少量微绒毛突起,细胞核较大,常染色质丰富,核仁明显,胞浆呈均匀中等的电子密度,具有较多游离多聚核糖体,粗面内质网和线粒体散在分布于细胞中。不同浓度金雀花碱作用后可见细胞凋亡形态学改变,细胞表面微绒毛减少和消失,凋亡细胞可见大小不等球状的突起及凋亡小体,细胞膜破裂,胞浆外溢;高剂量组内质网腔明显扩张、线粒体肿胀。阳性对照组线粒体减少,细胞突起明显减少,可见大面积内质网肿胀扩张可见典型凋亡细胞、凋亡小体。表明金雀花碱能损伤重要细胞器诱导HepG-2细胞凋亡。

图5 金雀花碱作用HepG-2细胞后的电镜图片(8000×)注:A.空白对照组;B.阳性对照组;C.低剂量组;D.中剂量组;E.高剂量组
2.4 流式细胞仪检测金雀花碱对HepG-2细胞凋亡率的影响
不同浓度的金雀花碱作用于人肝癌HepG-2细胞48 h后,FCM检测结果如表1和图6显示,金雀花碱给药组的DNA直方图中G0/G1峰前面出现明显的亚二倍体凋亡峰,且随着金雀花碱浓度的增加凋亡率也有显著增加(P<0.01)。金雀花碱的给药量为2.5 mmol/L时凋亡率为(3.72±0.49)%,随着给药量上升到10 mmol/L时,凋亡率上升至(65.74±3.34)%,呈一定的剂量依赖性。阳性组凋亡率为(15.83±3.16)%(P<0.01)。
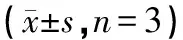
表1 流式细胞仪检测金雀花碱对HepG-2细胞的凋亡率
注:与空白组比较,**P<0.01

图6 FCM检测HepG-2细胞凋亡率注:A.空白对照组;B.阳性对照组;C.低剂量组;D.中剂量组;E.高剂量组
2.5 金雀花碱衍生物结构鉴定
将得到的产物点样展开,TLC检测,呈现蓝紫色荧光的单一化合物,与反应物金雀花碱存在极性差异,表明原料金雀花碱完全反应得到产物。NMR检测:白色固体,1H-NMR (500 MHz, CDCl3) δ 1.75 (s, 2H), 1.98~2.02 (m, 3H), 2.53 (s, 1H), 2.83(q, J=2.0, 1H), 3.09(s, 1H), 3.40 (q, J=1.5 Hz, 1H), 3.84~3.92 (m, 2H), 4.12 (q, J=2.0 Hz, 1H),4.74(dd, J=4.5 ,6.0Hz, 1H), 6.07(q, J=2.0 Hz, 1H), 6.46(q, J=1.5 Hz, 1H),7.30(s, 1H)。结果表明,产物为白色固体,与文献[15]比对一致,故鉴定该化合物为N-乙酰基金雀花碱(N-acetylcytisine)。
2.6 MTT法检测N-乙酰基金雀花碱对HepG-2细胞的生长抑制作用
MTT法检测不同浓度金雀花碱及N-乙酰基金雀花碱对HepG-2细胞的生长抑制作用,经过3次平行实验求出半数抑制浓度。由表2可明显看出,N-乙酰基金雀花碱作用于HepG-2细胞72 h后,随着药物浓度的增加,OD值显著降低,HepG-2细胞的生长抑制率逐渐升高。经计算金雀花碱IC50为5.51 mmol·L,N-乙酰基金雀花碱IC50为7.51 mmol/L。阳性药HCPT对细胞的生长抑制作用显著,72 h的半数抑制浓度IC50为8.56 μmol/L。
3 讨论
维药布亚(SophoraAlopecuraidesL.)是豆科槐属(Sophora)植物,主要分布在我国西北的荒漠地区和中亚细亚一带地区[16]。布亚全株具有味苦性寒的特点,发挥止痛镇静、清热消暑、抗菌消炎、利尿除湿等作用,在临床上能有效治疗喉痛、湿热痢疾、咳嗽、肠炎泄泻及湿疹等湿热性或血液质性疾病[17]。布亚含有多种化学成分,包含了有机酸、蛋白质、多糖、黄酮和生物碱等,其中生物碱含量最高,地上部分的生物碱含量占总生物碱的6.11%~8.03%,种子中的生物碱含量高达8.11%。布亚生物碱具有镇静镇痛、降压降脂、抗病毒、抗炎以及抗肿瘤作用,是布亚的主要生物活性成分[18]。

表2 MTT法测定金雀花碱及N-乙酰基金雀花碱对HepG-2的抑制率
注:与空白组比较,*P<0.05,**P<0.01
喹诺里西啶类生物碱的多种生物学活性得到了广泛研究,其中包括槐定碱、苦参碱、苦豆碱在内的生物碱被证明具有良好的抗肿瘤活性,而关于金雀花碱该方面的研究却少有报道[19-20]。本实验首先通过体外实验的方法,从增殖抑制作用、形态学观察、细胞凋亡率等方面对金雀花碱的抗肿瘤作用进行研究。MTT法是一种常用的体外筛选抗肿瘤药物的方法,操作简便、敏感。活细胞线粒体中的脱氢酶可以把MTT代谢还原形成一种蓝紫色不溶物-甲瓒化合物(Formazan),通过该原理测定不同给药剂组颜色变化的深浅,得到肿瘤细胞生长状况。通过计算测定的OD值得可到细胞受抑制的情况[21]。本研究发现金雀花碱能显著抑制人肝癌HepG-2细胞增殖,IC50为5.36 mmol/L。
细胞凋亡是一个形态学的概念,发生凋亡的细胞有着典型的形态学特征[22]。采用倒置显微镜观察给金雀花碱48 h后HepG-2细胞的形态变化。空白组细胞会贴壁聚堆生长,细胞饱满,边缘清晰,无漂浮死细胞,金雀花碱给药组细胞随着剂量的增加细胞体积逐渐变小,细胞逐渐变圆变粗糙,折光性逐渐减弱,贴壁细胞减少,出现悬浮死细胞,中高剂量组细胞多数脱落,有少数细胞体积变大,细胞破裂,呈坏死状。此外,本实验还采用透射电镜进一步分析金雀花碱引起的HepG-2 细胞凋亡形态变化,结果显示,不同浓度金雀花碱作用后可见HepG-2 细胞凋亡发生形态学改变,细胞表面的微绒毛减少或有些消失,凋亡细胞出现大小不等球状的突起和凋亡小体,细胞膜被破裂,导致胞浆外溢;内质网腔扩张明显,线粒体肿大。倒置显微镜和透射电子显微镜观察结果都为证明金雀花碱能诱导HepG-2凋亡提供了形态学的依据。
对PI染色后的细胞进行FCM分析,可以发现在DNA直方图上正常二倍体细胞的G0/G1峰前出现一个亚二倍体凋亡峰(apoptotic peak,AP峰),代表凋亡细胞。根据此峰可以得出凋亡细胞占总细胞数的百分率[23-25]。流式细胞仪检测结果显示给药组出现明显凋亡峰,且呈一定的剂量依赖性,高剂量组凋亡率为(65.74±3.34)%,明确了金雀花碱能诱导人肝癌HepG-2细胞的凋亡。通过对金雀花碱作用后细胞超微结构的观察,发现其内质网腔明显扩张、线粒体出现肿胀现象,说明金雀花碱诱导HepG-2细胞凋亡,可能是通过内质网应激及线粒体通路进行的。
研究显示,多数N取代基的金雀花碱衍生物对其生物活性有很大的影响[7]。为提高金雀花碱的生物活性及利用价值,获得活性更好,毒副作用更低的抗肿瘤金雀花碱衍生物,本实验对金雀花碱进行化学结构修饰。本实验分析得出目标化合物N-乙酰基金雀花碱,但MTT实验结果显示,经计算金雀花碱IC50为5.51 mmol/L,N-乙酰基金雀花碱IC50为7.51 mmol/L,提示其衍生物活性低于金雀花碱本身,并未能增强其抗肿瘤活性,说明金雀花碱的此种衍生物,不能起到增强药效的作用,不再具备继续研究的潜质。
综上所述,金雀花碱体外具有抑制HepG-2细胞生长的作用,能够诱导人肝癌HepG-2细胞凋亡。N-乙酰基金雀花碱能够抑制HepG-2细胞的生长,但其作用较金雀花碱弱,表明在金雀花碱的3位N上修饰链状结构Ac2O并不能增强金雀花碱的抗肿瘤活性。
[1] 郝伟亮,孟根达来,解红霞.苦豆子的化学成分及药理作用研究进展[J].中国药房,2016,27(13):1848-1850.
[2] 吐尔孙阿衣·克力木,努尔麦麦提·如则,阿依努尔·阿不来提.维药苦豆子研究近况[J].中国民族医药杂志,2016,40(5):66-68
[3] 游菁菁,李月英,沙碧莹,等.中药苦豆子生物碱的研究进展[J].江西中医药大学学报,2015,27(2):109-113,116.
[4] 田真真,万红娇,杨翠萍.槐定碱的药理研究综述[J].中国实验方剂学杂志,2010,16(11):219-221.
[5] 刘耀武,栗进才,夏成凯.关于天然药物活性成分结构修饰与改造的研究探讨[J].时珍国医国药,2009,20(6):1553-1555.
[6] Rouden J, Lasne MC, Blanchet J, et al. (-)-Cytisine and derivatives: synthesis, reactivity, and applications[J].Chem Rev,2014,114(1):712-778.
[7] Houllier N, Gopisetti J, Lestage P, et al. Identification of 9-fluoro substituted (-)-cytisine derivatives as ligands with high affinity for nicotinic receptors[J].Bioorg Med Chem Lett,2010,20(22):6667-6670.
[8] 芦冲,张睿苏,高彦宇,等.半枝莲醇提物含药血清对人结肠癌HT-29细胞增殖、凋亡和周期的影响[J].中医药学报,2016,44(2):51-54.
[9] 姬艳菊,徐巍.青龙衣提取物对人肝癌细胞株抑制作用的实验研究[J].中医药学报,2014,42(5):30-34.
[10] 司维柯,肖桃元,康格非.苦参碱对人肝癌细胞HepG2的细胞形态影响和相关增殖因素的变化[J].第三军医大学学报,2000,22(6):553-556.
[11] Ji YB, Yu L. N-butanol extract of Capparis spinosa L. induces apoptosis primarily through a mitochondrial pathway involving mPTP open, Cyt-C release and Caspase activation[J].Asian Pac J Cancer Prev,2014,15(21):9153-9157.
[12] 王芝兰,王荣田,郭立新,等.益脑灵对老年性痴呆模型大鼠学习记忆力及海马细胞超微结构的影响[J].中医药学报,2005,33(3):50-52.
[13] 孙阳,吴勃岩,车艳新,等.鳖甲煎丸诱导肝癌细胞凋亡及对STAT信号通路的影响[J].时珍国医国药,2016,27(4):849-851.
[14] Shi J, Jiang Q, Ding X, et al. The ER stress-mediated mitochondrial apoptotic pathway and MAPKs modulate tachypacing-induced apoptosis in HL-1 atrial myocytes[J].PLOS One,2015,10(2):e0117567.
[15] Przyby AK, Kubicki M. A comparative study of dynamic NMR spectroscopy in analysis of selected N-alkyl-, N-acyl-, and halogenated cytisine derivatives[J].J Mol Struct,2011,985:157-166.
[16] 石雪蓉.抗肿瘤中药的研究现状[J].四川解剖学杂志,2009,17(3):32-34.
[17] 江苏新医学院.中药大辞典(上册)[M].上海:上海科学技术出版社,2010:322.
[18] 全国中草药汇编组.全国中草药汇编(上册)[M].北京:人民卫生出版社,2003:12.
[19] Gao H, Guo Y, Deng N, et al. Suppressive Effect of Matrine on Tumor Invasion in N-Butyl-N-(4-Hydroxybutyl)Nitrosamine-Induced Urinary Bladder Carcinogenesis[J].Chemotherapy,2015,60(2):119-128.
[20] 林泽.槐属植物中药生物碱抗肿瘤作用机制研究[D].汕头:汕头大学,2008.
[21] liwka L, Wiktorska K, Suchocki P, et al. The Comparison of MTT and CVS Assays for the Assessment of Anticancer Agent Interactions[J].PLoS One,2016,11(5):e0155772.
[22] Colicos MA, Dash PK. Apoptotic morphology of dentate gyrus granule cells following experimental cortical impact injury in rats: possible role in spatial memory deficits[J].Brain Res,1996,739(1-2):120-131.
[23] Green DR. Means to an End: Apoptosis and other Cell Death Mechanisms [M].New York:Cold Spr Harbor Lab Press,2011:47-62.
[24] Grosse J, Warnke E, Wehland M,et al. Mechanisms of apoptosis in irradiated and sunitinib-treated follicular thyroid cancer cells[J].Apoptosis,2014,19(3):480-490.
[25] Fleisher TA. Apoptosis[J].Ann Allergy Asthma Immunol,1997,78(3):245-249.

