5-氨基酮戊酸光动力学诊断腹膜转移癌的研究进展
姬忠贺 刘 洋 Yutaka Yonemura,3 李 雁*
(1.首都医科大学附属北京世纪坛医院腹膜肿瘤外科, 北京 100038; 2.Peritoneal Surface Malignancy Center, Kishiwada Tokushukai Hospital, 4-27-1 Kamori-Cho, Kishiwada City, Osaka 596-8522, Japan; 3.NPO Organization to Support Peritoneal Surface Malignancy Treatment, 510 Fukushima-Cho, Shimogyou-Ku, Kyoto 600-8189, Japan)
腹膜转移癌(peritoneal metastasis, PM)一直被视作癌症的终末阶段,其主要治疗手段包括姑息手术或化学药物治疗(以下简称化疗),预后极差。近30年来,肿瘤学界建立了一套以细胞减灭术(cytoreductive surgery, CRS)加术中腹腔热灌注化疗(hyperthermic intraperitoneal chemotherapy, HIPEC)为主,联合术后腹腔化疗和系统化疗的综合治疗策略,可有效延长部分经谨慎选择的PM患者生存期[1]。腹膜癌指数(peritoneal cancer index, PCI)和细胞减灭程度(completeness of cytoreduction, CCR)是该综合治疗后最重要的独立生存预测因子[2]。然而,现行手术技术容易遗漏肉眼难以发现的隐匿部位PM或微小癌灶,即便经过彻底的CRS,术后腹膜复发率仍高达70%[3]。亟需发展新方法检测PM微小癌灶。近年来,氨基酮戊酸(aminolevulinic acid, ALA)光动力学诊断(photodynamic diagnosis, PDD)方法逐渐发展,并用于检测胃肠道恶性肿瘤、卵巢癌和恶性间皮瘤来源PM[4]。本综述旨在总结ALA-PDD的基本原理、基础和临床研究现状。
1 ALA-PDD的基本原理
1.1 原卟啉IX(protoporphyrin IX, PpIX)的生物合成与代谢
ALA是PpIX和亚铁血红素的天然前体。人体内,琥珀酰辅酶A和甘氨酸在ALA合成酶的催化下,于细胞线粒体合成ALA,被转移至细胞质,在限速酶ALA脱氢酶的催化下转化为胆色素原,再经系列酶促反应后生成PpIX。PpIX可在限速酶亚铁螯合酶的催化下转化为亚铁血红素,亦可由线粒体转入细胞质,并经细胞膜上的ABCG2外流转运子转移至细胞外(图1)。
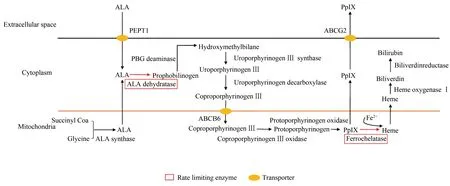
图1 原卟啉IX和亚铁血红素的生物合成途径Fig.1 Biosynthesis pathway of protoporphyrin IX and hemeALA:aminolevulinic acid;PpIX:protoporphyrin IX.
大量外源性ALA进入人体后,可经癌细胞膜表面的PEPT1内流转运子进入癌细胞,导致PpIX合成增加并在癌细胞内蓄积,在405 nm紫光激发下发出红色荧光[5]。
1.2 PpIX的选择性蓄积
PpIX在癌细胞和癌组织内的选择性蓄积是实现ALA-PDD的理论基础。PpIX在癌细胞中选择性蓄积的机制主要是酶学机制和转运子机制。
1.2.1 酶学机制
如图1所示,PpIX的合成受亚铁血红素含量反馈调控。而亚铁血红素合成途径中任何一种酶(尤其是限速酶)表达量的变化都有可能影响PpIX的含量,从而影响荧光信号。
亚铁螯合酶在PpIX选择性蓄积中的作用目前仍有争议。Kaneko等[6]的研究显示,在脑胶质瘤细胞中,亚铁螯合酶的活性较正常脑组织低。给予外源性ALA后,正常脑细胞线粒体中大量合成PpIX,并通过亚铁螯合酶代谢为亚铁血红素,从而使PpIX含量下降;而恶性胶质瘤细胞亚铁螯合酶含量低,导致PpIX在胞内蓄积。Hagiya等[7]研究显示,膀胱癌中亚铁螯合酶表达下调,给予外源性ALA后,膀胱癌细胞中PpIX含量升高。然而,Yonemura等[8]报道,PM中PpIX含量不依赖于亚铁螯合酶活性,该研究显示PM组织中亚铁螯合酶和ALA-PDD荧光状态无相关性,PM组织中亚铁螯合酶的表达量与PpIX含量无关。Hagiya等[9]报道,在5种胃癌细胞系中,亚铁血红素合成途径中涉及的八种酶的表达水平相同,且与ALA荧光无相关性。
1.2.2 转运子机制
ALA转运子的表达与代谢可促进PpIX选择性蓄积[10]。ALA内流转运子PEPT1和卟啉外流转运子ABCG2在调节细胞内PpIX水平上发挥重要作用[7, 9, 11]。
PEPT1表达于癌细胞膜,通过与协同转运蛋白H+/H3O+结合,摄取ALA[9]。在胃癌细胞系中上调PEPT1基因和下调ABCG2基因,可促进ALA诱导的PpIX特异性肿瘤蓄积[9]。Yonemura等[8]报道,PEPT1高表达的PM中,PpIX含量显著上升,PEPT1 mRNA的表达量与ALA-PDD荧光状态显著相关。
ABCG2是PpIX外流转运子,表达于癌细胞膜上,其表达量与ALA-PDD荧光状态显著相关。Yonemura等[8]报道,同时表达PEPT1 mRNA和ABCG2 mRNA的PM组织中,88.2%(15/17)ALA-PDD荧光阳性;ABCG2基因上调或PEPT1基因下调的PM组织中,75%(6/8)ALA-PDD荧光阴性。
临床标本中,PEPT1、ABCG2的免疫反应性与ALA-PDD荧光状态显著相关,提示临床上可通过免疫组织化学法检测组织中PEPT1和ABCG2的表达情况,筛选适用ALA-PDD的患者[8]。
ABCB6介导亚铁血红素合成中间产物粪卟啉原Ⅲ由细胞质转入线粒体。研究[7]显示ALA-PDD荧光阳性的膀胱癌标本中,ABCG6表达下调;胃癌细胞系中,ABCG6的表达量与ALA-PDD荧光无关[9]。
然而,部分ALA-PDD阳性PM,既不表达PEPT1也不表达ABCG2,而ALA-PDD阴性PM同时表达两者。目前,对PpIX如何跨线粒体膜返回细胞质知之甚少。其他未知的ALA内流转运子和卟啉外流转运子可能与PpIX蓄积相关。此外,亚铁离子的性质变化及环境因素如pH值、血供、淋巴回流等,可能与PM组织中PpIX选择性蓄积相关。
1.3 ALA-PDD检测PM的基本原理
大部分PM伴PEPT1过表达,大量外源性ALA处理后,ALA通过PEPT1转运至胞内,在ALA脱氢酶催化下激活亚铁血红素合成途径,癌细胞内PpIX含量增加,从而上调亚铁螯合酶和ABCG2的表达[8, 12]。部分PpIX在亚铁螯合酶作用下迅速代谢为亚铁血红素,与此同时,PpIX通过ABCG2从癌细胞内分泌至细胞外基质,导致PpIX在肿瘤局部基质内过量蓄积。阑尾黏液性肿瘤来源的PM中,肿瘤细胞成分相对较少,肿瘤细胞产生的黏液成分广泛分布于基质组织,PpIX在黏液中蓄积,PDD下发出强红色荧光。在膀胱癌[7]和胃癌细胞系[9]中,PEPT1基因上调和ABCG2基因下调,ALA-PDD状态取决于亚铁血红素的表达量。而PM中,PEPT1和ABCG2基因同时上调,PM组织中PpIX含量提高,呈ALA-PDD荧光阳性。
Yonemura等[12]报道,正常腹膜组织中,PEPT1 mRNA表达率为25%(10/40),ABCG2 mRNA表达率为48.4%(18/40),亚铁螯合酶mRNA表达率70.0%(28/40)。正常腹膜组织中PpIX含量显著低于PM组织[(0.007 3 ± 0.004 1)nm/mgvs(0.010 9 ± 0.003 1) nm/mg]。正常间皮细胞内,PpIX可通过ABCG2转运子分泌至腹腔,或通过亚铁螯合酶代谢为亚铁血红素,保持PpIX低含量。因此,正常腹膜组织中的PpIX含量不足以在紫光激发下发出红色荧光[8]。
2 ALA-PDD诊断PM的实验研究
多项动物实验研究[13-21]已验证了ALA-PDD诊断PM的安全性和可行性(表1)。这些研究涉及临床常见的PM类型,包括上皮性卵巢癌、结直肠癌、胃癌等,ALA给药方式为静脉给药、腹腔给药和口服给药。
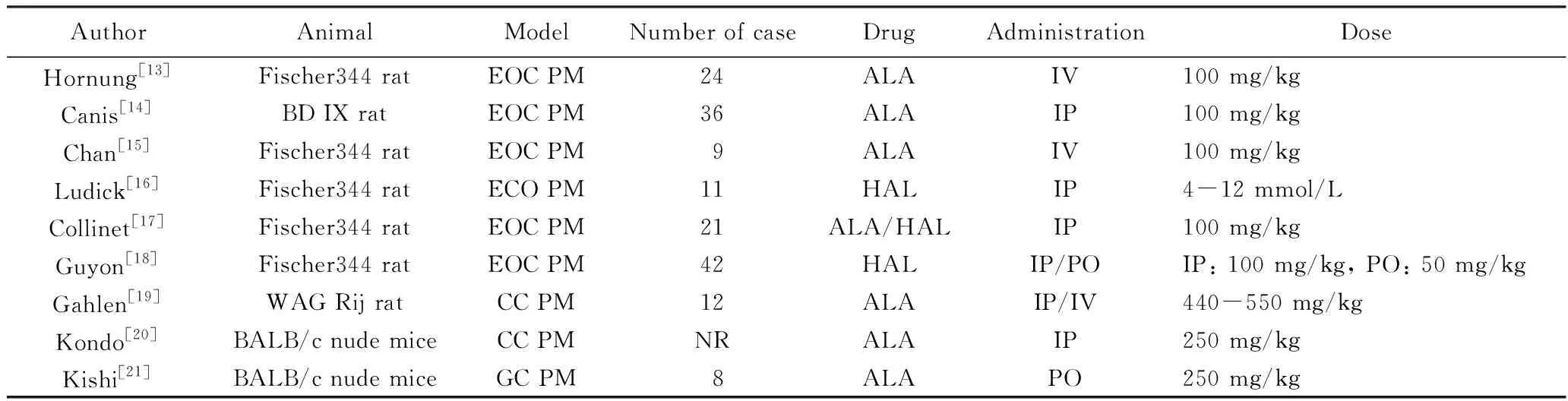
表1 ALA-PDD诊断PM的动物实验研究Tab.1 ALA-PDD for detecting PM in animal models
ALA: aminolevulinic acid;PDD:photodynamic diagnosis;PM: peritoneal metastasis;EOC: epithelial ovarian carcinoma;CC: colon cancer;GC: gastric cancer;HAL: hexaminolaevulinate;IV: intravenous;IP: intraperitoneal;PO: per os;NR: not reported.
Hornung等[13]报道,24只Fischer 344小鼠经腹腔注射卵巢癌细胞制作PM模型,接种4周后,静脉给予ALA 100 mg/kg,之后1、3、6、9 h时诊断性开腹,结果显示静脉给药1~3 h最适合PDD。
Canis等[14]将100 mg/kg ALA注射于上述PM大鼠模型腹腔内,3 h后在内镜下行PDD。对于肿瘤直径小于2 mm PM,白光下中位PM检出量为3(范围0~7),ALA-PDD下中位PM检出量是5(范围1~11)(P<0.000 8),ALA-PDD技术可以显著提高微小转移灶的检出率。
Lüdicke等[16]报道,在卵巢癌动物模型中,腹腔应用ALA衍生物——hexaminolaevulinate(HAL)检测微转移有可行性。无癌细胞的腹膜未显示荧光,与肿瘤结节明显区分开;PDD蓝光下检测到PM病灶数是标准明场下检出量的2倍,尤其是可检测到直径0.1~0.4 mm的PM微小病灶;通过后续严格的组织学验证,HAL荧光阳性PM无假阳性;该研究提示使用ALA的活性代谢物可进一步提高检出率。
Gahlen等[19]将ALA注射于结肠癌PM大鼠模型内,动物分为ALA腹腔给药(约440~550 mg/kg)和ALA静脉给药(100 mg/kg)两组,4 h后行PDD腹腔镜诊断。ALA腹腔给药组白光下发现142处肿瘤结节,而PDD能发现172处肿瘤结节;ALA静脉给药组白光下发现116处肿瘤结节,PDD能发现124处肿瘤结节;所有结节均经病理确诊为转移灶。该研究说明腹腔内给药的检出率更高。
3 ALA-PDD在PM中的临床研究
3.1 ALA PDD方法及细胞减灭术ALA导航
给予ALA前,应通过抗体筛查和Hoesch检测,排除卟啉症患者[22]。ALA-PDD临床研究有3种给药形式:腹腔、静脉和口服给药。
腹腔给药后,ALA既可以直接渗透至深部种植的癌细胞,也可被腹膜淋巴管和血管吸收经循环到达PM组织,医生需要等几个小时后才能开始ALA-PDD,一般建议在腹腔给予ALA 3~5 h后进行ALA-PDD[23]。腹腔应用ALA后腹腔镜荧光检测比静脉应用能获得更高的腹腔内剂量,能更高效的检测到微小或隐匿PM病灶[18]。
静脉给药的通常剂量为10~30 mg/kg,行ALA-PDD诊断时PM最大荧光出现在静脉给药后1~3 h之间。
口服给药的优点是无创应用、便捷安全,通常将20 mg/kg 5-ALA溶解于50~100 mL橙汁中,术前2 h服用。开腹后,首先明场下评估PM大小和分布,然后关闭手术室灯光,用氙灯照射375~445 nm的紫光作为激发光行PDD,观察腹腔所有区域。接着行肿瘤细胞减灭术和腹腔热灌注化疗。彻底清除肉眼可见肿瘤后,再次使用ALA-PDD寻找残余瘤。
不同给药方式的显像时间不同,主要是由显像原理决定的。口服5-ALA后,迅速被上消化道吸收入血,血浆5-ALA浓度1 h内达峰值,2~4 h后,PpIX在正常组织,尤其是胃肠黏膜中蓄积;接着正常组织中的PpIX逐步代谢,而肿瘤细胞中会维持一段时间;6 h后,正常组织和肿瘤组织中PpIX浓度差异达峰值[24]。由此可见,显像时间与患者胃肠功能、代谢状态相关。一般术前2~3 h口服给药,术中可获得较好的检测效果。静脉给药省略了药物吸收入血的过程,给药约2 h后,PpIX浓度即达峰值。一般行ALA-PDD前1~3 h内给药,可获得最大荧光。系统给药(口服、静脉)占用手术室时间短、操作便捷、监护简单,尤其是口服给药被广泛采用,其不足之处在于,皮肤及其他脏器药物浓度高,检测假阴性率高、诊断灵敏度一般,易发生不良反应。
腹腔给药与系统给药方式不同,系通过腹膜表面直接渗透进入腹膜及肿瘤细胞内,药物入血少,可获得较高的腹腔药物剂量,不良反应少,但是直接渗透耗时较长,一般在腹腔给予ALA后3~5 h行PDD检测。腹腔给药大部分直接渗透,少量进入血液循环,因此对腹膜深层的肿瘤细胞检测效果一般。
3.2 ALA PDD诊断不同来源PM试验结果
已经有多项ALA-PDD检测PM的临床试验[4,8,13,25-26](表2)。其中4项研究中ALA采用口服给药,1项研究为ALA腹腔给药。ALA剂量范围为10~30 mg/kg。腹腔给药孵育时间为5 h,而口服给药仅需2~3 h。灵敏度范围为46%~100%,特异度为100%。
ALA-PDD检测PM的总检出率为56.6%(81/143),PDD能够提高大部分卵巢癌(84.6%)、间皮瘤(62.5%)、胰腺癌(75.0%)标本的转移结节检出率。此外,在60%的结肠癌PM中,可检测到转移结节。在胃癌PM和阑尾黏液肿瘤中,PDD检测率较低,分别为25.7%和16.4%,详见表3[8]。
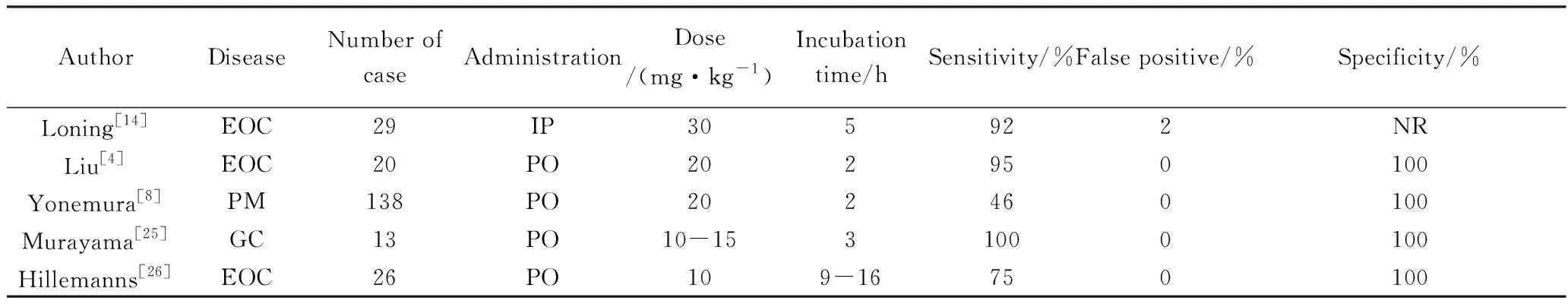
表2 ALA-PDD检测腹膜转移临床试验结果Tab.2 ALA-PDD for detecting PM in clinical trials
ALA: aminolevulinic acid;PDD:photodynamic diagnosis;EOC: epithelial ovarian carcinoma;PM: peritoneal metastasis;GC: gastric cancer;IP: intraperitoneal;PO: per os;NR: not reported.
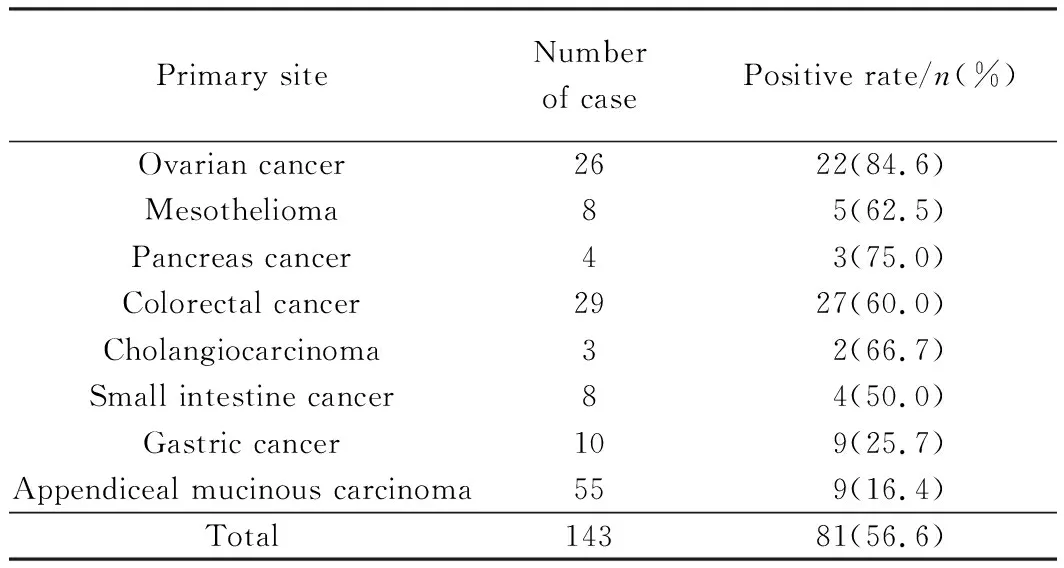
表3 不同原发部位PM行ALA-PDD的阳性率[8]Tab.3 Positive rate of ALA-PDD for detecting PM ofdifferent origins
PM: peritoneal metastasis;ALA: aminolevulinic acid;PDD:photodynamic diagnosis.
ALA荧光取决于PM组织中光敏化PpIX的含量(表4)[8]、肿瘤细胞在腹膜上的定位和术前化疗。位于深部腹膜下层组织的癌细胞无法被PDD检出。术前化疗后,PM变性,ALA荧光强度下降。光敏化PpIX在肿瘤中特异性蓄积量与肿瘤类型有关,胃癌PM和阑尾黏液腺癌中PpIX含量显著低于卵巢癌、胰腺癌和间皮瘤。
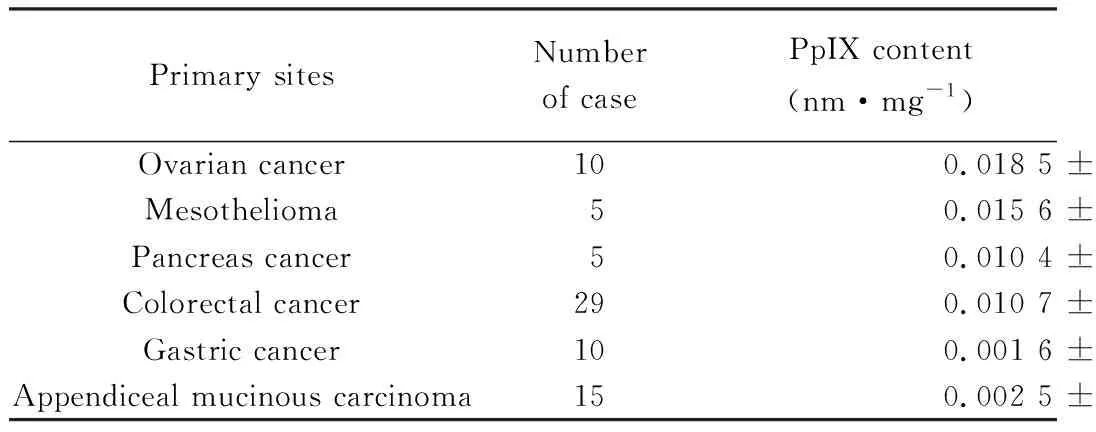
表4 不同原发部位PM中PpIX含量[8]Tab.4 PpIX contents in PM of different origins
PM: peritoneal metastasis;PpIX: protoporphyrin IX.
4 ALA PDD的安全性和可行性
口服ALA不良反应罕见,因为ALA是固有分子,并能通过卟啉/亚铁血红素途径快速代谢为PpIX和亚铁血红素[4, 8]。Yonemura等[8]报道,138例患者行ALA-PDD,均口服ALA 20 mg/kg,仅1例(0.7%)出现恶心和呕吐。Kamp等[27]报道,术后转氨酶和白细胞较术前无明显变化。84例患者中,5例暴露于日光下,出现了短暂性红斑。皮肤卟啉症由于光毒性,表现为多种皮肤症状,ALA-PDD护理过程中应避光。卟啉症的诊断依靠检测尿、全血和血浆中的卟啉相关代谢物,个别病例中需酶活性检测和基因分析。患者诊断急性卟啉症后,应立即给予大量葡萄糖静脉滴注,静脉注射血色素或亚铁血红素-精氨酸可有效改善临床症状和异常卟啉代谢。此外,Yonemura等[8]报道ALA导航CRS术后合并症发生率与常规CRS相似。
5 ALA-PDD与PM预后
Kamp等[27]在84例接受脑转移ALA导航手术的患者中,分析了ALA诱发荧光状态与局部复发之间的相关性。脑转移手术切除后,5-ALA诱发荧光阳性可能为脑部局部进展的危险因素。Guyotat等[28]系统研究了5-ALA导航技术在恶性脑胶质瘤手术中的应用,在52例回顾性研究中发现,无荧光残留和可疑荧光残留组生存期显著优于荧光残留组。进一步的前瞻性研究显示,ALA导航手术组无进展生存期显著优于常规手术组,两组总生存期差异无统计学意义。Rink等[29]对44篇PDD在膀胱肿瘤中的应用研究进行系统分析发现,PDD组与常规白光组相比,无复发生存期平均延长20%。Ushimaru等[30]对113例进展期胃癌患者行腹腔镜下ALA-PDD,发现ALA-PDD检测腹膜转移阳性患者3年生存期显著低于阴性患者。此外,该研究显示ALA-PDD诊断腹膜转移阳性且肉眼诊断阴性的患者,经新辅助化疗加手术治疗后,其生存情况与腹膜转移阴性患者差异无统计学意义,并显著优于ALA-PDD和肉眼同时诊断阳性患者。转移灶周围的部分无瘤组织有ALA衍生荧光,可能会导致无意识的根治性扩大切除,ALA阳性转移灶比ALA阴性转移灶切除更彻底可能是延长患者总生存期和无复发生存期的原因之一。
在ALA阳性PM中,与常规明场下手术相比,ALA-PDD能提高彻底切除率,腹膜复发率可能下降。然而,在消化道肿瘤中,目前研究主要关注于PDD诊断PM灵敏度和特异度,目前尚无ALA荧光导航手术下,CRS术后荧光残余状态与复发及生存相关性的研究报道。
6 结语
ALA-PDD可检测卵巢癌、胰腺癌、胆囊癌、小肠癌、结肠癌和间皮瘤来源的PM微小病灶,方法安全、可行,可发现明场下手术容易遗漏的隐匿PM或微小病灶。PEPT1和ABCG2基因同时表达,是PpIX癌组织内蓄积的关键环节。术前检测PEPT1和ABCG2表达,可用于筛选适合ALA-PDD的患者。
ALA-PDD技术在隐匿PM或微小癌灶检测方面优势明显,但仍存在以下几点不足:1)技术方法尚无规范,在给药方式、检测时间等方面无统一标准;2)该技术与患者预后的关系尚不明确;3)检测深度不足,阻碍了该技术发展;4)背景组织自发荧光影响检测灵敏度和特异度。
因此,ALA-PDD技术优势明显,临床应用前景广阔,亟需针对以上不足开展相关基础和临床研究。
[1] Li Y, Zhou Y F, Liang H, et al. Chinese expert consensus on cytoreductive surgery and hyperthermic intraperitoneal chemotherapy for peritoneal malignancies[J]. World J Gastroenterol, 2016, 22(30): 6906-6916.
[2] Yonemura Y, Canbay E, Li Y, et al. A comprehensive treatment for peritoneal metastases from gastric cancer with curative intent[J]. Eur J Surg Oncol, 2016, 42(8): 1123-1131.
[3] Yan T D, Black D, Savady R, et al. Systematic review on the efficacy of cytoreductive surgery combined with perioperative intraperitoneal chemotherapy for peritoneal carcinomatosis from colorectal carcinoma[J]. J Clin Oncol, 2006, 24(24): 4011-4019.
[4] Liu Y, Endo Y, Fujita T, et al. Cytoreductive surgery under aminolevulinic acid-mediated photodynamic diagnosis plus hyperthermic intraperitoneal chemotherapy in patients with peritoneal carcinomatosis from ovarian cancer and primary peritoneal carcinoma: results of a phase I trial[J]. Ann Surg Oncol, 2014, 21(13): 4256-4262.
[5] Yonemura Y, Endo Y, Canbay E, et al. Photodynamic detection of peritoneal metastases using 5-aminolevulinic acid (ALA)[J]. Cancers (Basel), 2017, 9(3): 23.
[6] Kaneko S, Kaneko S. Fluorescence-guided resection of malignant glioma with 5-ALA[J]. Int J Biomed Imaging, 2016, 2016: 6135293.
[7] Hagiya Y, Fukuhara H, Matsumoto K, et al. Expression levels of PEPT1 and ABCG2 play key roles in 5-aminolevulinic acid (ALA)-induced tumor-specific protoporphyrin IX (PpIX) accumulation in bladder cancer[J]. Photodiagnosis Photodyn Ther, 2013, 10(3): 288-295.
[8] Yonemura Y. Selection of patients by membrane transporter expressions for aminolevulinic acid (ALA)-guided photodynamic detection of peritoneal metastases[J].Int J Sci, 2015, 4(9): 66-77.
[9] Hagiya Y, Endo Y, Yonemura Y, et al. Pivotal roles of peptide transporter PEPT1 and ATP-binding cassette (ABC) transporter ABCG2 in 5-aminolevulinic acid (ALA)-based photocytotoxicity of gastric cancer cells in vitro[J]. Photodiagnosis Photodyn Ther,2012, 9(3): 204-214.
[10] Toyoda Y, Hagiya Y, Adachi T, et al. MRP class of human ATP binding cassette (ABC) transporters: historical background and new research directions[J]. Xenobiotica, 2008, 38(7-8): 833-862.
[11] Rodriguez L, Batlle A, Di Venosa G, et al. Study of the mechanisms of uptake of 5-aminolevulinic acid derivatives by PEPT1 and PEPT2 transporters as a tool to improve photodynamic therapy of tumours[J]. Int J Biochem Cell Biol, 2006, 38(9): 1530-1539.
[12] Yonemura Y, Canbay E, Ishibashi H, et al. 5-Aminolevulinic acid fluorescence in detection of peritoneal metastases[J]. Asian Pac J Cancer Prev, 2016, 17(4): 2271-2275.
[13] Hornung R, Major A L, McHale M, et al. In vivo detection of metastatic ovarian cancer by means of 5-aminolevulinic acid-induced fluorescence in a rat model[J]. J Am Assoc Gynecol Laparosc, 1998, 5(2): 141-148.
[14] Canis M, Botchorishvili R, Berreni N, et al. 5-aminolevulinic acid-induced (ALA) fluorescence for the laparoscopic diagnosis of peritoneal metastasis. AST An experimental study[J]. Surg Endosc, 2001, 15(10): 1184-1186.
[15] Chan J K, Monk B J, Cuccia D, et al. Laparoscopic photodynamic diagnosis of ovarian cancer using 5-aminolevulinic acid in a rat model[J]. Gynecol Oncol, 2002, 87(1): 64-70.
[16] Lüdicke F, Gabrecht T, Lange N, et al. Photodynamic diagnosis of ovarian cancer using hexaminolaevulinate: a preclinical study[J]. Br J Cancer, 2003, 88(11): 1780-1784.
[17] Collinet P, Sabban F, Cosson M, et al. Laparoscopic photodynamic diagnosis of ovarian cancer peritoneal micro metastasis: an experimental study[J]. Photochem Photobiol, 2007, 83(3): 647-651.
[18] Guyon L, Farine M O, Lesage J C, et al. Photodynamic therapy of ovarian cancer peritoneal metastasis with hexaminolevulinate: a toxicity study[J]. Photodiagnosis Photodyn Ther, 2014, 11(3): 265-274.
[19] Gahlen J, Pietschmann M, Prosst R L, et al. Systemicvslocal administration of delta-aminolevulinic acid for laparoscopic fluorescence diagnosis of malignant intra-abdominal tumors: Experimental study[J]. Surg Endosc, 2001, 15(2): 196-199.
[20] Kondo Y, Murayama Y, Konishi H, et al. Fluorescent detection of peritoneal metastasis in human colorectal cancer using 5-aminolevulinic acid[J]. Int J Oncol, 2014, 45(1): 41-46.
[21] Kishi K, Fujiwara Y, Yano M, et al. Staging laparoscopy using ALA-mediated photodynamic diagnosis improves the detection of peritoneal metastases in advanced gastric cancer[J]. J Surg Oncol, 2012, 106(3): 294-298.
[22] Lamon J, With T K, Redeker A G. The Hoesch test: bedside screening for urinary porphobilinogen in patients with suspected porphyria[J]. Clin Chem, 1974, 20(11): 1438-1440.
[23] Loning M, Diddens H, Kupker W, et al. Laparoscopic fluorescence detection of ovarian carcinoma metastases using 5-aminolevulinic acid-induced protoporphyrin IX[J]. Cancer, 2004, 100(8): 1650-1656.
[24] Koizumi N, Harada Y, Minamikawa T, et al. Recent advances in photodynamic diagnosis of gastric cancer using 5-aminolevulinic acid[J]. World J Gastroenterol, 2016, 22(3): 1289-1296.
[25] Murayama Y, Ichikawa D, Koizumi N, et al. Staging fluorescence laparoscopy for gastric cancer by using 5-aminolevulinic acid[J]. Anticancer Res, 2012,32(12): 5421-5427.
[26] Hillemanns P, Wimberger P, Reif J, et al. Photodynamic diagnosis with 5-aminolevulinic acid for intraoperative detection of peritoneal metastases of ovarian cancer: A feasibility and dose finding study[J]. Lasers Surg Med, 2017, 49(2): 169-176.
[27] Kamp M A, Fischer I, Buhner J, et al. 5-ALA fluorescence of cerebral metastases and its impact for the local-in-brain progression[J]. Oncotarget, 2016, 7(41): 66776-66789.
[28] Guyotat J, Pallud J, Armoiiry, et al. 5-aminolevulinic acid-protoporphyrin IX fluorescence-guided surgery of high-grade gliomas: a systematic review[J]. Adv Tech Stand Neurosurg, 2016, 43: 61-90.
[29] Rink M, Babjuk M, Catto J W, et al. Hexyl aminolevulinate-guided fluorescence cystoscopy in the diagnosis and follow-up of patients with non-muscle-invasive bladder cancer: a critical review of the current literature[J]. Eur Urol, 2013, 64(4): 624-638.
[30] Ushimaru Y, Fujiwara Y, Kishi K, et al. Prognostic significance of basing treatment strategy on the results of photodynamic diagnosis on advanced gastric cancer[J]. Ann Surg Oncol, 2017, 24(4): 983-989.

