35例同时性多原发结直肠癌患者临床诊疗分析
汪 栋 金 岚 姚宏伟 王 今 赵晓牧 吴国聪 杨盈赤 张忠涛
(国家消化系统疾病临床医学研究中心普外分中心 首都医科大学附属北京友谊医院普外科 首都医科大学普通外科学系, 北京 100050)
多原发结直肠癌(multiple primary colorectal carcinoma,MPCC)是指结直肠上发生的2个或2个以上的、相互独立的,并除外转移的原发癌灶;同时或在6个月以内发现2个或2个以上的原发癌灶,定义为同时性多原发结直肠癌(synchronous colorectal carcinoma,SCRC);非同时性且间隔时间在6个月以上,发现2个或2个以上的原发癌灶称异时性多原发结直肠癌(metachronous colorectal cancer,MCRC)[1-3]。随着结直肠癌的病例日益增加,MPCC的发病率有增加趋势,也更加受到外科医生的重视,在MPCC中SCRC所占比例较高[4],且术前诊断直接影响治疗方式的选择从而影响患者预后[5]。本文回顾分析2008年1月至2016年12月期间首都医科大学附属北京友谊医院收治的SCRC患者的临床资料及病理特征,并结合随访资料进行预后分析。
1 材料与方法
1.1 病例资料
2008年1月至2016年12月期间首都医科大学附属北京友谊医院普外科共收治结直肠癌患者1 692例。根据上述SCRC诊断标准利用计算机病案管理系统筛选所有结直肠癌患者,同时排除合并严重器质性病变以及病历资料不全的患者,共35例SCRC患者纳入本研究,其中男性23例,女性12例,男女比1.69∶1,发病年龄56~82岁,平均年龄(68.11±10.3)岁,13例伴有多发结直肠腺瘤性息肉。所有SCRC患者术前经影像学、结肠镜或术中探查发现,并经术中病理或术后病理学证实为结肠癌。
1.2 诊断标准
本研究诊断SCRC的具体标准如下[6]:①每个结直肠肿瘤病灶均经病理学检查证实为恶性,且除外局部浸润、转移和复发;②所有结直肠癌病灶均于同一时间诊断或诊断的相隔时间在6个月以内;③肿瘤病灶须不在同一肠段或邻近肠段,如在同一肠段,必须是不同病理类型或正常肠壁间隔>2 cm;④肿瘤病灶特征:每个结直肠肿瘤病灶有各自独特的病理学形态和特有的转移途径;⑤排除家族性结肠息肉病和溃疡性结肠炎癌变的结肠癌患者。
1.3 随访情况
通过电话回访、通讯软件、门诊复查等方式随访患者的复发及生存情况,治疗后1年内每3个月随访1次,1~2年内每6个月随访1次,2年后改为1年1次,随访时间截至2016年12月。临床评价指标总生存期定义为患者开始治疗至死亡或最后失访的时间,其中失访者按截尾数据计算。
1.4 统计学方法
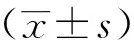
2 结果
2.1 35例SCRC患者诊断情况
35例患者中,34例为一次诊断为SCRC,1例为初次手术后3个月二次诊断为SCRC。所有患者初诊时均接受腹部增强CT检查。23例接受钡灌肠检查,14例诊断为SCRC,正确率为60.9%;30例患者完成全结直肠的电子结肠镜检查,其中21例患者诊断为SCRC,准确率为70%,另外5例患者均为术前出现急性肠梗阻,2例因急诊手术而未接受结肠镜检查,3例虽然术前放置结肠支架,梗阻近端肠道准备差,无法行全结直肠检查;结合多种影像学检查及结肠镜结果,32例患者诊断为SCRC,检出率为91.4%;3例患者经术中触诊探查、结肠镜检查及剖视离体标本,并结合术中冰冻病理补充诊断为SCRC;1例患者先接受乙状结肠癌根治术,术后3个月再次出现便血,结肠镜检查见横结肠肿瘤。
2.2 35例SCRC患者病理特征
2.2.1 患者瘤灶分布及组合
本研究35例患者中,双原发癌34例,三原发癌1例,肿瘤病灶共71处,其中盲肠2处,升结肠17处,横结肠9处,降结肠10处,乙状结肠22处,直肠11处,分别占2.9%、23.9%、12.7%、14.1%、30.9%、15.5%。瘤灶分布组合如下:盲肠+升结肠2例,升结肠+升结肠1例,升结肠+降结肠3例,升结肠+横结肠4例,升结肠+乙状结肠3例,升结肠+直肠3例,横结肠+乙状结肠4例,横结肠+直肠1例,降结肠+乙状结肠5例,降结肠+直肠1例,乙状结肠+乙状结肠2例,乙状结肠+直肠5例,直肠+乙状结肠+降结肠1例。
2.2.2 患者瘤灶病理类型及组合
71处SCRC瘤灶中腺癌最多,有50处(70.4%),黏液腺癌次之,有15处(21.2%)。对50处腺癌病灶分化程度进行分析显示,中分化癌最多,有27处(38.0%),瘤灶详细病理类型以及腺癌病灶分化程度详见表1。进一步对瘤灶在患者中的病理类型组合进行了分析,结果发现腺癌+腺癌组合的患者最多,有14例,其次是腺癌+黏液腺癌组合,有13例。本研究中唯一1例三发癌患者的瘤灶均为腺癌。其他瘤灶病理类型组合详见表1。
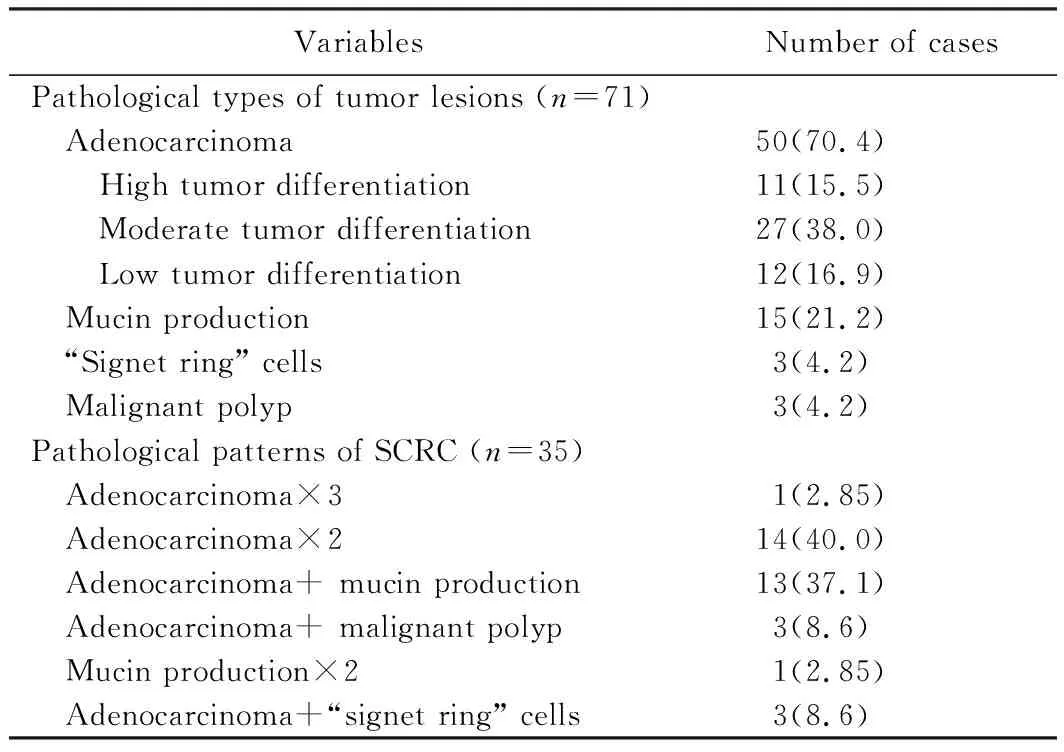
表1 同时性多原发结直肠癌患者的临床病理资料Tab. 1 Clinicopathological features of thepatient with SCRC n(%)
SCRC:the synchronous colorectal carcinoma.
2.2.3 患者病理分期
按照第7版国际抗癌联盟结直肠癌TNM分期标准[7],对35例SCRC患者按照最为严重的肿瘤病灶进行分期,其中Ⅰ期3例,Ⅱ期11例,Ⅲ期19例,Ⅳ期2例。详细TNM分期情况详见表2。
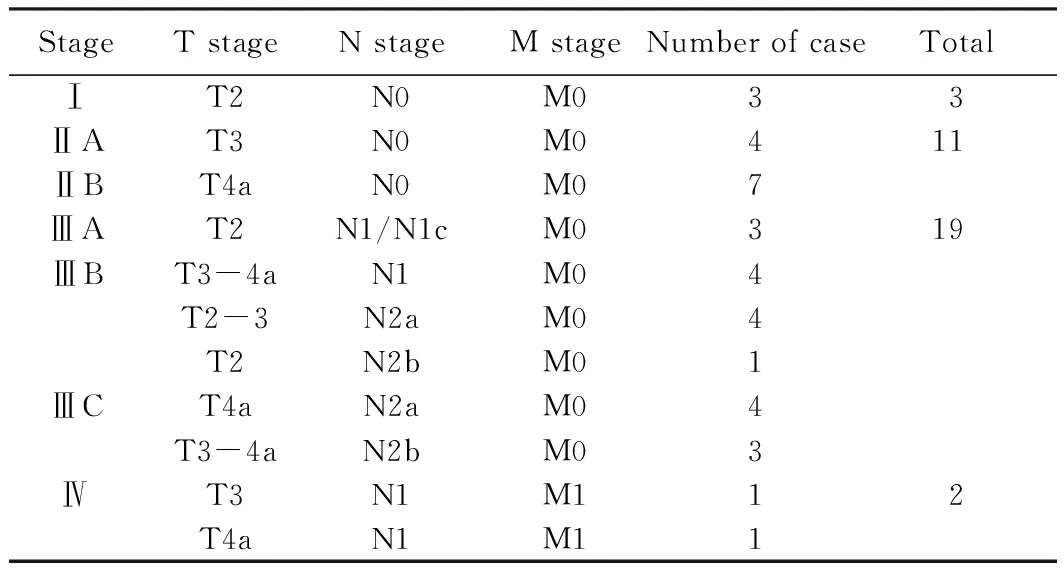
表2 35例SCRC患者TNM分期情况Tab.2 TNM stages of the 35 patients with SCRC
Stage classification is based America Joint Committee on Cancer Staging Manual, 7th edition[7];SCRC: synchronous colorectal carcinoma.
2.3 治疗方式及合并症
35例患者中除2例Ⅳ期患者未接受手术治疗外,1例家属放弃治疗,余32例患者均接受手术治疗。32例患者手术方式如下:标准肠癌根治术5例,扩大肠癌根治术10例,分段肠癌根治术10例,全/次全结肠切除术7例。患者术后合并症情况如下:切口感染3例,吻合口瘘2例,腹腔感染2例,肺炎2例,腹腔出血1例,肠梗阻3例,尿潴留2例。
2.4 35例SCRC患者预后情况
对35例SCRC患者进行随访,随访截至2016年12月,完整随访32例,且均为接受手术患者,失访3例,失访率为9.4%。32例术后完整随访患者,随访时间4~101个月,中位随访时间72.4个月。术后5年生存率为59.4%(19/32),复发率为28.1%(9/32)。肿瘤复发有2例发生在术后1年内,4例发生在2年内,2例发生在术后3年内,1例发生在术后4年内。单因素分析显示,年龄(≤68岁/>68岁)、肠梗阻(有/无)、肿瘤分期(Ⅲ~Ⅳ/Ⅰ~Ⅱ)、病理类型(未分化癌或黏液腺癌/其他病理类型)与5年内肿瘤复发相关(P值分别为0.018、 0.015、0.044、0.015)。而患者性别、手术方法、病灶数目、病灶分布、肠息肉与肿瘤复发无关。多因素Logistic分析显示,Ⅲ~Ⅳ期(OR=20.137;95%CI=5.289~101.331,P<0.001)、未分化癌或黏液腺癌(OR=11.275;95%CI=2.562~45.831,P=0.001)是SCRC术后5年内出现复发的独立危险因素。
3 讨论
SCRC总体发病率较低,而SCRC中以双原发的SCRC常见[6,8]。研究[9]表明,与单发CRC相比,SCRC患者平均发病年龄较高,且左侧结肠更易发生SCRC。本研究纳入的SCRC患者平均年龄为(68.11±10.3)岁,同样显示高龄可能是SCRC的危险因素之一。SCRC患者中的性别倾向有较为统一的结论,认为与单发CRC相比男性是一个高危因素[10]。另外一些公认SCRC的危险因素有炎性肠病、遗传性非息肉病性大肠癌(hereditary nonpolyposis colorectal cancer, HNPCC)、家族性腺瘤息肉病等,值的指出的是SCRC合并结直肠腺瘤性息肉比例较高[11],本研究中合并结直肠腺瘤性息肉的比例达到54.3%(19/35),近些年文献[12]显示合并结直肠锯齿状腺瘤的患者尤其应该引起重视。
以往SCRC术前术中漏诊率较高[13]。术前完善的检查是降低漏诊的首要条件。随着电子结肠镜检查的普及应用,一定程度上克服了SCRC第二病灶往往较小、隐匿,难以发现的问题,提高了术前诊断率[14]。本研究中21例患者通过结肠镜诊断为SCRC,诊断准确率为70%,与文献结果[14]类似。对于术前由于梗阻、出血或其他原因无法接受结肠镜检查或肠道条件不满意的患者,术中探查则尤为重要[3]。尤其是对SCRC好发部位,如乙状结肠、直肠和右半结肠应做重点探查,并且对于触诊探查困难的肝曲、脾曲结肠也应引起重视[3]。对于术前未行结肠镜检查的患者,术中若有条件可行术中结肠镜探查,明确是否有其他病灶。对于切除的标本,一定要切开仔细检查,本研究中即有1例患者因切开标本检查时发现意外病灶,冰冻病理证实为恶性后,考虑其距离切缘不足2 cm,术中补充切除肠管处理。随着目前虚拟肠镜(positron emission tomography-computed tomography,PET-CT)等新技术的应用,SCRC的术前诊断有望进一步提高。但作为临床医师,应该加强对SCRC的认识,在结直肠癌的诊断中发现单一癌灶后仍不能放松警惕,对于具有SCRC高危因素的患者,注重术前结肠镜的检查,利用CT、MR等影像学检查,并强调术中全面探查,结合冰冻检查和术中肠镜,才能尽可能减少漏诊。
针对SCRC的治疗,首选是外科手术治疗,但外科治疗原则国内外暂无明确统一的手术标准,具体的手术方式由于肿瘤位置、数目、范围的不同而多种多样,有扩大结直肠癌根治性切除术、分段结直肠癌根治性切除术、结肠全/次全切除术,在学界尚有争议[15-16],而且专门研究各种手术方式选择、预后差异等问题的研究较少。笔者总结经验认为,如果SCRC患者肿瘤位于同一肠段,间隔位置较近,一般在5 cm至10 cm范围内,可按照单发结直肠癌的标准来进行根治性切除;如果SCRC患者肿瘤位置间隔超过10 cm,但仍在两个连续的肠段范围内,可考虑进行扩大性结直肠癌根治性切除术;如果SCRC患者肿瘤间隔距离已经横跨1个及以上的肠段,根据血供情况,有条件的患者可接受分段结直肠癌根治性切除术治疗。至于全结肠或次全结肠切除术,主要应用SCRC有遗传背景,如遗传性非息肉病等的患者,应考虑接受该术式治疗,以最大限度减少术后肿瘤的复发及再发[3]。为提高患者生活质量,通过外科手术的分段结直肠癌根治性切除术、或扩大性结直肠癌根治性切除等手术方式联合同期肠管吻合的安全性和操作性已经被很多学者所接受[17]。但SCRC患者造口与否的主要影响因素是如果SCRC其中之一的肿瘤位于低位直肠,为保证根治,可能合并造口,或由于吻合口血供问题,需行造口。有研究[5]显示,在围术期的合并症发生率上,SCRC患者要高于单发结肠癌患者,这可能与SCRC患者往往为高龄,且手术切除范围较大有关,同时一些其他的可能的因素也会影响围术期合并症的发生,比如术中应用结肠镜探查增加感染概率等。
本研究中,完全腹腔镜或腹腔镜辅助的SCRC切除比例约为56.3%(18/32),手术顺利,虽然尚无腹腔镜治疗SCRC的大宗报道,但结合本中心的经验,如果术前明确对肿瘤的位置,侵犯范围有较为准确的判断,腹腔镜技术完全可以在SCRC的外科治疗中发挥重要作用,减少手术创伤,加快患者康复。针对部分SCRC中相对于主要病灶的其他病灶肿瘤较小,腹腔镜下定位困难的问题,本研究中6例患者采取了术前结肠镜下印度墨汁染色的定位肿瘤方法,方便腹腔镜下明确切除范围,保证切除的根治性。
SCRC的预后问题在学界存在争论。有学者[18]认为与单发结直肠癌相比,SRCR的生存期和单发结肠癌类似,但也有文献报道了完全相反的结论, 一项前瞻性研究[19]显示SCRC的预后较单发结肠癌明显更差。究其原因,除了可能与样本量、随访时间等统计学因素有关之外,诊断的正确性、治疗的合理性、随诊的及时性等医疗因素和遗传背景、基因突变等生物因素也在影响着患者的预后。结合本中心的治疗经验,笔者认为,在正确诊断、保证手术的根治性基础上,术后再予以积极的辅助治疗,总体的生存期还是令人满意的,可以达到单发结肠癌类似的效果。近年来有文献[3,20]显示微卫星不稳定性与SCRC患者的预后相关,这可能是错配修复基因突变所致复制错误引起的简单重复序列增加或丢失,使得肠道微环境不稳定,进而导致SCRC的发病。所以应在未来的研究中,总结SCRC的临床特点及高危因素,从分子生物学层次积极探索病因,以达到有效预防、早期诊断和规范治疗的目的,改善SCRC的预后。
SCRC的漏诊率较高,临床医师应提高对此病的认识,注意联合影像及内镜等多种检查,尤其是结肠镜检查,提高该病的检出率[21]。根据患者肿瘤具体情况,选择合适的手术方式,配合积极术后辅助治疗,可能取得较为满意的治疗效果。
[1] Torre L A, Bray F, Siegel R L, et al. Global cancer statistics, 2012 [J]. CA Cancer J Clin, 2015, 65(2): 87-108.
[2] Pajares J A, Perea J. Multiple primary colorectal cancer: individual orfamilial predisposition? [J]. World J Gastrointest Oncol, 2015, 7(12): 434-444.
[3] Lam A K, Chan S S, Leung M. Synchronous colorectal cancer: clinical, pathological and molecular implications [J]. World J Gastroenterol, 2014, 20(22): 6815-6820.
[4] Lee J W, Kim J W, Kim N K. Clinical characteristics of colorectal cancer patients with a second primary cancer [J]. Ann Coloproctol, 2014, 30(1): 18-22.
[5] van Leersum N J, Aalbers A G, Snijders H S, et al. Synchronous colorectal carcinoma: a risk factor in colorectal cancer surgery [J]. Dis Colon Rectum, 2014, 57(4): 460-466.
[6] Mulder S A, Kranse R, Damhuis R A, et al. Prevalence and prognosis of synchronous colorectal cancer: a Dutch population-based study [J]. Cancer Epidemiol, 2011, 35(5): 442-447.
[7] Amin M B, Edge S, Greene F, et al. AJCC cancer staging manual[M]. 7th ed. Germany: Springer, 2010:1726-1727.
[8] 牛丽云, 张峻岭, 刘天野, 等. 结直肠同时性多原发癌的临床病理特征和预后分析 [J]. 中华胃肠外科杂志, 2018, 21(1): 41-45.
[9] Lee B C, Yu C S, Kim J, et al. Clinicopathological features and surgical options for synchronous colorectal cancer [J]. Medicine (Baltimore), 2017, 96(9): e6224.
[10] Lam A K, Carmichael R, Gertraud Buettner P, et al. Clinicopathological significance of synchronous carcinoma in colorectal cancer [J]. Am J Surg, 2011, 202(1): 39-44.
[11] Nikoloudis N, Saliangas K, Economou A, et al. Synchronous colorectal cancer [J]. Tech Coloproctol, 2004, 8 Suppl 1: s177-179.
[12] Mohammadi M, Kristensen M H, Nielsen H J, et al. Qualities of sessile serrated adenoma/polyp/lesion and its borderline variant in the context of synchronous colorectal carcinoma [J]. J Clin Pathol, 2012, 65(10): 924-927.
[13] Abe S, Terai T, Sakamoto N, et al. Clinicopathological features of nonpolypoid colorectal tumors as viewed from the patients’ background [J]. J Gastroenterol, 2006, 41(4): 325-331.
[14] Kato T, Alonso S, Muto Y, et al. Clinical characteristics of synchronous colorectal cancers in Japan [J]. World J Surg Oncol, 2016, 14(1): 272-279.
[15] Malapelle U, De Stefano A, Carlomagno C, et al. Next-generation sequencing in the genomic profiling of synchronous colonic carcinomas: comment on Li et al (2015) [J]. J Clin Pathol, 2015, 68(11): 946-947.
[16] Easson A M, Cotterchio M, Crosby J A, et al. A population-based study of the extent of surgical resection of potentially curable colon cancer [J]. Ann Surg Oncol, 2002, 9(4): 380-387.
[17] Holubar S D, Wolff B G, Poola V P, et al. Multiple synchronous colonic anastomoses: are they safe? [J]. Colorectal Dis, 2010, 12(2): 135-140.
[18] Huang C S, Yang S H, Lin C C, et al. Synchronous and metachronous colorectal cancers: distinct disease entities or different disease courses? [J]. Hepatogastroenterology, 2015, 62(140): 838-842.
[19] Nosho K, Kure S, Irahara N, et al. A prospective cohort study shows unique epigenetic, genetic, and prognostic features of synchronous colorectal cancers [J]. Gastroenterology, 2009, 137(5): 1609-1620.e1601-1603.
[20] Bae J M, Cho N Y, Kim T Y, et al. Clinicopathologic and molecular characteristics of synchronous colorectal cancers: heterogeneity of clinical outcome depending on microsatellite instability status of individual tumors [J]. Dis Colon Rectum, 2012, 55(2): 181-190.
[21] 蒋松松, 陈刚,郑黎明,等.同时性多原发结肠癌误诊三例临床分析[J].临床误诊误治,2016,29(1):21-24.

