包膜丁酸钠与癸氧喹酯联合应用抗鸡球虫作用研究
崔 怡,刘 莎,黄 杰,李金贵*
(1.扬州大学兽医学院,扬州 225009;2.江苏省动物重要疫病与人畜共患病防控协同创新中心,扬州 225009)
球虫病是家禽养殖业中一种常见且严重的寄生虫病,通常由一种或多种球虫共同感染引起,其中致病性最强的是柔嫩艾美耳球虫(Eimeriatenella,E.tenella)。该病的发病率为50%~70%,死亡率可达50%,常导致生产性能严重下降而给家禽养殖业造成巨大的损失[1-2]。对于该病的防治仍以化学药物为主,但随着药物的长期使用,抗药性已经非常普遍,且出现抗药性的周期越来越短,给开发新药带来很大压力,由此可见单纯的化学药物防治难以满足市场需求[3-4]。研究表明丁酸可在肠道中产生短链脂肪酸为肠道上皮细胞提供直接能量来源,还能促进损伤修复,有利于建立并维持肠道非特异性免疫屏障[5]。丁酸钠具有调节肠道pH,提高肠道消化酶活性,促进消化吸收的作用[6],还具有广泛的抗炎作用[7]。近年来有研究表明在日粮中添加丁酸类衍生物可以促进肠粘膜、肠绒毛生长与损伤修复,进而减轻鸡球虫的致病程度[8-9],多项研究表明[10-12]包膜丁酸钠(Coated sodium butyrate,CSB)对禽类肠道、免疫及生产性能都有维持和保护作用。 潘丽俊等[13]报道称日粮中添加包膜丁酸钠能够提高家兔抵抗球虫感染的能力。癸氧喹酯(decoquinate,DQ)是目前防治球虫病的主要有效药物之一,主要作用于球虫生活史的早期阶段,干扰DNA 合成而阻止虫体发育。国内有关学者的相继研究表明DQ具有明显的抗球虫效果[14-16],但对某些地方球虫虫株需要较高的剂量(500 mg/kg)才能达到理想的效果[17]。
为了减少化学药物的使用量并减缓抗药性的出现,在使用抗球虫药的同时,添加一些肠道保护剂、促生长剂等增强抗球虫药的疗效,研究选用CSB与DQ联合用药,通过球虫病临床症状、粪便卵囊排出情况、盲肠病变记分以及组织病理学观察来验证联合用药对E.tenella的防治作用。
1 材料与方法
1.1 试验材料及试验动物 中国农业科学院家禽研究所提供的雏鸡饲料,不含抗球虫药和抗生素。包膜丁酸钠(CSB)由杭州康德权饲料有限公司生产提供,丁酸钠含量30%。癸氧喹酯(DQ)由山东德州神牛药业有限公司提供,批号:20160807,含量为99.8%。100只1日龄雄性绿壳蛋鸡,购于中国农业科学院家禽研究所,饲养于扬州大学兽医学院实验动物房,饲养环境经甲醛、高锰酸钾熏蒸,氨水喷洒消毒,饲养时统一光照,自由饮水摄食,饲养至13日龄开始试验。E.tenella孢子化卵囊,为扬州大学中兽医教研室采集病料分离,并经雏鸡接种纯化后获得的孢子化卵囊。
1.2 试验方法 将试验鸡平衡体重后分为五组,每组20只,分两个重复(n=10)。空白对照组(Control)、感染对照组(E.tenellainfection,EI)、感染+包膜丁酸钠组(EI+CSB)、感染+癸氧喹酯组(EI+QD)、感染+包膜丁酸钠+癸氧喹酯组(EI+CSB+DQ)。14日龄时,除对照组外EI组每只经口接种8万个孢子化卵囊。接种球虫前1d开始用药直至实验结束,所有药物均匀拌料后自由采食,自由饮水,Control组与EI组的饲料无药物添加,其他条件保持一致。观察感染后临床表现,包括精神、饮食以及粪便情况等。接种球虫后,注意观察鸡群发病情况,在出现血便时开始粪便卵囊计数,计算每克粪便中卵囊数(oocysts per gram, OPG),同时进行血便计分。对病死鸡进行剖检,观察盲肠与其他器官的病变情况。接种球虫第7d称重后处死试验鸡,统计盲肠病变记分。
1.3 血便记数、盲肠病变记分和抗球虫指数 血便数量计数;试验结束时解剖检查盲肠病变情况,盲肠病变记分按Johnson和Reid制定的标准进行病变记分的评定[18]。按美国默克公司方法计算相对增重率、存活率、病变值(病变计分×10)和卵囊值,据此计算抗球虫指数(anticoccidial index, ACI),ACI=(相对增重率+存活率)-(病变值+卵囊值)。
1.4 病理组织观察 采集盲肠组织样本,10%中性甲醛溶液固定,制备常规HE染色切片4 μm,镜检盲肠组织病变情况。
1.5 统计分析 所有试验数据均应用SPSS 19.0版统计分析软件进行单向方差分析(One-way ANOVA),结果以“平均值±标准差”的形式表示,差异显著性判断以P<0.05作为差异显著,P<0.01作为差异极显著。
2 结 果
2.1 各组试验鸡的临床症状 试验期间,对照组精神状态良好,饮食正常,无球虫感染。接种卵囊72 h后,各感染组均出现不同程度的下痢,病鸡精神状态尚可。至96 h左右观察到EI组和CSB组病鸡精神沉郁,然后出现鲜红血便,DQ处理的两组未见血便。120 h时EI组和CSB组的血便明显增多,其他感染组并未发现血便,饮食正常。到144 h时发现EI组和CSB组血便有明显减少,CSB+DQ组和DQ组仅出现零星血便。继续观察到168 h时EI组和CSB组血便数量持续减少,但精神状态并未改善;CSB+DQ组和DQ组仅存在微量血便,精神状态较好,食欲正常。
试验结束时统计增重情况发现,与对照组相比,EI组和CSB组的增重均显著下降,而DQ组和CSB+DQ组均逆转了球虫感染引起的增重下降(表2)。
2.2 各组的卵囊排出情况以及抗球虫指数比较 攻毒后120 h开始观察粪便中卵囊,136h观察到EI组和CSB组出现卵囊,卵囊数持续增高直到144 h EI组排出卵囊数达到高峰,此时EI组粪便卵囊数均明显高于CSB组。 160 h后EI 组卵囊数开始下降,CSB组达到高峰,两组卵囊数无显著性差异。168 h EI组和CSB组卵囊数均大幅度减少。DQ组仅在168 h观察到少量卵囊,CSB+DQ组和对照组在试验期间未观察到卵囊。EI和CSB组ACI不足120,CSB+DQ组和DQ组的ACI均在180以上(表3~表4)。从临床症状、卵囊排出情况、增重以及ACI等综合看来,联合用药组效果最好。

表2 各组试验鸡的体重变化(n=20)Tab 2 The change of body weight in different groups(n=20)
同列数据相比,肩标字母相同的差异不显著(P>0.05),肩标字母不相同的差异显著(P<0.0.5)。相对增重率(relative body weight gain, RBWG%)
In the same column, values with same superscripts (a, b and c) mean no significant difference among groups (P>0.05); values with different superscripts (a, b and c) mean significant difference (P<0.05). relative body weight gain: RBWG%

表3 每克粪便卵囊值(×105)Tab 3 Oocysts per gram feces(×105)
同表2。
Same as Tab2.

表4 各试验组抗球虫指数Tab 4 Anti-coccidial effect of different treatment groups
ACI ≥180判定为敏感,160≤ACI<18为良好,120 ≤ACI<160为差,ACI<120为无效。字母肩标相同为差异不显著,字母肩标不相同为差异显著(P<0.05)。相对增重率(relative body weight gain, RBWG%);存活率(survive rate, RSR%);卵囊值(oocysts index, OI);盲肠病变记分(cecum lesion scores, LS);抗球虫指数(anticoccidial index, ACI)
ACI≥180 means high effective, 160≤ACI <18 means middle effective, 120≤ACI <160 means lower effective, ACI <120 means invalid, values with same superscripts (a, b and c) mean no significant difference among groups (P>0.05), values with different superscripts (a, b and c) mean significant difference(P<0.05). relative body weight gain: RBWG%, survive rate: RSR%, oocysts index: OI, cecum lesion scores: LS, anticoccidial index: ACI.
2.3 各组鸡盲肠组织病理学观察 从病理切片可以看出EI组肠绒毛结构严重破坏,可见大量卵囊和配子体;CSB组同样可见大量卵囊、配子体寄生于盲肠,但肠绒毛结构相对完整;CSB+DQ组肠绒毛、肠腺结构完整,边缘大量杯状细胞,并未见虫体;DQ组盲肠结构完整没有虫体寄生,但肠绒毛边缘杯状细胞较少(图1)。
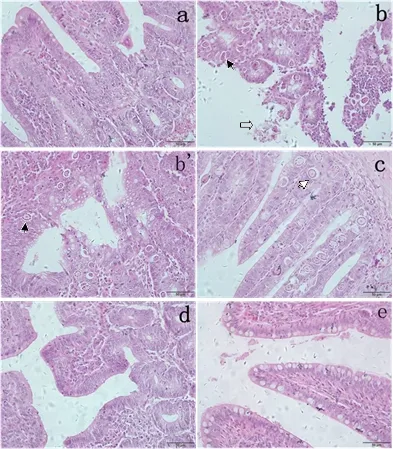
a: control组;b, b’: EI组;c: CSB组;d: DQ组;e: CSB+DQ组黑色箭头:配子体;白色箭头:卵囊;空心箭头:脱落的肠绒毛a: control group;b, b’: EI group;c: CSB group;d: DQ group;e: CSB+DQ group;Black arrow:gamelocyte;White arrow:Oocysts;Hollow arrow:intestinal villi fell away图1 鸡盲肠组织病理学观察(HE:400×) Fig 1 Histopathological analysis of cecal of chickens.(HE: 400×)
3 讨论与小结
研究表明包膜丁酸钠(CSB)具有修复肠绒毛,为肠道提供营养,抑制有害菌群的生长和爆发,调节肠道稳态,抑制炎症,增加饲料利用率的作用,甚至被当作一种潜在的抗生素的替代品[19-21],CSB对艾美耳球虫感染的肠道菌群失衡有改善作用,试验发现CSB对健康鸡的肠道菌群没有明显的抑制作用,但可以显著减少球虫感染引起的硬壁杆菌数目和拟杆菌门的丰度[22]。还有研究表明CSB和抗球虫药配合使用可提高抗球虫疗效,特别是对妥曲珠利、地克珠利和尼卡巴嗪等不敏感的球虫虫株[23]。
试验只有CSB组和EI组临床症状严重,与EI组相比CSB组在144 h后血便情况大幅度改善。从粪便卵囊计数发现,EI组卵囊数在144 h达到高峰,CSB组到160 h才达到高峰,且EI组在高峰时的卵囊数高于CSB组,在168 h时卵囊数降到相同水平;DQ组仅在168 h发现少量卵囊排出,CSB+DQ组并未发现卵囊排出。结合组织病理学切片观察,可以看到EI组和CSB组均存在大量虫体,但CSB组肠绒毛结构相对完整。DQ组和CSB+DQ组未发现虫体,肠绒毛结构完整,不过CSB+DQ组杯状细胞数量明显高于DQ组和对照组。杯状细胞的分泌产物在肠道固有免疫方面起着重要的作用,杯状细胞分泌的MUC、ITF和RELMβ均可维持肠粘膜稳态,缓解寄生虫感染引起的炎症,肠道感染疾病均伴随着杯状细胞的增多[24]。以上结果提示CSB在提高肠道的防御能力、保护肠绒毛的完整性、减缓和缩短球虫病病程方面存在一定的效果,但是效果有限。
在试验中CSB与DQ联合用药组的增重情况、卵囊排出情况均比单独应用DQ效果好,故联合应用产生了一定的增效作用,但不是特别显著,这可能是试验所用的E.tenella虫株对DQ比较敏感,DQ单独用药的ACI已经达到180,故没有体现出特别明显的增效作用。还有可能是因为CSB提前添加的时间比较短,球虫接种时还未起到对肠道菌群的调节作用,若提前一周预防给药或许能提高CSB的作用效果,这有待于进一步研究。
本试验结果表明,CSB单独用药能推迟血便并减少卵囊排出,但未能达到防治球虫的作用。CSB与DQ联合用药时能增强DQ的抗球虫效果,这说明CSB能适度增强肠道屏障功能,与DQ合用具有一定的增效作用。
参考文献:
[1] 常晓辉,薛飞群,张丽芳. 鸡球虫病药物防治的研究现状[J]. 中国动物传染病学报, 2011, 19(5): 71-75.
Chang X H, Xue F Q, Zhang L F. Advanced in anticoccidial drugs[J], Chinese Journal of Animal Infectious Diseases, 2011, 19(15): 71-75.
[2] 李祥瑞. 鸡球虫病的防控现状及展望[C]. 南京农业大学畜牧兽医学术年会——猪禽疫病综合防控研讨会, 2012.
Li X R. Overview and perspective on the current research status for the chicken coccidiosis[C]. Nanjing Agricultural University Animal Science and Veterinary Annual Meeting——Swine and Poultry Disease Prevention and Control colloquium, 2012.
[3] 严杜建,董成林,黄朝国. 鸡球虫病的防治现状与发展趋势[J]. 畜禽业, 2009, 2: 64-65.
Yan D J, Dong C L, Huang C G. Status of control and development trend of the chicken coccidiosis[J]. Livestock and Poultry Industry, 2009, 2: 64-65.
[4] Clark E L, Tomley F M, Blake D P. Are Eimeria genetically diverse, and does It matter?[J]. Trends Parasitol. 2017, 33(3): 231-241.
[5] Hudcovic T, Kolinska J, Klepetar J,etal. Protective effect of clostridium tyrobutyricum in acute dextran sodium sulphate-induced colitis: differential regulation of tumour necrosis factor-alpha and interleukin-18 in BALB/c and severe combined immunodeficiency mice[J]. Clin Exp Immunol, 2012, 167(2): 356-365.
[6] P Galfi, S Neogrady. The pH-dependent inhibitory action of n-butyrate on gastrointestinal epithelial cell division[J]. Food Res Int. 2001, 34: 581-586.
[7] Menzel T, Lührs H, Zirlik S,etal. Butyrate inhibits leukocyte adhesion to endothelial cells via modulation of VCAM-1[J]. Inflamm Bowel Dis, 2004, 10(2): 122-128.
[8] Ali A M, Seddiek S, Khater H F. Effect of butyrate, clopidol and their combination on the performance of broilers infected with Eimeria maxima[J]. Br Poult Sci, 2014, 55(4): 474-482.
[9] 王阵锋. 丁酸钠对感染E.tenella肉鸡肠道粘膜修复作用的研究[D]. 福建农林大学, 2008.
Wang Z F. Effect of sodium burrrate oil repairing intestinal mucosa of broiler chiekens with infection of Eimeria tenella[D]. Fujian Agriculture and Forestry University, 2008.
[10] 赵 民,徐小芳,余 荣. 包膜丁酸钠对青脚麻种鸡生产性能的影响[J]. 饲料工业, 2012, 33(20): 33-34.
Zhao M, Xu X F, Yu R. Effect of coated sodium butyrate on production performance of QingJiaoma breeders[J]. Feed Industry, 2012, 33(22): 33-34.
[11] 贾 凤. 包膜丁酸钠对肉鸭肠道生理和免疫机能的影响[D]. 浙江师范大学, 2014.
Jia F. Effect of coated sodium butyrate on intestinal physiology and immune function in meat duck[D]. Zhenjiang Normal University, 2014.
[12] 鞠婷婷,郭孝烨,随佳佳,等. 不同剂型丁酸钠对脂多糖应激肉鸡血清生化指标、抗氧化和抗炎功能的影响[J]. 动物营养学报, 2015, 27(10): 3146-3154.
Ju T T, Guo X Y, Sui J J,etal. Effect of different sodium bicarbonate on serum biochemical indexes, antioxidant and anti-inflammatory functions of lipopolysaccharide-stressed broilers[J]. Chinese Journal of Animal Nutrition, 2015, 27(10): 3146-3154.
[13] 潘丽俊. 包膜丁酸钠对家兔肠道健康的影响及对球虫病的预防效果研究[D]. 浙江师范大学, 2016.
Pan L J. Coated sodium butyrate effect on rabbit intestinal health and its protective effect research for coccidiosis[D]. Zhenjiang Normal University, 2016.
[14] 都业良,张 灿,刘焕奇,等. 癸氧喹酯对AA肉鸡感染Eimeria tenella疗效的研究[J]. 中国农学通报, 2009, 25(4): 6-9.
Du Y L, Zhang C, Liu H Q,etal. Efficacy of decoquinate against Eimeria tenella in AA broiler chickens[J], Chinese agricultural science bulletin, 2009, 25(4): 6-9.
[15] 索 勋,崔凤山,沈建忠,等. 癸氧喹酯预防人工感染肉仔鸡球虫病的药效试验[J]. 中国兽医杂志, 2002, 38(10): 11-13.
Suo X, Cui F S, Shen J Z,etal. Efficacy test of decoquinate in preventing artificial infection of coccidiosis in chicken[J]. Chinese Journal of Veterinary Medicine, 2002, 38(10):11-13.
[16] 韩 森. 新型抗球虫药——癸氧喹酯的研究与应用[J]. 饲料研究, 2007, 8: 14-15.
Han S. Research and application of new anti-coccidiosis drug——decoquinate[J]. FEED RESEARCH, 2017, 8: 14-15.
[17] 余东游,周 斌,毛翔飞,等. 癸氧喹酯抗鸡柔嫩艾美耳球虫病机理研究[J]. 中国畜牧杂志, 2010, 46(11): 62-64.
Yu D Y, Zhou B, Mao X F,etal. Study on the mechanism of decoquinate against Eimeria tenella in chicken[J]. Chinese Journal of Animal Science, 2010, 46(11): 62-64.
[18] Johnson J, Reid W M. Anticoccidial drugs: lesion scoring techniques in battery and floor-pen experiments with chickens[J]. Exp Parasitol, 1970, 28(1): 30-36.
[19] Zhou Z Y, Packialakshmi B, Makkar S K,etal. Effect of butyrate on immune response of a chicken macrophage cell line[J]. Vet Immunol Immunopathol, 2014, 162(1-2): 24-32.
[20] Kaczmarek S A, Barri A, Hejdysz M,etal. Effect of different doses of coated butyric acid on growth performance and energy utilization in broilers[J]. Poult Sci, 2016, 95(4): 851-859.
[21] Smith P M, Howitt M R, Panikov N,etal. The microbial metabolites, short-chain fatty acids, regulate colonic Treg cell homeostasis[J]. Science, 2013, 341(6145): 569-573.
[22] Zhou Z, Nie K, Huang Q,etal. Changes of cecal microflora in chickens following Eimeria tenella challenge and regulating effect of coated sodium butyrate[J]. Exp Parasitol, 2017, 177: 73-81.
[23] 朱焕星,王仁翠,孙培功,等. 丁酸钠与抗球虫药配伍使用对鸡盲肠球虫病的效果观察[J]. 养禽与禽病防治, 2011, (11): 5-6.
Zhu H X, Wang R C, Sun P G,etal. Effect of sodium butyrate combined with anticoccidial drug on cecal coccidiosis in chicken[J]. Poultry Husbandry and Disease Control, 2011, (11): 5-6.
[24] 董文逍,曹海龙,王邦茂. 杯状细胞在肠道疾病发病中作用的研究进展[J]. 国际消化病杂志, 2015, 35(4): 244-246, 269.
Dong W X, Cao H L, Wang B M. Research Progress on the Role of Goblet Cells in the Pathogenesis of Intestinal Diseases[J]. International Journal of Digestive Diseases , 2015, 35(4): 244-246. 269.

