猪链球菌Ide通用截短蛋白原核表达及纯化研究
曲光刚,王长江,李书光,李茂峰,武曰星,金婷婷,韩文瑜,沈志强1,*
(1.山东省滨州畜牧兽医研究院博士后科研工作站, 山东滨州 256600;2. 吉林大学博士后科研流动站,长春 130062;3. 山东绿都生物科技有限公司,山东滨州 256600;4. 山东省滨州畜牧兽医研究院,山东滨州 256600;5. 阳信县综合检验检测中心,山东滨州 251800)
猪链球菌(Streptococcosissuis,S.suis)感染猪可引起脑膜炎、关节炎和败血症等疾病,给养猪业造成严重的经济损失[1-3]。根据荚膜多糖抗原性的差异,猪链球菌可以分为35个血清型。研究表明,不同血清型的猪链球菌及同一血清型中不同菌株之间的致病力各有差异[4]。其中猪链球菌2型是从病猪体内最常分离出的血清型,致病力最强,同时它也是一种重要的人畜共患病病原体,可导致生猪从业人员的感染和死亡[5-6]。有关猪链球菌的致病机制及其预防研究已经成为公共卫生领域的研究热点[7]。
天然免疫球蛋白M(IgM)含有C1q结合基序,它可以结合到病原体表面而引发经典的补体级联反应[8],在抵抗不同病原体及关联先天免疫和获得性免疫过程中起重要作用[9]。由于单体膜表面IgM是猪主要的B细胞受体[9-10],并且猪体内缺少IgD,因此IgM对猪尤为重要。研究发现猪感染链球菌后体内会有IgM发生降解[11],在此过程中猪链球菌IgM降解酶(Immunoglobulin M-degrading enzyme ofS.suis, IdeSsuis)发挥了重要作用[11],这提示IdeSsuis蛋白可能是一种有效的猪链球菌抗原。此外,J Seele等的研究结果表明,IdeSsuis蛋白的氨基酸序列截短至第432个氨基酸时仍具有IgM降解活性[12]。
研究通过克隆IdeSsuis基因截短片段TrIde序列,分别构建原核表达载体pET28a-TrIde、pET32a-TrIde和pET-sumo-TrIde,转化E.coliBL21(DE3)后通过IPTG诱导表达,为猪链球菌通用亚单位疫苗的开发提供实验基础。
1 材料与方法
1.1 材料 猪链球菌2型强毒株JZLQ为实验室分离保存。载体pET28a、pET32a、pET-sumo购自Invitrogen公司;宿主菌E.coliDH5α、E.coliBL21(DE3)、 rTaq DNA聚合酶,限制性内切酶BamH Ⅰ、Hind Ⅲ,T4 DNA连接酶均购自宝生物工程(大连)有限公司;质粒提取试剂盒:Plasmid Mini Kit I (200)、胶回收试剂盒:Gel Extraction Kit (200)均购自美国OMEGA公司;氨苄青霉素(Ampicillin)与卡那霉素(Kanamycin)购自SIGMA公司。
1.2 方法
1.2.1 猪链球菌2型TrIde基因扩增 根据GenBank数据库中猪链球菌2型IdeSsuis基因序列设计合成1对上、下游分别含有BamH Ⅰ和Hind Ⅲ酶切位点的特异性引物。上游引物:5'-CGGGATCCATGGATACAGTTGTTACAGGAGTGAATGA-3',下游引物:5'-CCAAGCTTTGTCTGACTAGCTGTTTCT ̄TTGG-3'(下划线分别为BamH Ⅰ和Hind Ⅲ酶切位点)。引物由上海生工生物工程有限公司合成。提取猪链球菌2型强毒株JZLQ全基因组DNA,以此为模板经PCR方法扩增出TrIde基因片段,预期大小为1200 bp左右。TrIde基因扩增反应参数为98 ℃ 10 s,55 ℃ 5 s,72 ℃ 40 s,35个循环。扩增产物通过1%琼脂糖凝胶电泳检测片段大小。
1.2.2 原核重组表达载体的构建及鉴定 PCR产物经1%琼脂糖凝胶电泳后用胶回收试剂盒切胶回收,纯化后与pET28a、pET32a和pET-sumo载体分别用限制性内切酶BamH Ⅰ和Hind Ⅲ进行双酶切,而后分别用胶回收试剂盒进行回收纯化;回收产物在T4 DNA连接酶作用下连接1 h后转入DH5α感受态细胞,分别涂布相应抗性LB筛选平板,于37 ℃恒温培养箱中过夜培养;分别挑取筛选平板上的单菌落于LB液体培养基中,经培养后提取质粒进行双酶切鉴定,并将阳性质粒送上海生工生物工程有限公司进行测序。
1.2.3 TrIde蛋白的诱导表达及可溶性分析 将测序正确的重组表达载体pET28a-TrIde、pET32a-TrIde、pET-sumo-TrIde分别转化E.coliBL21 (DE3)感受态细胞,涂布抗性平板后挑取单菌落过夜培养,次日按1%比例将过夜培养物接种于新鲜LB培养基中继续培养,至OD600达到0.5左右时,分别加入IPTG至终浓度为0.1 mmol/L、1 mmol/L,分别在25 ℃、37 ℃条件下诱导表达8 h。诱导表达后的菌体细胞经超声波破碎后高速离心分离上清和沉淀,分别进行SDS-PAGE电泳分析。
1.2.4 TrIde蛋白纯化及阳性血清制备 采用优化后的最佳条件对TrIde目的蛋白进行诱导表达,表达产物经镍亲和层析柱纯化,纯化后的蛋白溶液采用BCA法微量蛋白浓度测量试剂盒测定浓度,蛋白分装后放置-80 ℃保存。
将纯化好的目的蛋白制成疫苗免疫清洁级新西兰兔,400 μg/只。免疫方式为皮下注射,第1次免疫时采用抗原与等体积的弗氏完全佐剂充分混匀后免疫;第2次免疫于首次免疫14 d后进行,抗原与等体积的弗氏不完全佐剂充分混匀乳化后进行免疫。第3次免疫在首次免疫28 d后进行,免疫条件同前一次。第3次免疫一周后采血,用ELISA方法测定血清抗体效价。
1.2.5 Western blotting分析 目的蛋白及空白菌变性后经SDS-PAGE电泳,电泳结束后将凝胶放置在转膜缓冲液中平衡20 min,采用半干法转印蛋白到硝酸纤维素膜上,磷酸盐缓冲液漂洗后用体积分数为10%的TBST 4 ℃封闭过夜。再加入体积分数5%的TBST稀释的兔阳性血清,37 ℃振荡孵育1 h,TBST漂洗3次,加入按1∶2000稀释的HRP标记的羊抗兔二抗,37 ℃振荡孵育30 min,TBST漂洗3次后进行DAB显色观察结果。
2 结 果
2.1 TrIde目的基因的扩增 经1%琼脂糖凝胶电泳检测,PCR扩增产物片段大小约为1200 bp,与预期目的片段大小相符,且未见非特异性扩增条带(图1)。
2.2 重组表达载体鉴定 琼脂糖凝胶电泳结果显示,三种重组表达载体分别用BamH Ⅰ和Hind Ⅲ双酶切后均得到一条大小约为1200 bp的条带,另一条条带位置在2000 bp以上(图2),为切开的载体片段。测序结果进一步表明重组表达载体构建正确。
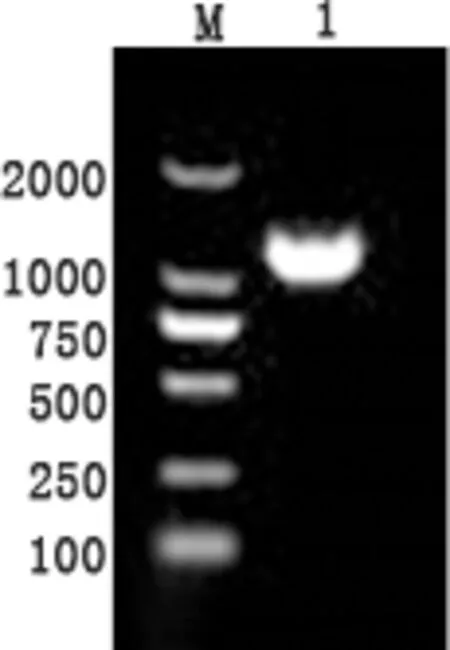
M:DL2000 Marker;1:TrIde基因片段PCR产物M: DL2000 Marker; 1: PCR product of TrIde图1 TrIde基因PCR扩增产物1%琼脂糖凝胶电泳结果Fig 1 PCR product of TrIde detected by 1% agarose gel electrophoresis
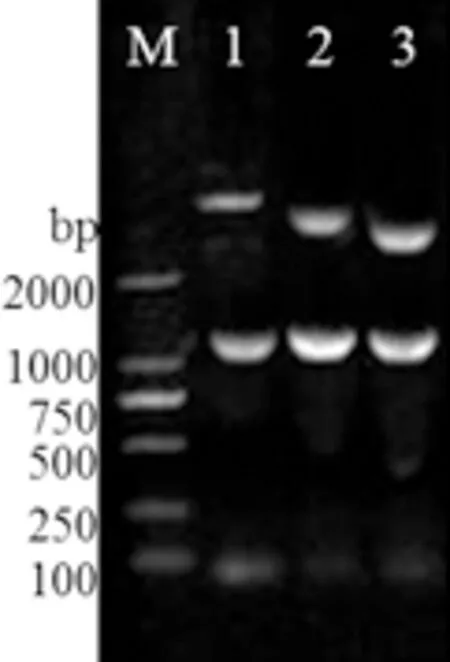
M:DL2000 Marker;1:pET32a-TrIde双酶切结果;2:pET-sumo-TrIde双酶切结果;3:pET28a-TrIde双酶切结果M: DL2000 Marker; 1: Double digestion products of pET32a-TrIde;2: Double digestion products of pET-sumo-TrIde;3: Double digestion products of pET28a-TrIde图2 重组表达质粒双酶切鉴定Fig 2 Double digestion assay of recombinant expression vectors
2.3 TrIde目的蛋白诱导表达
2.3.1 不同表达载体表达效果比较 在E.coliBL21(DE3)中分别对三种重组表达载体进行TrIde目的蛋白的诱导表达,结果显示pET28a-TrIde重组表达载体的表达效果最佳,目的蛋白表达量高且可溶率为95%以上(图3);pET32a-TrIde重组表达载体表达的目的蛋白也具有较好的可溶性,但表达量比pET28a-TrIde重组表达载体略低(图3,第2、5泳道);pET-sumo-TrIde重组表达载体表达的目的蛋白大部分以包涵体形式存在,可溶性目的蛋白的表达量低于pET28a-TrIde重组表达载体(图3,第2、8泳道)。
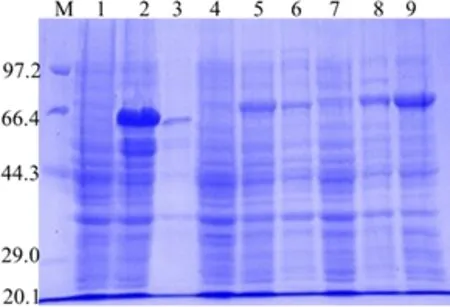
M:蛋白Marker;1:BL21 (DE3)/pET28a-TrIde未诱导菌;2:BL21 (DE3)/pET28a-TrIde诱导表达超声破碎上清;3:BL21 (DE3)/pET28a-TrIde诱导表达超声破碎沉淀;4:BL21 (DE3)/pET32a-TrIde未诱导菌;5:BL21 (DE3)/pET32a-TrIde诱导表达超声破碎上清;6:BL21 (DE3)/pET28a-TrIde诱导表达超声破碎沉淀;7:BL21 (DE3)/pET-sumo-TrIde未诱导菌;8:BL21 (DE3)/pET-sumo-TrIde诱导表达超声破碎上清;9:BL21 (DE3)/pET-sumo-TrIde诱导表达超声破碎沉淀M: Protein Marker; 1: Non-induced BL21 (DE3)/pET28a-TrIde;2: Supernatant after ultrasonication of BL21 (DE3)/pET28a-TrIde;3: Precipitate after ultrasonication of BL21 (DE3)/pET28a-TrIde;4:Non-induced BL21 (DE3)/pET32a-TrIde;5: Supernatant after ultrasonication of BL21 (DE3)/pET32a-TrIde;6: Precipitate after ultrasonication of BL21 (DE3)/pET32a-TrIde;7: Non-induced BL21 (DE3)/pET-sumo-TrIde;8: Supernatant after ultrasonication of BL21 (DE3)/pET-sumo-TrIde;9: Precipitate after ultrasonication of BL21 (DE3)/pET-sumo-TrIde图3 三种不同重组表达载体诱导表达结果SDS-PAGE分析Fig 3 SDS-PAGE analysis of TrIde induced by different recombinant bacteria
2.3.2 pET28a-TrIde重组表达载体表达条件的优化
SDS-PAGE结果显示,重组菌BL21 (DE3)/pET28a-TrIde经诱导后表达产物大小约50 kD,条带位置与预期目的蛋白分子质量大小一致(图4);不同温度条件对目的蛋白的表达量具有较大影响,25 ℃条件下目的蛋白的表达量比37 ℃条件下高,且可溶性较好(图4,第1、3和5、7泳道)。25 ℃条件下IPTG浓度对目的蛋白表达量及可溶性几乎无影响(图4,第1、2和3、4泳道)。
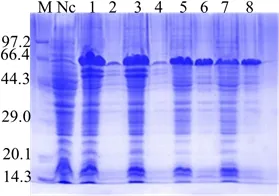
M:蛋白Marker;Nc:未诱导重组菌BL21 (DE3)/pET28a-TrIde;1:25 ℃ IPTG 0.1 mmol/L诱导表达8 h超声破碎上清;2:25 ℃ IPTG 0.1 mmol/L诱导表达8 h超声破碎沉淀;3:25 ℃ IPTG 1 mmol/L诱导表达8 h超声破碎上清;4:25 ℃ IPTG 1 mmol/L诱导表达8 h超声破碎沉淀;5:37 ℃ IPTG 0.1 mmol/L诱导表达8 h超声破碎上清;6:37 ℃ IPTG 0.1 mmol/L诱导表达8 h超声破碎沉淀;7:37 ℃ IPTG 1 mmol/L诱导表达8 h超声破碎上清;8:37 ℃ IPTG 1 mmol/L诱导表达8 h超声破碎沉淀M: Protein Marker; Nc: Non-induced recombinant bacteria;1: Supernatant after ultrasonication of recombinant bacteria induced by 0.1 mmol/L IPTG at 25 ℃ for 8 hours;2: Precipitate after ultrasonication of recombinant bacteria induced by 0.1 mmol/L IPTG at 25 ℃ for 8 hours;3: Supernatant after ultrasonication of recombinant bacteria induced by 1 mmol/L IPTG at 25 ℃ for 8 hours;4: Precipitate after ultrasonication of recombinant bacteria induced by 1 mmol/L IPTG at 25 ℃ for 8 hours; 5: Supernatant after ultrasonication of recombinant bacteria induced by 0.1 mmol/L IPTG at 37 ℃ for 8 hours; 6: Precipitate after ultrasonication of recombinant bacteria induced by 0.1 mmol/L IPTG at 37 ℃ for 8 hours; 7: Supernatant after ultrasonication of recombinant bacteria induced by 1 mmol/L IPTG at 37 ℃ for 8 hours; 8: Precipitate after ultrasonication of recombinant bacteria induced by 1 mmol/L IPTG at 37 ℃ for 8 hours图4 重组菌BL21 (DE3)/pET28a-TrIde不同诱导条件下表达结果SDS-PAGE分析Fig 4 SDS-PAGE analysis of recombinant TrIde induced by different conditions
2.4 TrIde蛋白纯化 选择诱导表达效果较好的重组菌BL21 (DE3)/pET28a-TrIde以最佳条件进行目的蛋白诱导表达,蛋白溶液经镍亲和层析柱纯化。纯化后的蛋白进行SDS-PAGE(图5),灰度分析结果显示目的蛋白纯度可达95%,BCA法测定蛋白浓度为1.8 mg/mL。
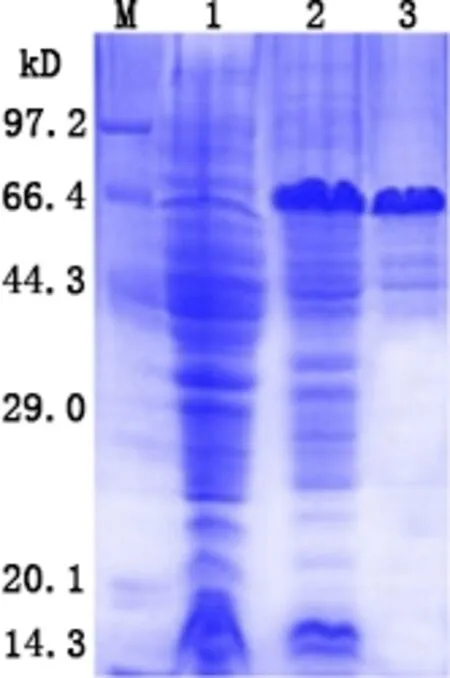
M:蛋白Marker;1:阴性对照;2:菌体超声破碎后离心上清;3:亲和层析纯化后的蛋白M: protein Marker; 1: Negative control; 2: Supernatant after ultrasonication; 3: Purified TrIde protein图5 TrIde蛋白纯化SDS-PAGE分析Fig 5 SDS-PAGE analysis of purified TrIde protein
2.6 Western blotting分析 免疫印迹结果显示,空载体菌及未诱导的转化菌在50 kD处均无表达条带,诱导菌则有明显条带(图6),提示经IPTG诱导后重组菌表达了截短的IdeSsuis蛋白TrIde,且TrIde重组蛋白能被抗2型猪链球菌阳性血清识别,表明该重组蛋白具有良好的抗原反应和免疫原性。
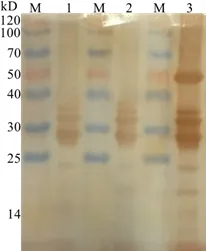
M:预染Marker;1:空载体表达产物;2:未诱导菌表达产物;3:TrIde重组蛋白M: Marker; 1: Expression product of empty vector;2: Non-induced expression product; 3: TrIde recombinant protein图6 TrIde重组蛋白Western blotting分析Fig 6 Western blotting analysis of TrIde protein
3 讨 论
由于猪链球菌的致病机制十分复杂,目前在猪链球菌病预防过程中尚未有广谱、高效的疫苗。一般认为猪链球菌致病力强弱是由其毒力因子决定的,但由于猪链球菌的毒力因子种类繁多、结构与功能复杂多变、各毒力因子之间的联系错综复杂,因此其致病机制尚未研究清楚[12-13]。目前研究的较为深入的致病性毒力因子主要包括荚膜多糖、溶菌酶释放蛋白与猪溶素等[14]。
人类病原菌酿脓链球菌分泌一种针对IgG特异性的内肽酶IdeS,该酶可在IgG铰链区高效裂解人类IgG。有研究表明猪链球菌Mac家族基因编码一种具有IdeS蛋白酶活性的酶(IdeSsuis)[15],该酶被证明与IdeS同型但不具有IgG裂解活性,而是专一性的裂解IgM,并且裂解效率极高。此外,IdeSsuis蛋白酶氨基酸序列的全长不是其裂解活性所必需的。Jana Seele等证明IdeSsuis蛋白酶只需从第35号到第432号氨基酸长度的片段就具有较好的IgM裂解活性[11]。
研究对IdeSsuis开放阅读框基因序列推测的氨基酸序列进行分析后,选取了长度为1227 bp的具有裂解活性的片段进行克隆表达。利用pET28a、pET32a和pET-sumo载体质粒分别构建IdeSsuis的重组表达载体pET28a-TrIde和pET32a-TrIde和pET-sumo-TrIde,利用BL21(DE3)作为宿主菌,通过不同温度条件及诱导剂IPTG浓度的优化,实现了该蛋白在大肠埃希菌原核表达系统中的可溶性表达。利用pET28a载体质粒表达的蛋白分子量理论值为46 kD,但SDS-PAGE电泳结果显示其表观分子量略大于46 kD。其表观分子量偏大的原因可能是与标准蛋白相比其电荷密度较低造成的[16]。
分别把目的基因TrIdeSsuis片段克隆入不同的表达载体构建三种重组表达质粒,并分别比较其表达效果,结果显示pET28a载体质粒能够实现该目的基因的可溶性表达,且目的蛋白表达量较高,便于该蛋白的后续纯化工作。IdeSsuis蛋白的可溶性表达为该蛋白的纯化及免疫原性分析奠定了基础。
IgM是体液免疫过程中的重要参与者,发生感染后IgM首先出现,它是感染初期的标志性物质。由于IdeSsuis对IgM具有非常高效和专一性的裂解作用,这可能是造成猪链球菌2型感染后产生免疫逃逸的机制之一。该酶参与了宿主免疫应答早期阶段的宿主-病原体相互作用,同时IdeSsuis在大部分链球菌中都有表达,因此,该蛋白的可溶性表达为猪链球菌通用疫苗的研发提供了新的方向和思路。后续需通过猪链球菌攻毒保护实验来验证该重组蛋白的免疫效果及保护作用。
参考文献:
[1] Segura M, Zheng H, De Greeff A,etal. Latest developments onStreptococcussuis: an emerging zoonotic pathogen: part 1[J]. Future Microbiology, 2014, 9(4): 441-444.
[2] Fittipaldi N, Segura M, Grenier D,etal. Virulence factors involved in the pathogenesis of the infection caused by the swine pathogen and zoonotic agentStreptococcussuis[J]. Future Microbiology, 2012, 7(2): 259-279.
[3] 简娟娟, 刘 利, 王 维. 猪链球菌2型感染的临床特征和治疗[J]. 现代畜牧科技, 2015 (2): 69-69.
Jian J J, Liu L, Wang W. Clinical characteristics and treatment ofStreptococcussuistype 2 infection[J]. Modern Animal Husbandry Science & Technology, 2015 (2): 69-69.
[4] Goyette-Desjardins G, Auger J P, Xu J,etal.Streptococcussuis, an important pig pathogen and emerging zoonotic agent-an update on the worldwide distribution based on serotyping and sequence typing[J]. Emerging Microbes & Infections, 2014, 3(6): e45.
[5] Kerdsin A, Dejsirilert S, Puangpatra P,etal. Genotypic profile ofStreptococcussuisserotype 2 and clinical features of infection in humans, Thailand[J]. Emerging Infectious Diseases, 2011, 17(5): 835-842.
[6] Sriskandan S, Slater J D. Invasive disease and toxic shock due to zoonoticStreptococcussuis: an emerging infection in the East?[J]. PLoS Med, 2006, 3(5): e187.
[7] Lun Z R, Wang Q P, Chen X G,etal.Streptococcussuis: an emerging zoonotic pathogen [J]. The Lancet Infectious Diseases, 2007, 7(3): 201-209.
[8] Butler J E, Zhao Y, Sinkora M,etal. Immunoglobulins, antibody repertoire and B cell development[J]. Developmental & Comparative Immunology, 2009, 33(3): 321-333.
[9] Ochsenbein A F, Zinkernagel R M. Natural antibodies and complement link innate and acquired immunity [J]. Immunology Today, 2000, 21(12): 624-630.
[10] Butler J E, Sun J, Navarro P. The swine Ig heavy chain locus has a single JH and no identifiable IgD[J]. International Immunology, 1996, 8(12): 1897-1904.
[11] Seele J, Singpiel A, Spoerry C,etal. Identification of a novel host-specific IgM protease inStreptococcussuis[J]. Journal of Bacteriology, 2013, 195(5): 930-940.
[12] Seele J, Beineke A, Hillermann L M,etal. The immunoglobulin M-degrading enzyme ofStreptococcussuis, IdeSsuis, is involved in complement evasion[J]. Veterinary Research, 2015, 46(1): 45-59.
[13] 高尚庆, 雷连成, 韩文瑜. 猪链球菌 2 型基因工程疫苗研究进展[J]. 生物技术通报, 2007 (2): 33-35.
Gao S Q, Lei L C, Han W Y. Progress in the research of gene ̄tically engineering vaccine ofStreptococcussuisserotype 2[J]. Biotechnology Bulletin, 2007 (2): 33-35.
[14] Okura M, Takamatsu D, Maruyama F,etal. Genetic analysis of capsular polysaccharide synthesis gene clusters from all serotypes ofStreptococcussuis: potential mechanisms for generation of capsular variation[J]. Applied and Environmental Microbiology, 2013, 79(8): 2796-2806.
[15] 马建华, 魏建忠. 猪链球菌毒力因子研究进展[J]. 动物医学进展, 2014, 35(8): 95-99.
Ma J H, Wei J Z. Progress on virulence factors ofStreptococcussuis[J]. Progress in Veterinary Medicine, 2014, 35(8): 95-99.
[16] Lei B, DeLeo F R, Hoe N P,etal. Evasion of human innate and acquired immunity by a bacterial homolog of CD11b that inhibits opsonophagocytosis[J]. Nature Medicine, 2001, 7(12): 1298-1305.
[17] 曲光刚, 杨金芳, 李茂峰, 等. 猪链球菌Sao-M和IdeSsuis蛋白的原核表达与反应原性分析[J]. 中国兽药杂志, 2016, 50(6): 1-4.
Qu G G, Yang J F, Li M F,etal. Expression and Western blotting analysis ofStreptococcussuisSao-M and IdeSsuis[J]. Chinese Journal of Veterinary Drug, 2016, 50(6): 1-4.

