光声/超声实时双模态显影纳米粒制备及示踪实验
杨 露,成 涓,陈瑜莉,刘逢秋
(1.重庆医科大学附属第二医院三腺外科,2.超声科,重庆 400010;3.重庆医科大学超声影像学研究所,重庆 400010)
近年来,我国乳腺癌发病率已居女性恶性肿瘤之首。准确判断前哨淋巴结转移,对乳腺癌分期、指导治疗及改善预后均具有重要意义,但如何精确定位前哨淋巴结是目前临床急需解决的关键难题之一。本研究采用高分子生物可降解材料携带具有良好光吸收属性的纳米炭及具有液气相变特性的液态氟碳,构建一种新型淋巴结示踪剂——光声/超声实时双模态显影纳米粒,并验证其示踪能力,以期为临床探索精确定位前哨淋巴结提供新的思路。
1 材料与方法
1.1 实验材料
1.1.1 仪器 主要包括:Heat System XL2020声振仪,Mettler Toledo XS104电子分析天平,Malvern Zeta SIZER 3000HS激光粒径仪,Hitachi H-7500透射电镜,Esaote MyLab 90彩色多普勒超声诊断仪(LA523探头,频率4~13 MHz),Leica TCSSP2激光扫描共聚焦显微镜,ADR-1085激光仪(重庆理真科技有限公司),Vevo LAZR光声仪,FOTRIC 226红外热像仪,DAY型超声图像定量分析诊断仪(重庆医科大学超声影像学研究所研发)。
1.1.2 试剂 主要包括:乳酸-羟基乙酸共聚物(ploy lactide-co-glycolide acid, PLGA;济南岱罡生物工程有限公司),纳米炭(重庆莱美药业股份有限公司),全氟己烷(perfluorohexane, PFH;百灵威试剂公司),二氯甲烷(重庆川东化工有限公司),聚乙烯醇(polyvinylalcohol, PVA;Sigma公司),巨噬细胞RAW264.7(南京赛泓瑞生物科技有限公司),细胞膜红色荧光探针Dil(碧云天生物有限公司)。
1.1.3 实验动物 新西兰大白兔20只(由重庆医科大学实验动物中心提供),雌雄不限,体质量2.0~2.5 kg;兔VX2肿瘤株由重庆医科大学超声工程研究所提供。
1.2 制备载纳米炭及液态氟碳的PLGA纳米粒 称取PLGA 50 mg置于50 ml离心管中,以移液管吸取1 ml二氯甲烷加入上述离心管中溶解PLGA;吸取50 μl纳米炭(50 mg/ml)至5 ml的EP管中,以2 ml双蒸水稀释后加入PFH 200 μl,并以声振仪声振30 s使其变为乳浊液;将其加入至已溶解PLGA的离心管中声振约1 min,而后加入6 ml 3%PVA均质90 s,再加入直径1 cm的磁珠后将其置于磁力搅拌器上搅拌2 h,使其挥发出二氯甲烷;磁力搅拌结束后离心洗涤3次,将离心洗涤后得到的沉淀物,即包裹纳米炭和液态氟碳的纳米粒(carbon nanoparticles incorporated liquid-gas phase-transition nanodroplets, CNPs)以1 ml双蒸水稀释,Co60辐照灭菌,4℃保存备用。制备Dil标记的荧光纳米粒(Dil-labeled CNPs,Dil-CNPs),在称取的PLGA中加入荧光染料Dil,制备及储存过程中避光。
1.3 一般性状检测及光致相变实验 光镜下观察CNPs的大小、形态及分散性,并采用激光仪(808 nm,1 W/cm2)辐照CNPs 30 s,光镜下观察激光辐照后CNPs大小变化情况;透射电镜下观察其内部结构;以激光粒径仪测量其粒径分布及Zeta电位。
1.4 体外吞噬实验 将对数生长期的巨噬细胞RAW264.7接种于培养皿中,于37℃、5%CO2恒温培养箱中培养24 h。待细胞贴壁生长后,将已辐照灭菌的 Dil-CNPs以培养液稀释成0.1 mg/ml加入培养皿中,共同孵育12 h后,以磷酸盐缓冲液(phosphate buffered saline, PBS)反复冲洗培养皿,于激光共聚焦显微镜下观察Dil-CNPs被巨噬细胞吞噬情况。
1.5 体外光热效应、光声显影与超声造影观察 将CNPs分别稀释成5、10、15、20 mg/ml共4种浓度,各取1 ml置入24孔板中,以激光仪(808 nm, 1 W/cm2)辐照30 s,并采用红外热像仪监测温度变化,每隔3 s对CNPs温度进行记录,绘制温度变化曲线。以等量生理盐水作为对照,将4种不同浓度的CNPs与生理盐水置入2%凝胶孔洞模型中,并设置3个复孔;采用光声仪以波长700 nm激光激发,采集光声图像并测量光声信号值;并以激光仪(808 nm,1 W/cm2)辐照30 s,采用超声诊断仪以造影模式扫查,并采用DAY型超声图像定量分析诊断仪分析所采集图像ROI的平均灰度值。

图1 CNPs光镜及透射电镜图像 A、B.光镜下(×100)可见激光辐照前CNPs大小均一(A),激光辐照后部分CNPs体积增大(B); C.透射电镜下可见深黑色的纳米炭颗粒携载于CNPs 图2 CNPs激光共聚焦显微镜下(×800)可见CNPs被巨噬细胞吞噬
1.6 体内光热效应、光声显影与超声造影观察 将兔VX2肿瘤接种于20只新西兰大白兔双侧后肢小腿外侧,4周后16只兔腘窝处出现肿瘤转移淋巴结共计30枚,随机分为2组,实验组(8只兔,15枚淋巴结)经足底注射2 ml CNPs(20 mg/ml),对照组(8只兔,15枚淋巴结)经足底注射2 ml生理盐水。处理后6、12、24 h采用激光仪(808 nm,2 W/cm2)辐照30 s,并以红外热像仪监测温度变化,每隔3 s记录淋巴结局部温度,绘制温度变化曲线。24 h后采用光声仪以波长700 nm激光激发,采集光声图像并测量光声信号值;并以激光仪(808 nm,2 W/cm2)辐照30 s,采集CEUS图像并分析平均灰度值。
1.7 统计学分析 采用SPSS 19.0统计分析软件,计量资料以±s表示,2组间比较采用独立样本t检验,多组间比较采用单因素方差分析,两两比较采用LSD法,P<0.05为差异有统计学意义。
2 结果
2.1 CNPs一般性状及光致相变结果 CNPs混悬液外观呈黑色,CNPs粒径为(483.32±45.09)nm,Zeta电位为(-26.30±5.02)mV。光镜下可见CNPs形态规则,大小均一,分散性好(图1A);经激光辐照后,CNPs内的纳米炭吸收光能,发生光热转换,致使CNPs内的液态氟碳发生液气相变,光镜下可见部分CNPs体积迅速增大(图1B)。透射电镜下CNPs呈较规则球形,并携载有深黑色纳米炭颗粒(图1C)。
2.2 体外吞噬结果 激光共聚焦显微镜下可见大量Dil-CNPs靠近蓝色的细胞核(图2)。
2.3 体外光热效应 不同浓度CNPs在激光辐照下温度均升高,辐照约10 s后,温度可达45~55℃,且浓度越高,升温速度越快、幅度越大,而对照组温度无明显升高,见图3。
2.4 体外光声显影 浓度为5、10、15、20 mg/ml的CNPs均可检测到较强光声信号,且光声信号随浓度增高呈增强趋势,而生理盐水未检测到明显光声信号,见图4。不同浓度CNPs及生理盐水的平均光声信号值见表1。
表1 不同浓度CNPs及生理盐水的平均光声信号值及平均灰度值(±s)
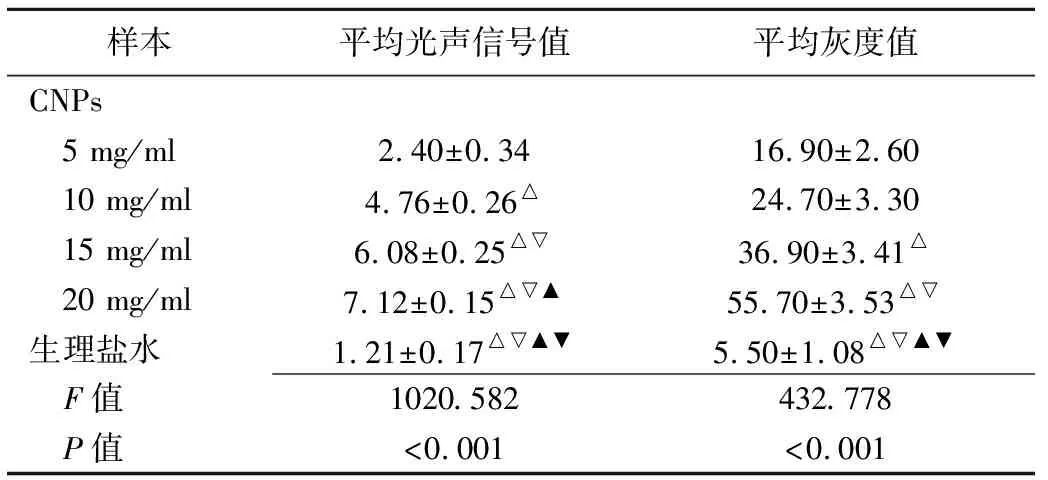
表1 不同浓度CNPs及生理盐水的平均光声信号值及平均灰度值(±s)
样本平均光声信号值平均灰度值CNPs 5 mg/ml 2.40±0.3416.90±2.60 10 mg/ml4.76±0.26△24.70±3.30 15 mg/ml6.08±0.25△▽36.90±3.41△ 20 mg/ml7.12±0.15△▽▲55.70±3.53△▽生理盐水1.21±0.17△▽▲▼5.50±1.08△▽▲▼ F值1020.582432.778 P值<0.001<0.001
注:△:与5 mg/ml CNPs比较,P<0.05;▽:与10 mg/ml CNPs比较,P<0.05;▲:与15 mg/ml CNPs比较,P<0.05;▼:与20 mg/ml CNPs比较,P<0.05
2.5 体外CEUS 浓度为5、10、15、20 mg/ml的CNPs CEUS均可见不同程度增强,且CNPs浓度越高,增强效果越明显,而生理盐水CEUS无增强,见图5。不同浓度CNPs及生理盐水的平均灰度值见表1。
2.6 体内光热效应 注射CNPs 6、12、24 h后实验组腘窝淋巴结局部温度均升高,其中注射24 h后温度升高最明显,局部温度约为50℃,而对照组温度无明显升高,见图6。

图4 生理盐水及不同浓度(5、10、15、20 mg/ml)CNPs体外光声显影 图5 生理盐水及不同浓度(5、10、15、20 mg/ml)CNPs体外CEUS图像
2.7 体内光声显影 实验组腘窝淋巴结可检测到较强光声信号,而对照组腘窝淋巴结未检测到明显光声信号,见图7。实验组及对照组平均光声信号值分别为3.16±0.25及0.93±0.17,差异有统计学意义(t=28.819,P<0.001)。
2.8 体内CEUS 实验组腘窝淋巴结CEUS增强效果明显,而对照组腘窝淋巴结CEUS无增强,见图8。实验组及对照组平均灰度值分别为41.67±4.89、15.20±2.78,差异有统计学意义(t=18.207,P<0.001)。

图3 生理盐水及不同浓度(5、10、15、20 mg/ml)CNPs在30 s激光辐照下的温度变化曲线
3 讨论

图6 经足底注射生理盐水及CNPs后不同时间(6、12、24 h)VX2肿瘤转移新西兰大白兔腘窝淋巴结在30 s激光辐照下的温度变化曲线
随着分子影像技术的发展,多种影像学技术已用于探查前哨淋巴结,多模态显影可弥补单一影像学技术的不足,有效提高前哨淋巴结术前定位和活检的准确率。CEUS可实时显示淋巴结甚至引流淋巴管情况,较为准确地定位前哨淋巴结,安全性好,有助于初步判断淋巴结性质[1-3],但目前所采用的微泡造影剂存在不能染色前哨淋巴结及代谢时间短等问题。光声成像是一种无创性成像技术,结合了超声成像高穿透深度和光学成像高对比度的特性,可提供实时高对比度和高分辨率图像,且无辐射。目前光声成像技术虽已应用于前哨淋巴结的显影[4-7],但淋巴结本身吸收光的能力较差,必须借助外源性造影剂,目前应用较多者包括亚甲蓝、吲哚菁绿、纳米金棒、碳纳米管等一些染料、荧光材料及纳米材料。
纳米炭是一种可应用于乳腺癌、结直肠癌、甲状腺癌等恶性肿瘤淋巴结示踪的新型染料,经局部注射后可被巨噬细胞吞噬进入淋巴结内,具有高度淋巴结趋向性,极少引发局部及全身不良反应,与美蓝等传统染料相比更加高效、安全[8-9],且具有极强的光吸收属性,是光声造影剂的理想材料[10]。PLGA是一种可降解的高分子有机化合物,具有良好的生物相容性、生物可降解性、成球性和成球后稳定性。Niu等[11]应用包裹苏丹蓝的PLGA微球显影前哨淋巴结,证实PLGA微球较脂质体微泡在体内具有良好稳定性。此外,纳米级PLGA微球经皮下注射后可顺利进入淋巴结[11],且PLGA微球易被巨噬细胞吞噬[12-13]。

图7 生理盐水(A)及CNPs(B)在新西兰大白兔体内光声显影 图8 生理盐水(A)及CNPs(B)在新西兰大白兔体内超声造影及定量分析
本研究利用PLGA包裹纳米炭与液态氟碳制备CNPs,其大小均一、形态规则,且该纳米粒在体外可被巨噬细胞吞噬,且经皮下注射后可进入淋巴结。CNPs因纳米炭的光学属性,具有良好的光热效应和光声显影能力;而其具有超声显影的能力则是因为纳米炭吸收光能后发生光热转换,使其内部温度迅速升高,促使液态氟碳发生液气相变,产生大量的微气泡,CNPs体积增大成为良好的超声显像剂[14-15]。
在体外实验中,本研究通过红外成像仪记录温度变化曲线,发现CNPs浓度越高,其升温速度越快,且幅度越大。本研究通过在体动物实验发现,皮下注射CNPs 6、12、24 h后,在激光辐照下局部淋巴结升温速度和幅度随时间延长不断增加(图6),可能是由于CNPs需经巨噬细胞吞噬和毛细淋巴管等途径进入区域淋巴结,淋巴结内CNPs浓度随时间累积而不断增高。
本研究证实CNPs在激光辐照下可产生良好的光热效应,并可用于光声成像及CEUS,且随着纳米粒浓度增高,产生的微气泡随之增多,增强光声显影与CEUS的效果也随之增加;且纳米炭本身是一种黑色染料,用其制备的CNPs仍呈现为黑色,亦具有染色淋巴结的能力,可进一步提高对淋巴结的显示率。因此,CNPs有望成为一种新型的集双模态显影和染料为一体的淋巴结示踪剂,这种实时追踪、双模态显影及染色淋巴结的方式有助于简便、快捷地精确定位恶性肿瘤前哨淋巴结。
本研究仅对CNPs的一般属性、光热效应、光声显影和CEUS进行初步研究,仍有诸多问题亟待解决,如CNPs的毒性与安全性、区域淋巴结中CNPs浓度的定量分析、光声显影与CEUS的持续时间等,均有待进一步探索。
[参考文献]
[1] Sever AR, Mills P, Jones SE, et al. Sentinel node identification using microbubbles and contrast-enhanced ultrasonography. Clin Radiol, 2012,67(7):687-694.
[2] Cox K, Sever A, Jones S, et al. Validation of a technique using microbubbles and contrast enhanced ultrasound (CEUS) to biopsy sentinel lymph nodes (SLN) in pre-operative breast cancer patients with a normal grey-scale axillary ultrasound. Eur J Surg Oncol, 2013,39(7):760-765.
[3] Yang WT, Goldberg BB. Microbubble contrast-enhanced ultrasound for sentienl lymph node detection: Ready for prime time? AJR Am J Roentgenol, 2011,196(2):249-250.
[4] Erpelding TN, Kim C, Pramanik M, et al. Sentinel lymph nodes in the rat: Noninvasive photoacoustic and US imaging with a clinical US system. Radiology, 2010,256(1):102-110.
[5] Pan D, Pramanik M, Senpan A, et al. Near infrared potoacoustic detection of sentinel lymph nodes with gold nanobeacons. Biomaterials, 2010,31(14):4088-4093.
[6] Pramanik M, Song KH, Swierczewska M, et al. In vivo carbon nanotube-enhanced non-invasive photoacoustic mapping of the sentinel lymph node. Phys Med Biol, 2009,54(11):3291-3301.
[7] Jeon M, Song W, Huynh E, et al. Methylene blue microbubbles as a model dual-modality contrast agent for ultrasound and activatable photoacoustic imaging. J Biomed Opt, 2014,19(1):16005.
[8] 葛洁,颜博,曹旭晨.纳米炭混悬注射液与亚甲蓝注射液在早中期乳腺癌前哨淋巴结活检中的应用.中华肿瘤杂志,2011,33(3):226-228.
[9] 瞿欢,张亚男,陈卫东.纳米炭在乳腺癌前哨淋巴结示踪的实验研究.中国普通外科杂志,2010,19(5):489-492.
[10] Yang L, Cheng J, Chen Y, et al. Phase-transition nanodroplets for real-time photoacoustic/ultrasound dual-modality imaging and photothermal therapy of sentinel lymph node in breast cancer. Sci Rep, 2017,7:45213.
[11] Niu CC, Wang Z, Zuo G, et al. Poly (lactide-co-glycolide) ultrasonographic microbubbles carrying Sudan black for preoperative and intraoperative localization of lymph node. Clin Breast Cancer, 2012,12(3):199-206.
[12] Brandhonneur N, Chevanne F, Vié V, et al. Specific and non-specific phagocytosis of ligand-grafted PLGA microspheres by macrophages. Eur J Pharm Sci, 2009,36(5):474-485.
[13] Thiele L, Merkle HP, Walter E. Phagocytosis and phagosomal fate of surface-modified microparticles in dendritic cells and macrophages. Pharm Res, 2003,20(2):221-228.
[14] Quaia E. Microbubble ultrasound contrast agents: An update. Eur Radiol, 2007,17(8):1995-2008.
[15] Qin S, Caskey CF,Ferrara KW. Ultrasound contrast microbubbles in imaging and therapy: Physical principles and engineering. Phys Med Biol, 2009,54(6):27-57.