不同声强低强度脉冲超声对SD大鼠骨髓间充质干细胞迁移的影响
蒋璟玮,刘宝茹,梁丹丹,汪 威,罗 东,陈俊林,陈锦云,陈文直,2,王 嫣*
(1.重庆医科大学生物医学工程学院 省部共建国家重点实验室培育基地—重庆市超声医学工程重点实验室 重庆市生物医学工程学重点实验室 重庆市微无创医学协同创新中心,重庆 400016;2.重庆医科大学附属第二医院肿瘤治疗中心,重庆 400010)
骨髓间充质干细胞(bone marrow mesenchymal stem cells, BMSCs)是一种非造血类的成体多能干细胞,具有取材方便、增殖能力强、可多向分化、免疫原性低等特点[1]。组织损伤时,BMSCs可向受损位点迁移并进行修复,其对心肌梗死、神经退行性疾病、骨疾病等疾病的治疗作用已经动物实验证实[2-4]。然而,外源移植BMSCs在体内迁移时,向靶组织的迁移率低[5-6]。如何提高外源性BMSCs自身迁移能力,从而使BMSCs在体内向受损组织迁移时具有更强的能力,是目前干细胞治疗领域亟待解决的难题。低强度脉冲超声(low intensity pulsed ultrasound, LIPUS)声强范围1~100 mW/cm2,目前临床主要用于治疗骨科疾病,具有费用低廉、简便易行、效果理想的优点[7-8]。LIPUS可促进BMSCs的增殖[9]及多向分化[10-12],加快骨折愈合,从而达到治疗目的[13]。本研究通过体外细胞实验研究LIPUS对BMSCs迁移的影响,并筛选最佳声强。
1 材料与方法
1.1 实验细胞培养 BMSCs(购自中国科学院干细胞库)来源于6周龄SD大鼠骨髓。将BMSCs从液态氮中取出后进行复苏,加入含10%胎牛血清(fetal bovine serum, FBS;Gibco公司)的低糖DMEM培养基(Hyclone公司),置于细胞培养箱中以37℃、5%CO2条件培养。采用Olympus IX-70倒置相差显微镜观察细胞生长情况。当细胞生长至80%时,采用0.25%胰蛋白酶(Hyclone公司)消化传代。
1.2 LIPUS辐照及分组 将处理后的BMSCs分为4组,在后续实验中对空白对照组不进行LIPUS辐照(仅行假辐照操作),对其余3组均采用海扶LIPUS仪样机进行辐照,并根据辐照声强分为30 mW/cm2组、60 mW/cm2组及90 mW/cm2组。其他超声辐照参数:频率0.3 MHz,重复频率1 kHz,占空比20%,每次辐照时间20 min。
1.3 划痕实验 取生长状态良好BMSCs,接种至六孔培养板中进行培养,每孔加入5×105个细胞,待细胞完全贴壁后采用无血清培养基“饥饿”培养24 h后,以 200 μl枪头进行划痕。用磷酸盐缓冲液(phosphate buffer solution, PBS)洗去划掉的细胞,加入无血清的低糖DMEM培养基继续培养。而后分别对30 mW/cm2组、60 mW/cm2组及90 mW/cm2组进行辐照,并于辐照后即刻及辐照后24 h、48 h,采用Olympus IX-70倒置相差显微镜观察划痕区并进行拍照,通过image J软件测定划痕区面积。对空白对照组分别于相应时间测定划痕区面积。消化收集各时间点BMSCs,离心后弃上清,加入1 ml新鲜完全培养基及0.5 ml浓度为1 mg/ml的MTT[3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴;Sigma公司],于细胞孵箱中培养4 h,离心后弃去培养液,加入150 μl二甲基亚砜(Sigma公司)溶解沉淀。采用Bio-Tek酶标仪在490 nm波长处测量吸光度值。
1.4 transwell小室模型构建及细胞迁移实验 采用24孔滤膜孔径8 μm的transwell小室(Corning公司)构建细胞迁移模型。实验前将装有含2% FBS的低糖DMEM培养基的transwell小室放入培养箱中平衡1 h。对BMSCs采用无血清低糖DMEM培养基重悬,将细胞密度调整为5×105/ml,每孔200 μl接种于transwell小室的上室,并向transwell小室的下室内加入800 μl含10% FBS的完全培养基。接种后,对30 mW/cm2组、60 mW/cm2组及90 mW/cm2组进行辐照,24 h后取出transwell小室,以棉签擦去上室未迁移的细胞,4%多聚甲醛固定,亚甲蓝染液染色;对空白对照组仅于相应时间进行固定及染色处理。采用Olympus Ⅸ-70倒置相差显微镜随机选取5个视野进行拍照并计数。
1.5 F-肌动蛋白(F-actin)染色 对30 mW/cm2组、60 mW/cm2组及90 mW/cm2组分别进行LIPUS辐照,爬片生长24 h后(密度达50%的汇合度),吸弃培养液,与空白对照组共同以37℃预热的PBS(pH为7.4)清洗细胞2次后,于室温下采用4%多聚甲醛固定10 min,再以PBS清洗细胞2次,以Tritonx-100溶液透化处理5 min,取200 μl异硫氰酸荧光素(fluorescein isothiocyanate, FITC)标记的鬼笔环肽工作液(翊圣生物科技有限公司)进行染色,室温下孵育30 min,以抗荧光淬灭封片剂(华迈科生物技术有限责任公司)封片。采用Nikon TE200荧光显微镜观察F-actin表达情况,随机选取5个视野进行拍照;采用image J软件检测各组细胞的相对荧光强度。
1.6 统计学分析 采用SPSS 22.0统计分析软件。计量资料以±s表示。采用单因素方差分析比较多组间划痕面积、吸光度、细胞计数及相对荧光强度,两两比较采用LSD法。以P<0.05为差异有统计学意义。
2 结果
2.1 划痕实验及MTT活性检测 30 mW/cm2组、60 mW/cm2组及90 mW/cm2组LIPUS辐照后即刻、24 h及48 h及空白对照组相应时间划痕面积见表1、图1。辐照后24 h时空白对照组划痕面积[(0.93±0.26) mm2]最大,分别大于30 mW/cm2组(P<0.001)、60 mW/cm2组(P<0.001)及90 mW/cm2组(P=0.015);30 mW/cm2组划痕面积最小[(0.47±0.21)mm2],分别小于60 mW/cm2组(P<0.001)、90 mW/cm2组(P<0.001)及空白对照组(P<0.001)。辐照后48 h空白对照组划痕面积[(0.70±0.11)mm2]仍明显大于30 mW/cm2组(P<0.001)、60 mW/cm2组(P<0.001)和90 mW/cm2组(P<0.001),30 mW/cm2组划痕面积[(0.19±0.10)mm2]仍明显小于60 mW/cm2组(P<0.001)、90 mW/cm2组(P<0.001)及空白对照组(P<0.001)。
表1 30 mW/cm2组、60 mW/cm2组、90 mW/cm2组LIPUS辐照后不同时间及对照组相应时间BMSCs划痕面积比较(mm2,±s)
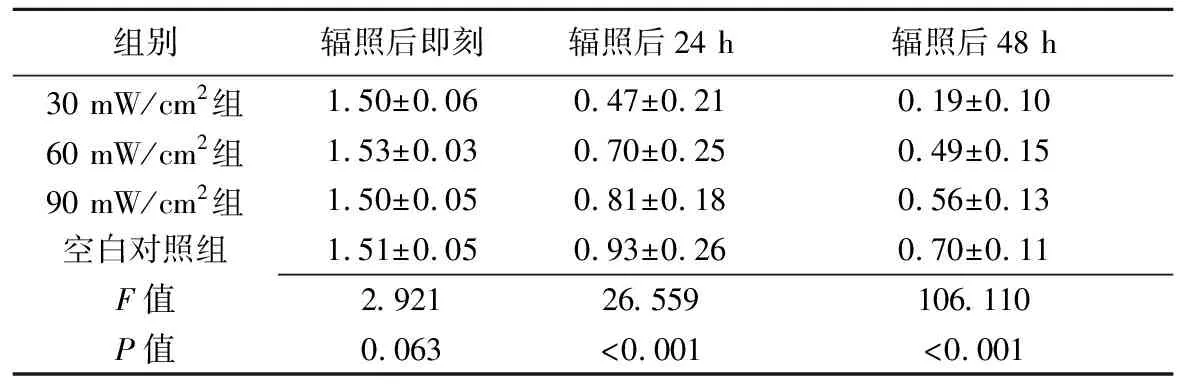
表1 30 mW/cm2组、60 mW/cm2组、90 mW/cm2组LIPUS辐照后不同时间及对照组相应时间BMSCs划痕面积比较(mm2,±s)
组别辐照后即刻辐照后24 h辐照后48 h30 mW/cm2 组1.50±0.060.47±0.210.19±0.1060 mW/cm2 组1.53±0.030.70±0.250.49±0.1590 mW/cm2 组1.50±0.050.81±0.180.56±0.13空白对照组1.51±0.050.93±0.260.70±0.11F值2.92126.559106.110P值0.063<0.001<0.001
MTT活性检测结果显示,30 mW/cm2组、60 mW/cm2组及90 mW/cm2组LIPUS辐照后即刻、24 h及48 h及空白对照组相应时间吸光度差异均无统计学意义,见表2。
表2 30 mW/cm2组、60 mW/cm2组、90 mW/cm2组LIPUS辐照后不同时间及对照组相应时间BMSCs吸光度比较(±s)

表2 30 mW/cm2组、60 mW/cm2组、90 mW/cm2组LIPUS辐照后不同时间及对照组相应时间BMSCs吸光度比较(±s)
组别辐照后即刻辐照后24 h辐照后48 h30 mW/cm2 组1.77±0.152.01±0.122.40±0.1060 mW/cm2 组1.68±0.321.95±0.142.39±0.1590 mW/cm2 组1.71±0.221.96±0.132.40±0.15空白对照组1.67±0.251.96±0.112.44±0.08F值1.6160.7201.408P值0.1960.5440.378
2.2 transwell迁移结果 对穿过transwell小室上室的BMSCs进行染色(图2)并计数结果显示,各组间细胞计数差异有统计学意义(F=43.145,P<0.001);两两比较,30 mW/cm2组[(212.53±35.32)个]、60 mW/cm2组[(168.87±35.49)个]及90 mW/cm2组[(155.60±35.34)个]细胞计数均大于空白对照组[(89.53±19.27)个;P均<0.001],30 mW/cm2组细胞计数分别大于60 mW/cm2组(P=0.013)及90 mW/cm2组(P<0.001),而60 mW/cm2组与60 mW/cm2组间细胞计数差异无统计学意义(P=0.226)。

图1 倒置相差显微镜下观察BMSCs划痕愈合(×40) LIPUS辐照后即刻(A~D)、24 h(E~H)及48 h(I~L)30 mW/cm2组、60 mW/cm2组、90 mW/cm2组及空白对照组相应时间细胞划痕图像,蓝线之间为划痕区

图2 倒置相差显微镜下观察穿过transwell小室上室的细胞,亚甲蓝染色(×100) A.空白对照组; B.30 mW/cm2组; C.60 mW/cm2组; D.90 mW/cm2组 图3 F-actin荧光显微镜下图像,FITC-鬼笔环肽荧光染色(×100) A.空白对照组; B.30 mW/cm2 组; C.60 mW/cm2 组; D.90 mW/cm2 组
2.3 F-actin 染色结果 F-actin染色(图3)显示,LIPUS辐照后30 mW/cm2组、60 mW/cm2组及90 mW/cm2组BMSCs微丝增粗变长,数量增多。各组间相对荧光强度差异有统计学意义(F=64.350,P<0.001)。两两比较,30 mW/cm2组(125.43±17.43)、60 mW/cm2组[89.78±16.09]及90 mW/cm2组[73.54±13.04]相对荧光强度均高于空白对照组[(51.94±12.76);P均<0.001],30 mW/cm2组相对荧光强度高于60 mW/cm2组(P<0.001)及90 mW/cm2组(P<0.001),60 mW/cm2组相对荧光强度高于90 mW/cm2组(P<0.001)。
3 讨论
组织发生损伤时,BMSCs可向损伤位点归巢并参与修复,此为BMSCs移植治疗的理论基础,而外源性注射的BMSCs在体内迁移率低是目前BMSCs移植治疗领域的瓶颈。研究[10]发现,LIPUS作用于BMSCs后,可对其生物学行为产生影响,但大多数研究[11-12]主要集中于LIPUS对BMSCs增殖能力和分化能力的影响。本研究探讨LIPUS对BMSCs迁移能力的影响,并对LIPUS辐照的最佳声强进行筛选。
BMSCs向组织损伤位点迁移是BMSCs治疗的关键一步。划痕模型可模仿体内伤痕康复时细胞迁移过程,是细胞迁移研究的经典模型。本研究采用不同声强LIPUS对BMSCs划痕进行辐照,发现LIPUS辐照后24 h及48 h时BMSCs划痕面积均较相应时间未辐照者减小(图1),且超声强度为30 mW/cm2时划痕面积最小,表明LIPUS可增强BMSCs向“损伤”部位的迁移能力,且超声强度为30 mW/cm2时增强作用最明显。本研究通过MTT实验对划痕实验中BMSCs的细胞增殖活性进行检测结果显示,各时间点4组BMSCs间吸光度差异均无统计学意义,表明各组增殖活性相似,划痕面积的改变仅与细胞迁移能力有关。
为进一步确认LIPUS促进BMSCs迁移的作用,本研究进行transwell迁移实验,发现分别以声强为30 mW/cm2、60 mW/cm2、90 mW/cm2的LIPUS辐照后,传过transwell小室上室的细胞计数均明显高于未经LIPUS辐照者,表明LIPUS可提高BMSCs的迁移能力,与Wei等[13]的研究结果一致。另有研究[14]报道,LIPUS联合BMSCs移植可加速骨缺损愈合。组织损伤时通过LIPUS促进BMSCs动员,LIPUS不仅是促进BMSCs增殖和多向分化,而是在BMSCs归巢这一步就开始发挥增效作用。
F-actin是构成微丝的主要细胞骨架蛋白,与细胞迁移能力密切相关。本研究以FITC-鬼笔环肽对LIPUS辐照后的BMSCs进行荧光染色,观察其F-actin表达,发现LIPUS可使BMSCs的细胞骨架发生改变,微丝数量增多,细胞骨架面积增大,采用图像分析软件对各组F-actin荧光强度进行检测后发现30 mW/cm2组、60 mW/cm2组及90 mW/cm2组的相对荧光强度均明显高于空白对照组,且30 mW/cm2组明显高于60 mW/cm2组及90 mW/cm2组,表明LIPUS可增强BMSCs的黏附和迁移能力,且30 mW/cm2的LIPUS辐照促进细胞迁移的能力最强。研究[15]发现,机械应力作用于细胞膜后可激活细胞膜上的一系列受体,将机械刺激信号传递至细胞内,从而产生生物学效应改变。因此,LIPUS增强BMSCs迁移能力可能是由于超声的机械应力作用于BMSCs细胞膜上的受体,再由细胞内的信号分子将这种刺激传递至细胞骨架,使细胞骨架向利于细胞运动迁移的方向进行重排,从而促进细胞迁移。
综上所述,本研究发现LIPUS可促进BMSCs的体外迁移能力,超声辐照最佳声强为30 mW/cm2。但本研究仅对BMSCs的体外迁移能力进行了检测,其在实验动物及人体内是否具有相同的生物效应还需要进一步研究证实。
[参考文献]
[1] Ritfeld GJ, Nannoe Tewarie RD, Vajn K, et al. Bone marrow stromal cellmediated tissue sparing enhances functional repair after spinal cord contusion in adult rats. Cell Transplant, 2012,21(7):1561-1575.
[2] Zhang GW, Gu TX, Guan XY, et al. HGF and IGF-1 promote protective effects of allogeneic BMSC transplantation in rabbit model of acute myocardial infarction. Cell Proliferation, 2015,48(6):661-670.
[3] Mina E, Maliheh N, Akram A, et al. The effect of intrathecal delivery of bone marrow stromal cells on hippocampal neurons in rat model of Alzheimer's disease. Iran J Basic Med Sci, 2015,18(5):520-525.
[4] 杨俊丽,韩霞,孙明启.骨髓间充质干细胞移植治疗四肢骨折骨不连:实验成果与转化应用.中国组织工程研究,2014,18(45):7337-7341.
[5] Sarkar D, Spencer JA, Phillips JA, et al. Engineered cell homing. Blood J, 2011,118(25):e184.
[6] Gleeson BM, Martin K, Ali MT, et al. Bone marrow-derived mesenchymal stem cells have innate procoagulant activity and cause microvascular obstruction following intracoronary delivery: Amelioration by Antithrombin therapy. Stem Cells, 2015,33(9):2726.
[7] Takikawa S, Matsui N, Kokubu T, et al. Low-intensity pulsed ultrasound initiates bone healing in rat nonunion fracture model. Ultrasound Med, 2001,20(3):197-205.
[8] 孙保勇,陈文直,贾小林,等.低强度脉冲超声促进骨折愈合的动物实验研究.中国矫形外科杂志,2005,13(6):43-46.
[9] Gao Q, Walmsley AD, Cooper PR, et al. Ultrasound stimulation of different dental stem cell populations: Role of mitogen-activated protein kinase signaling. J Endod, 2016,42(3):425-431.
[10] LYU Y, Zhao P, Chen G, et al. Effects of low-intensity pulsed ultrasound on cell viability, proliferation and neural differentiation of induced pluripotent stem cells-derived neural crest stem cells. Biotechnol Lett, 2013,35(12):2201-2212.
[11] Kusuyama J, Bandow K, Shamoto M, et al. Low intensity pulsed ultrasound (LIPUS) influences the multilineage differentiation of mesenchymal stem and progenitor cell lines through ROCK-Cot/Tpl2-MEK-ERK signaling pathway. J Biol Chem, 2014,289(15):10330-10344.
[12] El-Bialy T, Alhadlaq A, Wong B, et al. Ultrasound effect on neural differentiation of gingival stem/progenitor cells.Ann Biomed Eng, 2014,42(7):1406-1412.
[13] Wei FY, Leung KS, Li G, et al. Low intensity pulsed ultrasound enhanced mesenchymal stem cell recruitment through stromal derived factor-1 signaling in fracture healing. PloS One, 2014,9(9):e106722.
[14] He R, Zhou W, Zhang Y, et al. Combination of low-intensity pulsed ultrasound and C3H10T1/2 cells promotes bone-defect healing. International Orthopaedics, 2015,39(11):2181-2189.
[15] Sultan C, Stamenovi D, Ingber D, et al. A computational tensegrity model predicts dynamic rheological behaviors in living cells. Ann Biomed Eng, 2004,32(4):520-530.