多模式CT在后循环缺血性孤立性眩晕中的应用价值
杨潮萍,芮汉臣,范桂梅,张丽华
孤立性眩晕是指不伴有其他局灶性神经功能缺损症状体征及听力损害,可伴有眼震、恶心及呕吐、步态不稳等症状的眩晕。孤立性眩晕可由前庭中枢病变或前庭周围病变引起。目前临床上后循环缺血性孤立性眩晕的诊断标准为:后循环缺血引起的眩晕,但无其他大脑后部、脑干和小脑受累的症状及体征,同时排除所有其他疾病(耳源性、偏头痛、精神疾病或低血压等)导致的眩晕。脑干、小脑卒中等中枢来源的头晕/眩晕(恶性眩晕)与外周性眩晕(良性眩晕)的诊断极易混淆,对表现为孤立性眩晕的卒中患者的诊治,仍是临床工作中的一个巨大挑战。如何早期、准确地识别其中枢性损害,成为诊治孤立性眩晕患者工作中首先需要解决的问题[1]。本研究采用320排CT全脑灌注成像(computed tomography perfusion,CTP)及CT血管成像(computed tomography angiography,CTA),对后循环缺血性孤立性眩晕患者进行血管及早期血流动力学评价,为后循环缺血性孤立性眩晕患者诊断及预后判断提供影像学依据。
1 材料与方法
1.1 一般资料 全部30例患者为2014年6月-2017年4月沧州市中心医院脑科医院神经内科以头晕为主诉,临床诊断为后循环缺血性孤立性眩晕的住院患者。入组标准:①年龄>40岁;②以眩晕为主诉;③符合Essen卒中风险评分量表(Essen Stroke Risk Score,ESRS)对脑血管病危险因素分级>3分。排除标准:①前循环缺血及颅内出血性疾病。②排除耳源性、偏头痛性、低血压性或精神性等其他病因引起的眩晕,如梅尼埃病、前庭神经炎等疾病。③就诊时有感觉障碍、运动障碍、复视、一过性视物黑蒙等神经系统定位体征者。48 h内行320排CT全脑灌注成像与CTA、颅脑磁共振弥散检查。其中男17例,女13例,年龄42~85岁,平均62.8岁。所有患者以眩晕为主要症状,就诊时不伴神经科定位体征或听力证据。
1.2 方法 所有患者均采用320排CT(Aquilion ONE,Toshiba Medical Systems)进行全脑灌注成像检查。扫描参数为:80 kV管电压,112~187 mA管电流,512×512矩阵,320 mm视场,0.35 s旋转时间和0.5 mm×320准直仪。z轴覆盖范围最高达160 m,与患者的头颅尺寸一致,使用双筒高注射器经肘静脉以6 ml/s的速率注射50 ml非离子型对比剂。检查获得数据在Fabric工作站中经软件包处理生成相应的全脑灌注成像和全脑血管成像。由两名神经影像学医师对生成的图像进行评价,手工勾标注兴趣区(region of interest,ROI),并计算测量病变侧与病变对侧镜像区的脑血流量(cerebral blood flow,CBF)、脑血容量(cerebral blood volume,CBV)、平均通过时间(mean transit time,MTT)、达峰时间(time to peak,TTP)等灌注参数。采用北美症状性颈动脉内膜切除术试验(North American Symptomatic Carotid Endarterectomy,NASCET)方法计算血管狭窄分数=(狭窄远端正常血管直径-最狭窄处血管直径)/狭窄远端正常血管直径×100%。血管存在多发狭窄时测量狭窄最重处。血管狭窄程度按狭窄率0、0~29%、30%~69%、70%~99%、100%划分为无狭窄、轻度狭窄、中度狭窄、重度狭窄及闭塞5个等级。椎动脉发育不良指椎动脉管腔均匀变细,≤1/3正常侧管径;一侧椎动脉优势指两侧椎动脉直径差≥0.3 mm,或者一侧椎动脉在CTA相同的视觉角度上以更直的方式连接到基地动脉;椎动脉扭曲指椎动脉颈段弯曲,如螺旋状或有≥2个的弯曲。基地动脉发育不全定义为直径<2 mm。基底动脉迂曲,头颈CTA检查结果显示右侧椎动脉纤细,起始段重度狭窄(图1)。根据椎基底动脉结合处基底动脉的走行路径分为C型(朝向右侧或左侧),S型(多重弯曲)和J型。
1.3 统计学处理 采用SPSS 19.0软件进行分析,计量资料以()表示,组间比较采用t检验,计数资料以频数或百分比表示,组间比较采用χ2检验。P<0.05为差异有统计学意义。
2 结果
30例后循环缺血性孤立性眩晕患者中后循环梗死患者17例,其中延髓梗死4例,脑桥梗死5例,中脑梗死2例,小脑梗死6例,丘脑梗死3例。
2.1 CTA结果 CTA显示25例(83.33%)患者有血管异常,异常血管共98条,其中70条椎基底动脉硬化并狭窄,9条椎动脉起始部扭曲,4条椎动脉先天发育不良,28条颈内动脉系统血管狭窄(表1,图2)。
2.2 CTP结果 22例(73.33%)患者发现存在与临床症状相对应的灌注异常区,发现TTP延迟及MTT延迟者分别为20例和17例,发现CBF下降及CBV下降者分别为16例和13例。灌注异常区的TTP及MTT值高于健侧镜像区(P<0.05),患侧与健侧的CBF及CBV比较未发现存在明显差异(表2,图2)。5例(16.67%)患者CTP结果提示缺血区面积大于梗死核心区。
2.3 CTP阳性与血管狭窄的关系 22例CTP异常的患者中,所有患者患侧均存在责任血管狭窄,其中15例患者血管病变为中、重度狭窄。8例CTP正常的患者中,3例患者患侧存在责任血管狭窄,其中2例患者血管病变为轻度狭窄。责任血管中、重度狭窄患者的CTP阳性率高于责任血管轻度狭窄及无狭窄患者的CTP阳性率(P<0.05)(表3)。

图1 颈基底动脉计算机断层扫描血管成像检查结果
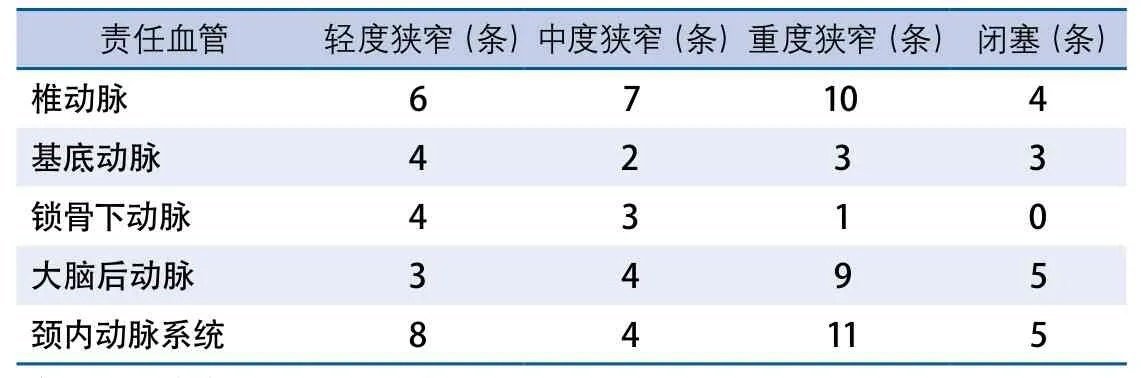
表1 CTA检查发现脑血管狭窄情况
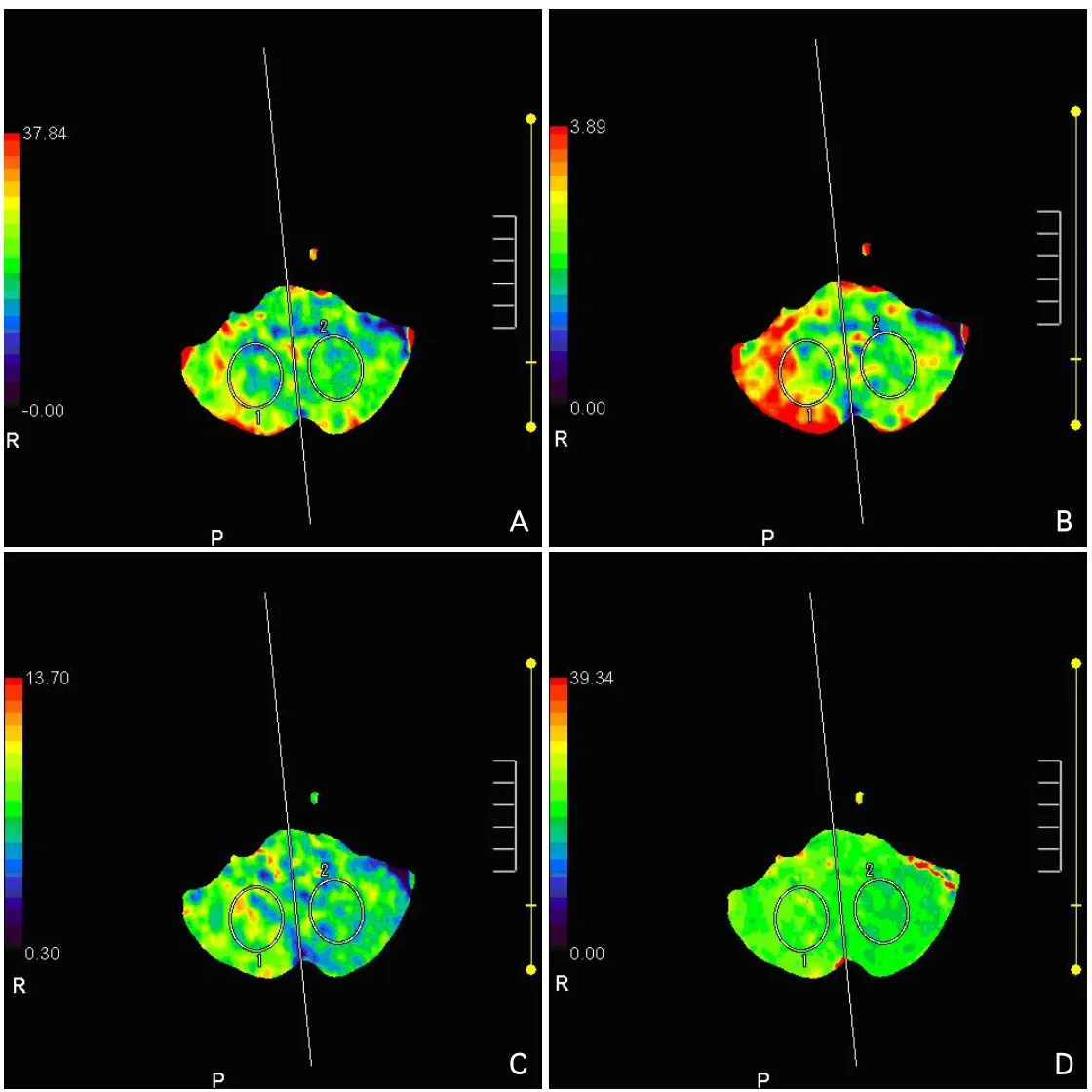
图2 某患者头颅CTP检查结果
3 讨论
眩晕是指自身的一种旋转或线性的运动幻觉,多由前庭神经系统功能性或器质性损害引起,常表现为患者突发的自身和(或)外界物体按一定方向旋转、浮沉、漂移、倾斜或翻滚等。眩晕也是脑血管疾病的常见症状。孤立性眩晕是指有典型的临床眩晕发作而不伴有其他神经系统受累的症状或体征,多由前庭周围病变引起。虽然头晕和眩晕是后循环缺血的常见症状,但头晕和眩晕的常见病因却并不是后循环缺血,单纯的头晕/眩晕极少是后循环缺血的表现。然而临床实践中发现,临床上确实存在这种与后循环缺血相关的孤立性眩晕发作的患者,有关后循环缺血孤立性眩晕的病例报道在国内外也不少见。随着神经影像学及神经耳科技术的发展,越来越多的脑干和小脑等部位的血管性病变引起的中枢性孤立性眩晕被发现[2-3],而这些病变可造成更大的危害,甚至危及患者生命。研究发现后循环缺血可表现为孤立性眩晕发作,而孤立性眩晕可以是后循环缺血或出血的唯一症状。危险因素超过3个以上的病因不明的单纯孤立性眩晕,即使没有脑干和小脑病变的症状和体征,也应按后循环缺血给予相应处理。头颅磁共振弥散加权成像(magnetic resonance imaging-diffusion-weighted imaging,MRI-DWI)是诊断后循环缺血的可靠工具,然而Louis Caplan[4]指出只有85.3%的患者可通过临床和MRI明确梗死部位,其他则被认为是短暂性脑缺血发作(transient ischaemic attack,TIA)或是临床或脑部影像检查不能确定的病变。2013年Stroke杂志中有研究同样指出“那些DWI表现正常的患者中,63%为类卒中患者”[5]。临床工作中发现,部分通过临床症状体征确诊为脑梗死,但DWI无异常的患者,临床症状持续存在可达数天,复查DWI仍为阴性。由此推测存在一部分脑梗死患者,因DWI表现为阴性、临床症状仅为眩晕,而被误诊为前庭周围性眩晕。误诊的概率有多高,用什么方法能将其检出是医学研究人员所需要面对的问题。
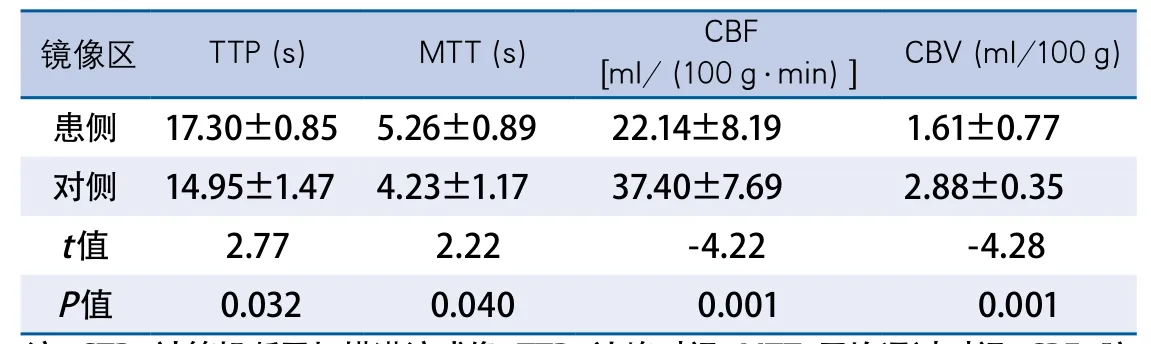
表2 22例CTP异常患者患侧与对侧镜像区的脑灌注参数比较
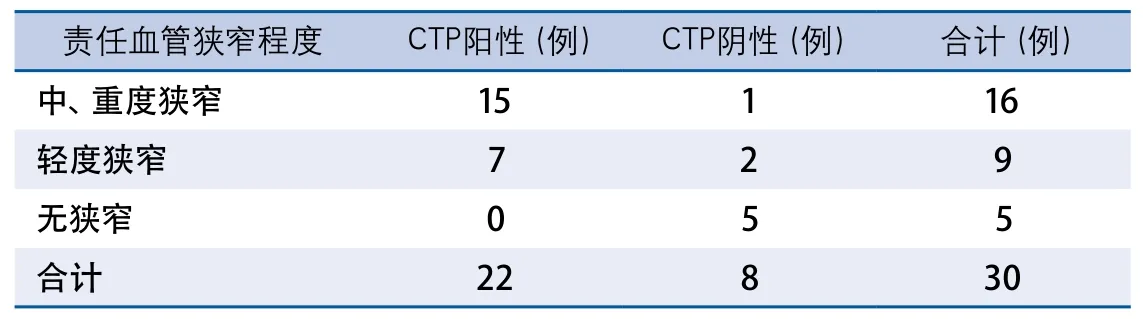
表3 不同狭窄程度责任血管的CTP异常率比较
随着现代先进的影像学技术的发展,更多先进的影像学检查方法被应用于临床诊断和研究。其中,数字减影血管造影(digital subtraction angiography,DSA)被认为是评价血管形态的金标准,然而DSA也有价格昂贵且有创的缺点。CTA是能有效代替DSA的无创性检查手段之一。以往普通CT进行脑CTP检查时,由于Z轴覆盖范围窄,需要根据患者的症状选择最佳层面,在同一个解剖位置行多周期的动态扫描后取得脑灌注扫描的信息。部分病灶可能在扫描层面之外无法显示全脑血流动力学信息,尤其对于后循环系统成像质量不佳。320排CT覆盖范围达16 cm,全脑的各向同性容积数据可以一次获得,可以通过多种方式进行全脑灌注的评价。320排CT作为一种新颖的无创性、一站式成像技术能精确地反映血管形态和脑灌注情况[6],具有0时像差和全脑覆盖成像的优点。CTA能在急性、亚急性和慢性卒中下快速和无创性评估颅内外血管结构,可提供是否存在血管狭窄或闭塞、侧支循环等潜在的重要信息[7]。尤其是CTA检测颅内血管闭塞的敏感性为92%~100%,特异性为82%~100%,阳性预测值为91%~100%,在某些情况下,其准确程度接近甚至超过DSA。CTP可以定量检测组织器官的血灌注状态,早期显示脑血流变化,并能通过MTT、局部CBV、CBF变化间接说明神经元和神经胶质细胞的存活状态[8-9],这一方法较MRI-DWI更敏感,在本报告病例中有5例患者进行CTP检查,结果提示缺血区面积大于梗死核心区。CTP可作为TIA患者首选的影像学检查手段,其对前循环系统灌注情况的评价可等于或优于MRI灌注成像[10]。CTP对诊断后循环系统的缺血性改变同样具有一定的优势[11],并广泛应用于对脑血流动力学的评估。CTP在评价非梗死性脑灌注情况一定程度上可优于MRI[12]。本研究应用320排CT同时,联合进行CTA可从不同角度对后循环缺血性孤立性眩晕进行综合评价,为选择合理的治疗方案提供客观的影像依据。
后循环缺血孤立性眩晕是由于大脑后部、脑干和小脑等部位缺血损伤引起,CTP检查可以用来评价相应脑组织区域的灌注状态。有研究表明,CTP在发病40 min后即可检测出灌注异常区,CTP对TIA的诊断具有显著特异性及敏感性。本研究显示,后循环TIA患者发作间歇期临床症状虽然缓解但影像学仍有异常表现,73.33%(22/30)的后循环缺血性孤立性眩晕的患者其后循环供血区域处于低灌注状态,TTP(20/22)、MTT(17/22)异常率大于CBF(16/22)和CBV(13/22)异常率。TTP和MTT被认为是显示脑灌注损伤的较敏感指标,能早期发现脑缺血性改变,在脑组织缺血损伤过程中,CBF和CBV尚未出现明显变化时,TTP和MTT就已经出现了延长,说明TTP和MTT更易反应缺血过程。血流速度减慢和侧支循环代偿供血导致了TTP的延迟,而由于脑灌注储备受损和灌注压降低则出现了MTT延迟。MTT延迟,CBF正常或轻度降低,CBV正常或略增高,提示该区域脑组织尚保存有血管调节功能[13]。
在本研究30例后循环缺血性孤立性眩晕的患者中,25例(83.33%)患者有血管异常。异常血管包括椎动脉粥样硬化斑块形成、椎动脉血管扭曲、椎动脉先天发育不良和颈动脉粥样硬化斑块形成等。25例血管异常的后循环缺血性孤立性眩晕患者中,22例(73.33%)患者CTP结果显示后循环供血区存在低灌注状态,以上结果充分说明了后循环缺血性孤立性眩晕缺血病变的本质。CTP异常与责任血管狭窄具有相关性,中、重度狭窄患者的CTP阳性率显著高于轻度狭窄及无狭窄患者。另外,本研究中3例血管异常患者并没有相应供血区灌注下降,此现象说明尽管供血动脉狭窄,但是供血区CBF和CBV的变化并不明显,其可能机制为:当发生血管慢性狭窄或闭塞时,侧支循环开放、脑血管狭窄远端血管代偿性扩张,从而使CBF维持在正常水平。针对狭窄椎动脉进行支架置入术可以改善椎基底动脉供血区的低灌注状态,减少TIA发生,预防脑梗死发生,延长无卒中生存期[14],320排CT和CTP能够为后循环缺血性孤立性眩晕的诊断及治疗提供巨大的帮助,有效地避免误诊及治疗时机的延误。
对后循环缺血性孤立性眩晕患者进行后循环血管的结构和功能评价对于患者的诊断、治疗和预后均具有非常重要的意义。多模式CT通过一站式扫描可以获得CT平扫、CTP和CTA图像。CTP检查能发现存在脑血流动力学异常的患者,通过TTP、MTT、CBF、CBV等参数可以有效地评估后循环缺血性孤立眩晕患者脑灌注状态。而头颈CTA则可以对后循环缺血性孤立眩晕患者脑血管有无狭窄及狭窄程度做出准确的评估。CTP和CTA的结合使用有利于后循环缺血性孤立眩晕的诊断和最佳治疗方案的选择。
本研究样本量偏少,尚需进一步扩大样本进一步证实。320排CT在头颅检查中也有不足之处,其成像的空间分辨率仍较DSA低,放射性辐射及对比剂剂量尚待进一步降低。故多模式CT在临床中的应用需进一步探讨。
[1]杨旭.眩晕定位诊断和后循环卒中[J].中国卒中杂志,2015,10(5):413.
[2]CHOI K D,LEE H,KIM J S.Vertigo in brainstem and cerebellar strokes[J].Curr Opin Neurol,2013,26(1):90-95.
[3]杨旭.国内神经科眩晕诊断现况及对策[J].中国卒中杂志,2015,10(5):373-381.
[4]CAPLAN L.Posterior circulation ischemia:then,now,and tomorrow.The Thomas Willis Lecture-2000[J].Stroke,2000,31(8):2011-2023.
[5]BRUNSER A M,HOPPE A,ILLANES S,et al.Accuracy of diffusion-weighted imaging in the diagnosis of stroke in patients with suspected cerebral infarct[J].Stroke,2013,44(4):1169-1171.
[6]SAN MILL Á N RU ÍZ D,MURPHY K,GAILLOUD P.320-multidetector row whole-head dynamic subtracted CT angiography and whole-brain CT perfusion before and after carotid artery stenting:technical note[J].Eur J Radiol,2010,74(3):413-419.
[7]ZHU G,MICHEL P,AGHAEBRAHIM A,et al.Computed tomography workup of patients suspected of acute ischemic stroke:perfusion computed tomography adds value compared with clinical evaluation,noncontrast computed tomography,and computed tomography angiogram in terms of predicting outcome[J].Stroke,2013,44(4):1049-1055.
[8]MAKIN S D,DOUBAL F N,DENNIS M S,et al.Clinically confirmed stroke with negative diffusionweighted imaging magnetic resonance imaging:longitudinal study of clinical outcomes,stroke recurrence,and systematic review[J].Stroke,2015,46(11):3142-3148.
[9]彭佳雯,陆建平,王鹤,等.脑缺血再灌注大鼠模型FAIR-PWI研究[J].中国医学计算机成像杂志,2012,18(1):63-66.
[10]PRABHAKARAN S,PATEL S K,SAMUELS J,et al.Perfusion computed tomography in transient ischemic attack[J].Arch Neurol,2011,68(1):85-89.
[11]VAN DER HOEVEN E J,DANKBAAR J W,ALGRA A,et al.Additional diagnostic value of computed tomography perfusion for detection of acute ischemic stroke in the posterior circulation[J].Stroke,2015,46(4):1113-1115.
[12]CAMPBELL B C,CHRISTENSEN S,LEVI C R,et al.Comparison of computed tomography perfusion and magnetic resonance imaging perfusion-diffusion mismatch in ischemic stroke[J].Stroke,2012,43(10):2648-2653.
[13]张春玲,徐忠宝,李继梅,等.116例大脑中动脉病变患者脑梗死类型分布和脑灌注异常分析[J].中华神经医学杂志,2009,8(1):71-75.
[14]AKINS P T,KERBER C W,PAKBAZ R S.Stenting of vertebral artery origin atherosclerosis in high-risk patients:bare or coated? A single-center consecutive case series[J].J Invasive Cardiol,2008,20(1):14-20.

