脂氧素A4通过p38 MAPK及Nrf2通路调控气道炎症反应
卓乐盈,吴镇杰,于祥,周美茜,李成业,欧阳金生,林琪斌,蔡畅
(1.温州医科大学 第一临床医学院,浙江 温州 325035;2.永嘉县中医院 呼吸科,浙江 温州 325105;3.温州医科大学附属第一医院 呼吸科,浙江 温州 325015)
气道慢性炎症是大多数呼吸道疾病的重要临床病理生理特征。近年来,随着环境污染的逐渐加重,气道慢性炎症性疾病的发生率逐年增长。人体气道与外界环境相通,直接接触各种氧化剂和毒性物质、吸入性过敏原、病原微生物以及空气污染物等,均可通过不同的机制激发炎症反应。
脂氧素(lipoxins,LXs)是一种重要的内源性脂质抗炎介质,能够促进炎症反应的及时消退,被誉为炎症反应的“刹车信号”或“停止信号”[1]。研究发现LXA4及其类似物在小鼠哮喘模型中具有抑制炎症及促进炎症消退的作用,包括增强自然杀伤细胞功能,刺激巨噬细胞表达CD206[2],还可以促进肺损伤的修复[3]。但目前LXs在气道炎症进程中参与的信号通路及其分子调控机制尚未完全清楚。本研究通过脂多糖(lipopolysaccharide,LPS)刺激BEAS-2B细胞,探讨LXA4对气道炎症反应的抑制作用及其所涉及的信号通路。
1 材料和方法
1.1 材料 BEAS-2B细胞株购自中国医学科学院昆明细胞库。LPS、Trizol和DCFH-DA试剂购于美国Sigma公司;LXA4购自美国Cayman Chemical公司;BEGM培养基购自美国Lonza公司;RPMI 1640培养基、胎牛血清购自美国Gibco公司;谷胱甘肽(Glutathione,GSH)检测试剂盒购于南京建成生物工程研究所;BCA试剂盒、细胞浆和细胞核蛋白抽提试剂盒购自上海碧云天生物技术有限公司;人p38、p-p38抗体购自美国Cell Signal Technology公司;人核因子E2相关因子(nuclear factor erythroidderived 2-like 2,Nrf2)、p-Nrf2、核纤层蛋白B1(Lamin B1)抗体购自美国Abcam公司;人β-tubulin抗体购自杭州联科生物公司;SYBR Green realtime PCR Master Mix、反转录-聚合酶链反应试剂盒购自日本Takara公司;引物由上海生工生物工程有限公司合成。
1.2 方法
1.2.1 试剂配制:LPS配成贮存浓度为100μg/mL 的溶液,分装后-20℃保存;为保持试剂稳定性,LXA4用无菌无水乙醇溶解,配成贮存浓度为100 μmol/L 的溶液,分装后-80℃保存备用,使用时取适量溶液,待无水乙醇蒸发完毕后,加入培养基重新溶解。
1.2.2 BEAS-2B细胞培养:BEAS-2B细胞培养于BEGM培养基,按1×105个细胞/mL密度接种到培养瓶,置于37℃,5% CO2培养箱中培养,每2~3 d换液1次,BEAS-2B细胞为贴壁生长,细胞汇集至70%~80%时,按1:3传代。
1.2.3 实验分组及干预:将对数期生长的BEAS-2B细胞分为3组。对照组:不做任何处理;LPS组:100 ng/mL LPS刺激24h;LPS+LXA4组:100 nmol/L LXA4预处理30min,加入100 ng/mL LPS刺激24h。收集细胞或培养上清进行后续实验。
1.2.4 实时荧光定量PCR:以Trizol法提取各组细胞总RNA,并测定RNA浓度及纯度(2.0>A260/A280>1.8)。按照反转录试剂盒操作说明将RNA反转录为cDNA。取cDNA产物用SYBR Green real-time PCR Master Mix进行实时荧光定量PCR,每个样本设3个复孔。采用2-ΔΔCt法进行数据处理,计算实验组相对于对照组的基因表达倍数变化。IL-1β上游引物序列:5’-CCAGGAGAATGACCTGAGCA-3’,下游引物序列:5’-GGAGCGTGCAGTTCAGTGAT-3’;IL-6上游引物序列:5’-TGAGGAGACTTGCCTGGTGA-3’,下游引物序列:5’-TGCAGGAACTGGATCAGGAC-3’;血红素加氧酶-1(heme oxygenase,HO-1)上游引物序列:5’-CAGTGCCACCAAGTTCAAGC-3’,下游引物序列:5’-CTGGATGTTGAGCAGGAACG-3’;醌氧化还原酶[NAD(P)H:quinone oxidoreductase,NQO-1]上游引物序列:5’-AAGCCGCAGACCTTGTGATA-3’,下游引物序列:5’-TGGCAGCGTAAGTGTAAGCA-3’。GAPDH直接从上海生工生物工程公司购买。
1.2.5 流式细胞术:收集各组细胞制备单细胞悬液[细胞数量为(5~6)×106],用PBS清洗2~3次,用0.4mL含1% FBS的PBS重悬细胞,分别加入流式管。各组加入DCFH-DA,37℃孵育20~30min。PBS清洗2~3次,加入0.3mL含1% FBS的PBS重悬细胞,注意避光。用流式细胞仪上机检测,FlowJo.10软件分析实验数据。
1.2.6 GSH含量检测:收集各组细胞[细胞数量为(5~6)×106],用PBS作为匀浆介质破碎后离心取上清,检测细胞内GSH表达水平,测定方法根据南京建成生物工程研究所试剂盒说明书操作。各组设置3个复孔以减少误差。
1.2.7 Western blot:BCA法测定蛋白浓度。抗体浓度分别为:兔抗p38抗体、兔抗p-p38抗体、兔抗Lamin B1抗体、兔抗Nrf2抗体和兔抗p-Nrf2抗体 1:1 000;鼠抗β-tubulin抗体1:4 000,HRP标记的羊抗兔IgG抗体、羊抗鼠IgG抗体1:8 000。用Bio-Rad Image Lab软件分析条带光密度,半定量比值测定分析。
1.3 统计学处理方法 应用SPSS22.0统计学软件进行统计分析。计量资料以±s表示,用Shapiro-Wilk法行正态性检验,用Levene法行方差齐性检验,各组间比较采用单因素方差分析,组间两两比较用LSD法检验,方差不齐采用秩和检验。P<0.05为差异有统计学意义。
2 结果
2.1 LXA4对LPS诱导BEAS-2B细胞产生IL-6和IL-1β的影响 与对照组比,LPS组BEAS-2B细胞IL-6和IL-1β mRNA水平明显升高(P<0.05)。与LPS组比,LXA4+LPS组BEAS-2B细胞IL-6和IL-1β mRNA水平显著降低(P<0.05),见图1。
2.2 LXA4对LPS诱导BEAS-2B细胞氧化应激的影响 炎症反应的发生发展常伴随着大量氧自由基的产生。在LPS的刺激下,BEAS-2B细胞内ROS水平显著上调,差异有统计学意义(P<0.05)。LXA4预处理后,ROS水平明显下降,而GSH水平明显升高,差异均有统计学意义(P<0.05),见图2。
2.3 LXA4对LPS诱导BEAS-2B细胞p38 MAPK通路的影响 p38 MAPK通路在炎症细胞因子的产生过程中有着重要的作用。与对照组比,LPS可显著上调p-p38/p38水平(P<0.01),而LXA4能够明显抑制p-p38的蛋白表达,差异均有统计学意义(P<0.01),见图3。
2.4 LXA4对LPS诱导BEAS-2B细胞Nrf2通路的影响
在LPS的刺激下,BEAS-2B细胞核内Nrf2表达水平显著下降(P<0.01),胞浆Nrf2表达水平上升(P<0.05),Nrf2磷酸化水平下降(P<0.05)。而经LXA4预处理后,核内Nrf2表达水平显著升高(P<0.01),胞浆Nrf2水平明显下降(P<0.05),Nrf2磷酸化水平显著上调(P<0.01),见图4。

图1 各组BEAS-2B细胞IL-6和IL-1β mRNA水平的比较
2.5 LXA4对LPS诱导BEAS-2B细胞Nrf2下游分子表达的影响 与对照组比,LPS组HO-1 mRNA表达水平显著下降(P<0.01),NQO-1 mRNA水平差异无统计学意义(P>0.05)。LXA4预处理后,HO-1和NQO-1 mRNA水平出现显著的上调(P<0.01),见图5。
3 讨论
研究表明支气管上皮细胞在气道慢性炎症以及气管重塑的过程中发挥着重要作用。支气管上皮细胞不仅仅是一层屏障,它可以通过模式识别受体(Toll-like receptor,TLR)识别环境中的刺激物,分泌上皮细胞来源的细胞因子,桥接固有免疫和适应性免疫[4]。活化的支气管上皮细胞可促进Th2型细胞因子的释放,募集并激活其他炎性细胞,发挥主动调节作用,同时诱导上皮下纤维的沉积,促进肺部慢性炎症的发生发展[5]。有研究发现,LXA4在哮喘发病过程中,可以促进NK细胞所介导的粒细胞凋亡,并且可影响NK细胞的细胞毒性作用[6]。本研究发现LXA4具有抑制支气管上皮细胞的炎症反应以及促进炎症消退的作用。在BEAS-2B细胞中,LXA4预处理显著抑制了由LPS引起的促炎因子和ROS的产生,同时LXA4还诱导抗氧化酶和GSH的表达显著上调,并且该作用在一定程度上依赖p38的磷酸化水平和Nrf2的核转位及磷酸化水平。因此,LXA4在气道炎症性疾病中发挥抗炎和抗氧化作用,对肺部炎症的预防和治疗具有一定的作用。

图2 各组BEAS-2B细胞内ROS和GSH水平的比较
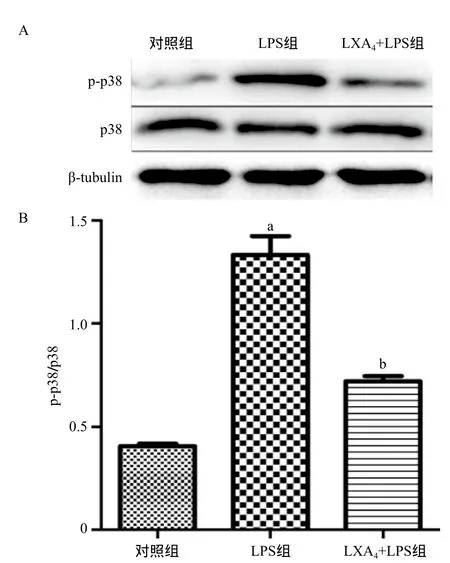
图3 各组BEAS-2B细胞内p-p38和p38表达水平的比较
在过敏性哮喘患者中,由气道上皮细胞合成与释放的IL-6可调节效应性CD4+T细胞的功能,诱导Th1型细胞向Th2型细胞的分化,促进炎症的发生发展,造成肺组织损伤[7-9]。IL-1β是肺部炎性级联 反应中的关键因子,它可刺激细胞黏附分子的产 生,选择性募集炎性细胞,诱导多种细胞因子的表达[10]。因此,抑制促炎细胞因子的产生是控制肺部炎症发生发展的一个重要手段。本研究发现LXA4预处理可显著抑制LPS诱导支气管上皮细胞IL-1β和IL-6 mRNA的表达。这与以往在巨噬细胞、内皮细胞和人视网膜上皮细胞中的研究[11-12]结果一致。

图4 各组BEAS-2B细胞内Nrf2核转位以及磷酸化水平的比较
另外,气道上皮细胞也是直接接触外部环境刺激,产生ROS引起气道氧化应激反应的主要细胞之一[13]。静息状态下,机体内ROS的水平处于动态平衡,并且维持在极低的水平。过量的ROS也能够促进炎症因子以及其他炎症相关调节因子的表达,及时清除ROS可有效抑制炎症的发生发展。LPS可刺激巨噬细胞、中性粒细胞和气道上皮细胞ROS的生成,本研究发现,LXA4能够明显抑制LPS诱导BEAS-2B细胞内的ROS的产生。另外,GSH是重要的内源性抗氧化剂,可直接清除自由基和ROS,保护过氧化诱导的细胞损伤。本研究发现LXA4显著上调了LPS诱导的BEAS-2B细胞胞内GSH的合成与表达。p38 MAPK通路是各种转录因子的上游信号调节器,如NF-κB、AP-1[14],参与炎症反应、细胞增殖、细胞分化和细胞死亡等过程。有研究发现,在中性粒细胞中,LXA4可以降低AP-1与DNA的结合能力,抑制下游炎症相关基因的转录[15]。在气道上皮细胞中,抑制p38 MAPK通路可抑制IL-6的合成与分 泌[16-18]。NF-κB通路的激活能够上调IL-1β的分泌,后者又能够进一步促进NF-κB通路的激活。LPS通过与TLR4结合可快速活化p38 MAPK途径,本研究发现气道上皮细胞在LPS的刺激下,p-p38表达增加,这与气道炎症条件下磷酸化的p38表达水平增高具有一致性,而LXA4可以抑制p38 MAPK途径的激活。因此,LXA4可能通过调控p38 MAPK信号通路抑制促炎因子的表达。该作用与小胶质细胞中的表达一致,而在心肌细胞系H9c2中,LXA4上调了p-p38的表达水平[19-20],造成这种差异的主要原因可能跟细胞类型有关。
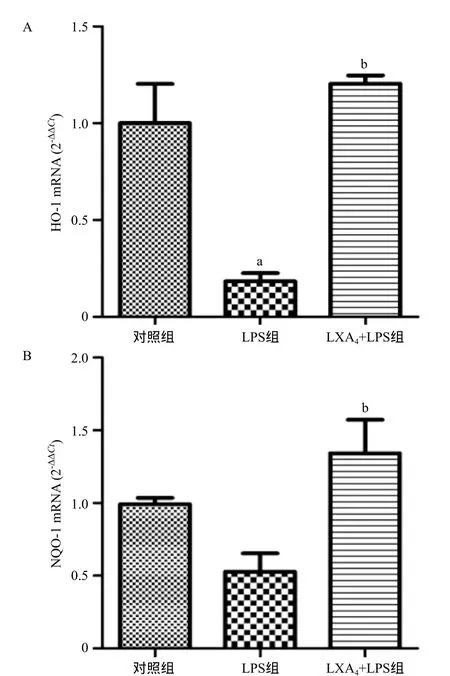
图5 各组BEAS-2B细胞内HO-1及NQO-1 mRNA水平的比较
研究发现,通过激活Nrf2通路能够有效抑制氧化应激反应引起的肺损伤[21]。Nrf2是人体普遍存在的一种抗氧化转录因子,在抑制LPS诱导的氧化损伤中发挥着重要的保护作用[22-23]。在正常状态下,Nrf2主要表达于细胞质内,与细胞质中肌动蛋白结合蛋白KEAP1相互结合,保持在一个低表达状态,且易被泛素蛋白酶体途径迅速降解。当细胞受到氧化剂或毒性物质的刺激时,KEAP1的分子构象发生改变,Nrf2可从KEAP1上解离后活化,而活化后的Nrf2转位进入细胞核内并与抗氧化反应原件(antioxidant response element,ARE)的启动子部位结合,从而促进一系列细胞保护基因和抗氧化酶的表达。Nrf2通路的激活是抗氧化应激反应有效的保护机制。研究发现,COPD患者肺泡巨噬细胞内的HO-1表达下降[24]。NQO-1和HO-1具有显著的抗炎和抗氧化作用,两者的表达受到Nrf2通路下游ARE的调控[25]。本研究发现LXA4能够促进Nrf2的核转位以及磷酸化,同时ARE下游基因NQO-1和HO-1的表达增高。因此,LXA4的抗氧化作用可能与Nrf2通路激活,使得抗氧化酶NQO-1和HO-1的表达水平升高有关。
综上所述,LXA4可减轻LPS引起的BEAS-2B细胞炎症反应并促进炎症消退,其机制可能一方面与抑制p38 MAPK通路、减少促炎因子的分泌有关;另一方面与增强Nrf2的核转位以及磷酸化、减轻氧化应激损伤有关。
[1] 李春来, 张冰缘, 刘再英. 脂氧素在呼吸系统疾病中的研究进展[J]. 中华临床医师杂志(电子版), 2016(11): 197-198.
[2] BORGESON E, JOHNSON A M, LEE Y S, et al. Lipoxin A4 attenuates obesity-induced adipose in flammation and associated liver and kidney disease[J]. Cell Metab, 2015, 22(1): 125-137.
[3] KE Y, ZEBDA N, OSKOLKOVA O, et al. Anti-in flammatory effects of OxPAPC involve endothelial cell-mediated generation of LXA4[J]. Circ Res, 2017, 121(3): 244-257.
[4] QIU Z, ZHOU J, LIU F, et al. Deletion of Shp2 in bronchial epithelial cells impairs IL-25 production in vitro, but has minor in fluence on asthmatic in flammation in vivo[J]. PLoS One, 2017, 12(5): e0177334.
[5] LEONARDI S, VITALITI G, MARSEGLIA G L, et al.Function of the airway epithelium in asthma[J]. J Biol Regul Homeost Agents, 2012, 26(1 Suppl): S41-48.
[6] DUVALL M G, BARNIG C, CERNADAS M, et al. Natural killer cell-mediated inflammation resolution is disabled in severe asthma[J]. Sci Immunol, 2017, 2(9): eaam5446.
[7] hEIJINK I H, NAWIJN M C, HACKETT T L. Airway epithelial barrier function regulates the pathogenesis of allergic asthma[J]. Clin Exp Allergy, 2014, 44(5): 620-630.
[8] KAUR D, BRIGHTLING C. OX40/OX40 ligand interactions in T-cell regulation and asthma[J]. Chest, 2012, 141(2):494-499.
[9] RAJU K R, KUMAR M N, GUPTA S, et al. 5-Aminosalicylic acid attenuates allergen-induced airway inflammation and oxidative stress in asthma[J]. Pulm Pharmacol Ther,2014, 29(2): 209-216.
[10] LI H, YIN J, LI L, et al. Iso flurane postconditioning reduces ischemia-induced nuclear factor-κB activation and interleukin 1β production to provide neuroprotection in rats and mice[J]. Neurobiol Dis, 2013, 54: 216-224.
[11] KURE I, NISHIUMI S, NISHITANI Y, et al. Lipoxin A(4)reduces lipopolysaccharide-induced inflammation in macrophages and intestinal epithelial cells through inhibition of nuclear factor-kappa B activation[J]. J Pharmacol Exp Ther,2010, 332(2): 541-548.
[12] KAVIARASAN K, JITHU M, ARIF M M, et al. Low blood and vitreal BDNF, LXA4 and altered Th1/Th2 cytokine balance are potential risk factors for diabetic retinopa-thy[J].Metabolism, 2015, 64(9): 958-966.
[13] GUAN S P, TEE W, NG D S, et al. Andrographolide protects against cigarette smoke-induced oxidative lung injury via augmentation of Nrf2 activity[J]. Br J Pharmacol, 2013,168(7): 1707-1718.
[14] PARK J, KWAK C H, HA S H, et al. Ganglioside GM3 suppresses lipopolysaccharide-induced inflammatory responses in rAW 264.7 macrophage cells through NF-kappaB, AP-1, and MAPKs signaling[J]. J Cell Biochem, 2018, 119(1):1173-1182.
[15] QI W, LI H, CAI X H, et al. Lipoxin A4 activates alveolar epithelial sodium channel gamma via the microRNA-21/PTEN/AKT pathway in lipopolysaccharide-induced in flammatory lung injury[J]. Lab Invest, 2015, 95(11): 1258-1268.
[16] DOUILLET C D, ROBINSON W P, MILANO P M, et al.Nucleotides induce IL-6 release from human airway epithelia via P2Y2 and p38 MAPK-dependent pathways[J]. Am J Physiol Lung Cell Mol Physiol, 2006, 291(4): L734-746.
[17] FURUSAWA J, MORO K, MOTOMURA Y, et al. Critical role of p38 and GATA3 in natural helper cell function[J]. J Immunol, 2013, 191(4): 1818-1826.
[18] JIN M, KIM S R, YOON S J, et al. Suppressive effects of fructus of Magnolia denudata on IL-4 and IL-13 expression in T cells[J]. In Vitro Cell Dev Biol Anim, 2013, 49(10):805-814.
[19] 周昱, 吴升华, 陈筱青, 等. L X A 4通过p 38 M A P K/N r f 2信号通路诱导H 9 c 2心肌细胞H O-1高表达[J]. 南京医科大学学报(自然科学版), 2012, 32(11): 1493-1498.
[20] WANG Y P, WU Y, LI L Y, et al. Aspirin-triggered lipoxin A4 attenuates LPS-induced pro-in flammatory responses by inhibiting activation of NF-kappaB and MAPKs in BV-2 microglial cells[J]. J Neuroin flammation, 2011, 8: 95.
[21] SMIRNOVA N A, HASKEW-LAYTON R E, BASSO M,et al. Development of Neh2-luciferase reporter and its application for high throughput screening and real-time monitoring of Nrf2 activators[J]. Chem Biol, 2011, 18(6): 752-765.
[22] PARK J, MIN J S, KIM B, et al. Mitochondrial ROS govern the LPS-induced pro-in flammatory response in microglia cells by regulating MAPK and NF-kappaB pathways[J].Neurosci Lett, 2015, 584: 191-196.
[23] YANG H L, LIN M W, KORIVI M, et al. Coenzyme Q0 regulates NFkappaB/AP-1 activation and enhances Nrf2 stabilization in attenuation of LPS-induced in flammation and redox imbalance: Evidence from in vitro and in vivo studies[J]. Biochim Biophys Acta, 2016, 1859(2): 246-261.
[24] FREDENBURGH L E, PERRELLA M A, MITSIALIS S A.The role of heme oxygenase-1 in pulmonary disease[J]. Am J Respir Cell Mol Biol, 2007, 36(2): 158-165.
[25] KIM J, CHA Y N, SURH Y J. A protective role of nuclear factor-erythroid 2-related factor-2 (Nrf2) in in flammatory disorders[J]. Mutat Res, 2010, 690(1-2): 12-23.

