小鼠PD-1及其配体PD-L1胞外区基因的原核表达及亲和性
吕开绩,陈旭东,程开,王路得,朱进顺,Kamara Saidu,张丽芳,朱冠保
(1.温州医科大学附属第一医院 胃肠外科,浙江 温州 325015;2.温州医科大学 分子病毒与免疫研究所 微生物学与免疫学教研室,浙江 温州 325035)
程序性死亡分子1(programmed death-1,PD-1)及其配体(programmed death ligand-1,PD-L1)是属于B7家族的协同刺激分子。PD-1是I型跨膜糖蛋白,由胞外区、疏水性跨膜区、细胞质区组成,CD4+T细胞、CD8+T细胞、NKT细胞、B细胞和单核细胞等在激活后都能表达PD-1分子[1]。PD-L1也属I型跨膜蛋白,同样具有胞外区、疏水性跨膜区、细胞质区,PDL-1可在IFN-γ诱导作用下广泛表达于许多肿瘤细胞表面,研究表明,在黑色素瘤、结肠癌、肺癌等肿瘤中呈现过表达[2]。当PD-1与PD-L1结合后,会启动T细胞的抑制信号转导,显著抑制T细胞活化和增殖,导致细胞毒性T淋巴细胞(cytotoxic T lymphocyte,CTL)的凋亡,使得机体的免疫监控无法识别肿瘤细胞,从而可逃避宿主免疫,最终导致肿瘤的进一步发展[3-4]。阻断该信号转导通路后可以恢复T细胞的功能,因此PD-1/PD-L1介导的信号转导通路正成为肿瘤治疗研究的热门靶点。本研究采用原核表达系统制备了小鼠PD-1胞外区(mPD-1)及其配体PD-L1胞外区(mPD-L1)蛋白,并且用mPD-L1蛋白免疫日本大耳兔从而获得多克隆抗体,并分别应用ELISA和免疫荧光的方法,验证了原核表达的mPD-L1和mPD-1之间的结合亲和性,以及原核表达的mPD-1和天然mPD-L1之间的结合亲和性,为PD-L1过表达的肿瘤的靶向诊断及治疗研究提供基础。
1 材料和方法
1.1 材料 pET21a(+)、pGEX 4T-1克隆载体和E.coliBL21(DE3)为本实验室保存。DNA聚合酶、T4 DNA连接酶、限制性内切酶NedI、XhoI、EcoRI购自美国Thermo公司;异丙基硫代-β-D-硫代吡喃半乳糖苷(isopropyl β-D-thiogalactoside,IPTG)购自美国默克公司;氨苄青霉素购自济南齐鲁药厂;弗式佐剂购自美国Sigma公司;小鼠抗His mAb、小鼠抗GST mAb购自杭州联科生物技术有限公司;HRP标记的山羊抗兔IgG(H+L)抗体和山羊抗鼠IgG(H+L)抗体、FITC标记的羊抗兔IgG(H+L)和羊抗鼠IgG(H+L)购自上海联科生物技术公司;镍螯合亲和层析胶(Ni-NTA Agarose)购自德国Qiagen公司;B16细胞株由本实验室保存;胎牛血清购自美国Gibco公司;RPMI 1640培养基购自美国Hyclone公司;健康日本大耳白兔(雌性,体质量2.0~2.5 kg),来自温州医科大学实验动物中心。动物许可证号:SYXK(浙)2015-0009。
1.2 方法
1.2.1 pET21a(+)/mPD-L1重组质粒的构建及mPDL1蛋白原核表达、纯化和鉴定:全基因合成mPD-L1基因序列,经过原核密码子优化后在其上下游引入限制性内切酶NedI、XhoI酶切位点,克隆至pET21a(+)载体,构建pET21a/mPD-L1重组质粒。将测序正确的重组质粒pET21a(+)/mPD-L1转化至E.coliBL21(DE3)感受态细菌后,接种至15mL LB培养基中(含100μg/mL氨苄青霉素),37℃,震荡培养过夜。再从以上菌液中取10μL加至500mL LB培养基中(含100μg/mL氨苄青霉素),37℃,震荡培养3h。之后经终浓度为1.0mmol/L IPTG 37℃ 诱导6h后收菌,12 000r/min离心5min。经PBS洗涤、离心、超声破菌,12 000r/min离心5min收集上清,进行SDS-PAGE和Western blot分析,以His-tag鼠单抗为一抗,用HRP标签的羊抗鼠IgG作为二抗;进一步收集经IPTG诱导后表达的菌液,1 200r/min,5min离心取沉淀,加入8mol/L尿素使其溶解,经超声破菌处理、离心后弃沉淀,取上清,上清中的蛋白经过Ni-NTA Agarose柱纯化、洗脱,将收集到的蛋白依次在4、2mol/L尿素中透析2h,最后在PBS缓冲液中透析过夜。
1.2.2 制备mPD-L1兔多克隆抗体、测定抗体的效价并鉴定其特异性:用纯化后的mPD-L1蛋白免疫健康的日本大耳白兔,同时设计阴性对照组。1、3、5周对兔子进行隔周免疫。首次免疫方案:将完全弗氏佐剂与500μg mPD-L1蛋白在冰上等量混合充分乳化,之后二次免疫,将不完全弗氏佐剂与500μg mPD-L1等量混合,其余操作如前。每次对每只日本大耳白兔进行背部皮内多点注射。同时,于0、2、4、6周于兔耳缘静脉取血,将收集的血液于37℃水浴内放置1h,之后3 000r/min,4℃离心,25min,分离血清并分装,-80℃保存备用。ELISA检测:用包被液缓冲液(0.05mol/L碳酸缓冲液,pH 9.6)稀释纯化的mPD-L1蛋白以10μg/mL的浓度加入酶标板孔中,设2个复孔,4℃过夜;5%脱脂奶粉按1:80稀释0、2、4、6周血清为一抗,羊抗兔IgG-HRP为二 抗;验证免疫血清中mPD-L1蛋白特异IgG抗体效价持续上升后,于第6周从兔心脏取血,收集血清方法如上。第6周血清抗体效价用间接ELISA法检测,将mPD-L1蛋白以10μg/mL的浓度包被96孔板,4℃过夜,第2天分别将第6周免疫兔血清进行倍比稀释,初始的稀释度为1:50,之后以5倍的稀释比倍比稀释,直至稀释比为1:781 250,稀释后的血清为一抗,二抗为HRP标记的羊抗兔IgG。将96孔板置于酶标仪在450 nm处读取吸光度值,所有血清标本均设置2个复孔检测,同时将PBS与弗式佐剂免疫后混合乳化,免疫得到的血清作为阴性对照。将mPD-L1蛋白经SDS-PAGE后转膜,将多克隆兔血清(以1:5 000稀释)作为一抗,HRP标记的羊抗兔IgG(H+L)作为二抗,检测兔血清中mPD-L1蛋白特异IgG抗体对mPD-L1蛋白的特异性识别和结合能力。
1.2.3 pGEX-4T-1/mPD-1重组质粒构建及mPD-1蛋白原核表达纯化和鉴定:全基因合成mPD-1基因序列,经原核密码子优化后在其上下游引入限制性内切酶XhoI、EcoRI酶切位点,克隆至pGEX-4T-1质粒,构建pGEX-4T-1/mPD-1重组质粒。将测序正确的重组质粒pGEX-4T-1/mPD-1转化至宿主菌E.coliBL21(DE3)感受态细菌后中,挑单克隆接种于15mL LB液体培养基中(含100μg/mL氨苄青霉素),37℃,振荡培养过夜。次日取10mL菌液加至500mL LB液体培养基中,37℃振荡培养3h,诱导方法如前。离心收集菌体,先用PBS洗涤1次,然后用适量尿素重悬沉淀,超声波裂解,12 000r/min,离心5min,取上清和用尿素溶解后的沉淀分别进行SDS-PAGE分析,结果提示上清中含有大量mPD-1蛋白。收集上清,用GST纯化柱进行纯化,用pH 7.3的平衡缓冲液过柱,然后将获得的上清上样,结束后继续加入平衡缓冲液,随后经pH 8.0洗脱缓冲液(含50mmol/L Tris-HCl,10mmol/L还原型谷胱甘肽)将融合蛋白洗脱下来并收集。将GST-tag单抗为用作一抗,然后用HRP标记的羊抗鼠IgG(H+L)为二抗,进行Western blot分析和鉴定。
1.2.4 ELISA检测mPD-1和mPD-L1的亲和性:用包被液缓冲液稀释mPD-L1蛋白至终浓度为10μg/mL,以每孔100μL的量包被ELISA板,4℃过夜。次日用PBS洗涤3次后用5%脱脂牛奶37℃封闭1h;PBST(含0.5mL/L Tween 20)洗涤3次后,用同浓度脱脂牛奶稀释mPD-1蛋白,以10μg/mL(100μL)加至包被的孔上37℃反应1.5h,PBS-T洗涤4次,加入抗GST小鼠单克隆抗体(1:5 000),37℃反应1.5h 后,PBS-T洗涤3次,加入HRP标记的山羊抗鼠IgG(1:10 000),37℃反应1h,PBS-T洗涤4次,将TMB显色液以每孔100μL的量加至96孔板,37℃避光显色10min,加50μL终止液(2mol/Lh2SO4)终止反应。本研究中利用mPD-1携带GST标签能与GST-鼠单抗特异性结合作为检测指标,分别以未加mPD-1蛋白、mPD-L1蛋白、抗GST单克隆抗体作为3个阴性对照,反应结果置酶标仪于450 nm处读取吸光度值,利用Graphpad6.0软件绘制相应图表。
1.2.5 免疫荧光体外验证mPD-1对天然PD-L1的亲和性:以常规方法复苏传代以B16细胞(小鼠黑色素瘤细胞)。将B16细胞以10 000/孔的量铺在48孔板上,同时加以100 ng/mL的IFN-γ以诱导PD-L1的表达,设置阴性对照,将48孔板放置于37℃,5% CO2培养箱内过夜。实验组和对照组同时添加200μg/mL 过滤后的mPD-1蛋白,孵育6h;用PBS洗涤,经4%多 聚甲醛固定15min;0.3% Triton-X100,处理15min。 20%胎牛血清(培养基)封闭1h,37℃。用PBS洗涤后,加一抗(GST-鼠抗1:2 000)37℃ 1h;洗涤后FITC抗鼠37℃孵育1h,PBS-T洗3次。每孔加入的PI 30μL染核5min,之后加入20μL RNA酶抑制剂PBS-T洗3次,避光,载玻片上滴荧光粹灭剂,细胞面朝下放在载玻片共聚焦显微镜下观察,并拍照。
1.3 统计学处理方法 采用SPSS20.0软件,组间比较采用单因素方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 pET21a(+)/mPD-L1重组质粒构建及mPD-L1蛋白原核表达、鉴定、纯化 mPD-L1全长663个碱基,经密码子碱基优化后全基因序列合成,并经NedI、XhoI酶切位点作用后克隆至克隆载体pET21a(+)内,构建pET21a(+)/mPD-L1重组质粒,之后将重组质粒送至测序,见图1,经测序鉴定正确。经IPTG诱导后,重组质粒E.coliBL21(DE3)中表达,一条明显蛋白条带出现在相对分子质量为25 kDa的位置,与预期蛋白大小相一致。同时将纯化后的mPDL1蛋白经SDS-PAGE分析,在相对分子质量25 kDa的位置处同样出现与预期蛋白大小相一致的单一的蛋白条带。Western blot检测结果显示,在25 kDa处出现同样单一反应带,见图2。


图1 重组质粒pET21a(+)/mPD-L1构建和鉴定图
2.2 mPD-L1兔多克隆抗体效价测定及特异性鉴定 将纯化后的PD-L1蛋白作为包被抗原检测兔0、2、4及6周血清mPD-L1特异性IgG抗体的效价,mPD-L1蛋白免疫组兔血清于免疫后第2周开始,多克隆抗体效价逐渐升高,至第6周达高峰。ELISA检测结果显示,第6周mPD-L1蛋白免疫组兔多克隆抗体IgG的效价可达1:156 250。多克隆抗体经Western blot鉴定后在25 kDa处出现单一条带,见图3。
2.3 pGEX-4T-1/mPD-1重组质粒构建及mPD-1蛋白原核表达、鉴定和纯化 mPD-1蛋白全长447个碱基,经原核密码子碱基优化后送至公司全基因合成,并经EcorI、XhoI酶切位点克隆至pGEX-4T-1载体,构建pGEX-4T-1/mPD-1重组质粒,经测序鉴定正确,见图4。重组质粒经IPTG诱导表达,收菌后得到的菌液用PBS溶解,之后超声裂解后取上清,经SDS-PAGE电泳分析后在相对分子质量约40 kDa的位置得到一条明显蛋白条带,与预期蛋白大小相符。同时将纯化后的mPD-1蛋白经上述电泳方法进行分析,结果显示纯化后的蛋白与预期蛋白大小相符。经Western blot检测,在40 kDa处出现单一反应带,见图5。2.4 ELISA法检测mPD-1/mPD-L1结合活性 实验组(PD-L1+PD-1+GST)与对照组(PD-L1+GST、PD-1+GST、PD-L1+PD-1)的OD450值分别为0.907±0.038、0.016±0.001、0.063±0.009、0.018±0.001,差异有统计学意义(P<0.01),表明mPD-1蛋白与mPD-L1蛋白在体外能够特异性结合,具有良好的亲和性。2.5 体外免疫荧光的亲和性验证 在经IFN-γ诱导后的B16细胞膜可见强绿色的点状或团块状绿色荧光斑点,而未经IFN-γ诱导的细胞株未见明显的绿色荧光斑点,见图6。

图2 mPD-L1蛋白的SDS-PAGE及Western blot图

图3 兔多克隆抗体的效价测定以及特异性鉴定
3 讨论
PD-L1和PD-1特异性结合后会负性调控在活化T细胞表面的PD-L1所介导的信号通路,从而使T细胞的活化和增殖受到显著抑制,并且导致某些细胞因子表达和分泌失常,如IFN-γ、IL-2。已有研究发现PD-L1调控的免疫耐受能够导致肿瘤细胞逃避免疫监视以及某些病毒的慢性感染及其他多种相关的自身免疫性疾病[5-8]。PD-L1能够在IFN-γ诱导后高效地表达在肿瘤细胞表面,进一步加剧PD-1/PD-L1通路的抑制性调控信号,导致机体出现异常低下的免疫功能,T细胞部分甚至全部丧失功能,淋巴细胞介导的免疫应答受到抑制,从而导致肿瘤细胞逃避CTL的杀伤和清除[9]。研究表明,利用PD-1或PDL1的抗体特异性阻断PD-1/PD-L1信号通路途径,可恢复T细胞活性,并抑制肿瘤的生长[11],因此,阻断PDL-1/PD-1介导的负性调控机制已成为临床上肿瘤免疫疗法或抗病毒感染治疗的新策略,干扰PD-1/PD-L1信号途径已成为目前治疗PD-L1表达肿瘤的新方法[11-13]。目前,美国FDA已经批准PD-1/PD-L1单克隆抗体上市用于治疗PD-L1高表达的肿瘤,如:Atezolizumab、Durvalumab、Avelumab。
本研究采用原核表达系统,高效表达并且纯化mPD-L1和mPD-1蛋白,发现mPD-1蛋白存在于上清中,因此利用GST纯化柱将其纯化,而mPD-L1蛋白则存在于包涵体内,因此用变性缓冲液将其变性,之后再用尿素梯度透析将其复性并且用Western blot将获得的蛋白进行验证。利用mPD-L1免疫日本大耳白兔制备了mPD-L1的多克隆抗体,并且通过ELISA测定该抗体的效价,通过Western blot鉴定该抗体的特异性,结果显示多克隆抗体在1:156 250稀释时仍然有较高的效价,并且能够特异性识别mPD-L1蛋 白,后期可以将该抗体用于组织水平验证PD-L1的表达。该多克隆抗体与本实验室制备的其他抗体一 样,均有较高的效价以及良好的特异性[14]。进一步采用ELISA,通过与对照组的对比,发现mPD-L1蛋 白与mPD-1蛋白在体外能够结合,应用免疫荧光验证了mPD-1能够与细胞表面天然存在的PD-L1蛋白结合。
综上所述,经原核细胞表达并纯化后获得的mPD-L1和mPD-1蛋白之间具有良好的亲和性,同时本研究在细胞水平验证了mPD-1蛋白与细胞表面的天然PD-L1之间也具有特异性结合的亲和性。mPD-1能否阻断在体PD-1/PD-L1通路达到肿瘤的治疗作用尚待后续进一步研究。通过同源性匹配分析发现人源性PD-L1全长蛋白和鼠源性PD-L1全长蛋白同源性达到69%,其胞外区蛋白的同源性达到了73%。因此,本研究获得的mPD-1原核蛋白也可为人源PD-L1阳性肿瘤的诊断和治疗方面的研究提供实验基础。

图4 重组质粒pGEX-4T-1/mPD-1构建和鉴定图

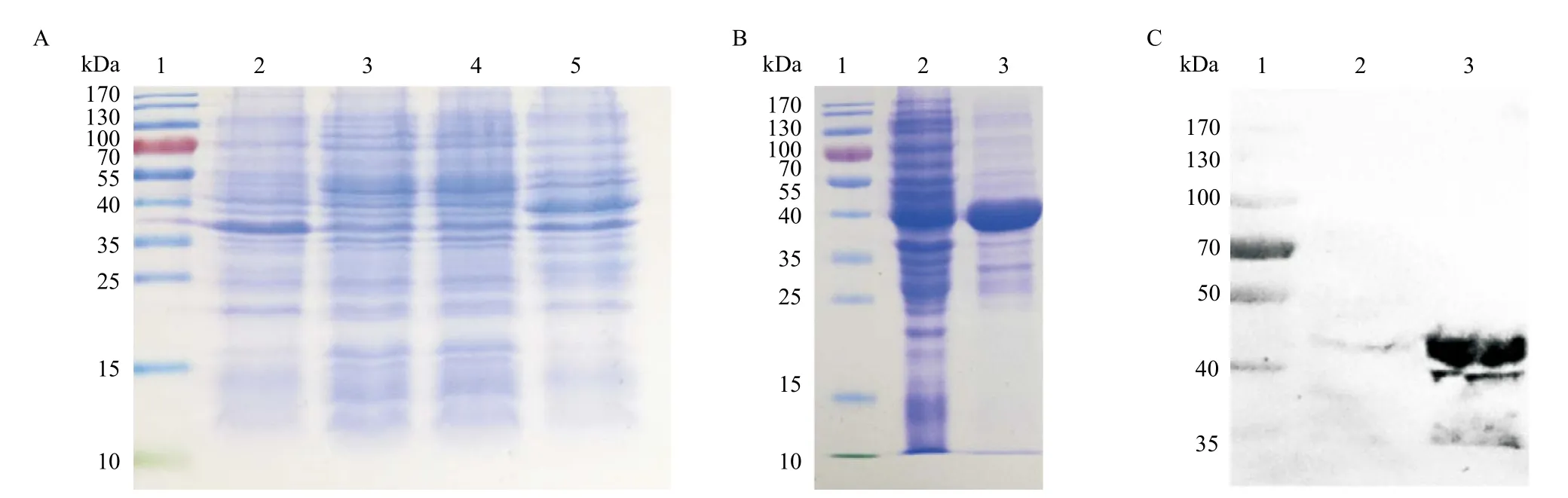
图5 mPD-1蛋白的SDS-PAGE以及Western blot图

图6 mPD-L1兔多克隆抗体间接免疫荧光检测(×400)
[1] GREENWALD R J, FREEMAN G J, SHARPE A H. The B7 family revisited[J]. Annu Rev Immunol, 2005, 23: 515-548.
[2] 覃晓林, 刘朝奇, 杨凡, 等. 小鼠P D L-1胞外区基因表达、纯化及其多克隆抗体的制备[J]. 细胞与分子免疫学杂志,2010, 26(6): 569-571.
[3] DAY C L, KAUFMANN D E, KIEPIELA P, et al. PD-1 expressionon HIV specific T cells is associated with T-Cell exhaustion and disease progression[J]. Nature, 2006, 443(7109): 350-354.
[4] MUMPRECHT S, SCHURCH C, SCHWALLER J, et al.PD-1 signaling onchronicmyeloid leukemia-Specific T cells results in T cell exhaustion and disease progression[J].Blood, 2009, 114(8): 1457-1458.
[5] PLEGE A, BORNS K, BAARS W, et al. Suppression of human T-cell activation and expansion of regulatory T cells by pig cells over expressing PD-ligands[J]. Transplantation,2009, 87(7): 975-982.
[6] WANG S, BAJORATH J, FLIES D B, et al. Molecular modeling and functional mapping of B7-H1 and B7-DC uncouple costimulatory function from PD-1 interaction[J]. J Exp Med, 2003, 197(9): 1083-1091.
[7] GAO Q, WANG X Y, QIU S J, et al. Over expression of PDL1 significantly associates with tumor aggressiveness and postoperative recurrence in human hepatocellular carcinoma[J]. Clin Cancer Res, 2009, 15(3): 971-979.
[8] KEIR M E, FRANCISCO L M, SHARPE A H. PD-1 and its ligands in T-cell immunity[J]. Curr Opin Immunol, 2007, 19(3): 309-314.
[9] IWAI Y, TERAWAKI S, IKEGAWA M, et al. PD-1 inhibits antiviral immunity at the effecctor phase in the liver[J]. J Exp Med, 2003, 198(1): 39-50.
[10] DONG H, STROME S E, SALOMAO D R, et al. Tumorassociated B7-H1 promotes T-cell apoptosis:A potential mechanism of immune vasion[J]. Nat Med, 2002, 8(8):793-800.
[11] REYNOSO E D, ELPEK K G, FRANCISCO L, et al. Intestinal tolerance is converted to autoimmune enteritis upon PD-1 ligand blockade[J]. J Immunol, 2009, 182(4): 2102-2112.
[12] NIKOLOVA M, LELIEVRE J D, CARRIERE M, et al. Regulatory T cells differentially modulate the maturation and apoptosis ofhuman CD8+ T-cell subsets[J]. Blood, 2009,113(19): 4556-4565.
[13] 贺宇飞, 张桂梅, 王小红, 等. P D-1胞外段c D N A在真核细胞的表达与其功能鉴定[J]. 生物工程学报, 2004, 20(5):699-703.
[14] 蔡一奇, 程开, 陈旭东, 等. M A G E-A 3多克隆抗体的制备及在胃癌细胞检测中的应用[J]. 温州医科大学学报, 2017,47(5): 318-324.

