胚胎干细胞分泌因子增强AML-12细胞抗凋亡能力
林武,黄昭帅,鲍苗,陈肖鸣
(温州医科大学附属第一医院 小儿外科,浙江 温州 325015)
得益于胚胎干细胞(embryonic stem cell,ESC)的多向分化潜能,其为终末期肝脏疾病提供了可观的潜在细胞移植供体。和体外培养的人原代肝细胞相比,诱导而来的“肝细胞样细胞”的表型相对不成熟[1-6],表现出与人体胚胎肝更相近的功能及表型特征[7]。然而即使是这样不成熟的肝细胞却也能很大程度地改善肝功能[8-9]。另外,在细胞移植中约只有10%的移植细胞存活[10-11]。近年来,ESC分泌因子的细胞保护作用逐渐被人们揭示,我们假设ESC移植治疗肝脏损伤疾病的成功不仅是细胞移植本身的组织替代作用,其分泌的细胞因子也能够帮助肝细胞抵抗凋亡,修复肝损伤。
1 材料和方法
1.1 材料 DMEM/F12、丙酮酸钠、非必需氨基酸、 2-巯基乙醇、胎牛血清(fetal bovine serum,FBS)、 0.25%胰酶EDTA购于美国Gibco公司;核酸混合物、白细胞抑制因子(leukemia inhibitory factor,LIF)购于美国Millipore公司;胰岛素转铁蛋白硒混合物(insulin-transferrin-selenium,ITS)、双抗(100 U/mL青霉素、100μg/mL链霉素)购于美国Invitrogen公司;地塞米松、MTT试剂盒购于美国Sigma公司;CO2细胞培养箱购于美国Thermo公司;缺氧装置购于加拿大Stemcell Technologies公司;Seahorse线粒体应激检测试剂盒购于美国Agilent公司。
1.2 方法
1.2.1 细胞培养:ESC(F12)细胞系由美国罗格斯大学医学院Melitta Schachner教授赠予;完全培养基为15% FBS、1%丙酮酸钠、1%非必需氨基酸、1%核酸混合物、0.2% 2-巯基乙醇、1%双抗、0.01% LIF;基础培养基为高糖DMEM(含L-谷氨酰胺),培养ESC时需要每天加入0.01% LIF以维持ESC的未分化状态。解冻ESC,接种到用丝裂霉素处理的铺满成纤维细胞滋养层的培养皿中,在传过3~4代之后,成纤维细胞滋养层细胞基本去除干净,ESC悬浮培养于其完全培养基中。本课题中以其完全培养基为对照培养基即CON-M;ESC每2~3 d传1代,并收集上清液,此ESC上清液即为条件培养基即ESC-M。细胞于含5% CO2、37℃的细胞培养箱中培养。AML-12细胞系为一种鼠源性肝细胞系,从美国ATCC公司购入;AML-12细胞完全培养基(简写为CM)为10% FBS、1% ITS、40 ng/mL地塞米松、1%双抗、88% DMEM/F12。
1.2.2 AML-12细胞的培养方法:常规细胞培养:AML-12细胞培养于CM中,并置于含5% CO2、21% O2、37℃的细胞培养箱中;缺氧环境培养:AML-12分别培养于CON-M和ESC-M中,并置于5% CO2、1% O2、 37℃的缺氧装置中;室内环境培养:AML-12分别培养于CON-M和ESC-M中,并直接置于室内非细胞培养箱环境中(极低CO2浓度、21% O2、20℃);无血清培养:分别用CON-M和ESC-M处理AML-12细胞48h后,胰酶消化并按照每孔6 000个细胞数目的浓度重悬2种不同处理的细胞在CM中并接种于96孔板中,待细胞在细胞培养箱过夜贴壁后,将细胞培养液换成去除血清的CM继续培养。
1.2.3 MTT细胞活性测定:取接种于96孔板中的AML-12细胞,弃旧液,每孔加入100 µL含0.5 mg/mL MTT的CM培养基继续培养3h,弃培养基,加入150 µL DMSO摇床摇晃溶解10min后,立即在酶标仪中测定570 nm处的OD值。每组做3次重复,并做3次独立重复实验。
1.2.4 Seahorse细胞代谢呼吸动态分析:根据Agilent的Seahorse线粒体应激检测试剂盒说明书来操作,步骤如下:分别用CON-M和ESC-M培养AML-12细胞48h后,胰酶消化并按照每孔种6 000个细胞数目的浓度重悬2种不同处理的细胞在CM培养基中并接种于Seahorse XFp细胞板中,待细胞在培养箱中过夜贴壁后,将细胞培养基换成Seahorse XFp基础培养基,并在37℃烘箱中作用1h,之后将培养板的盖子换成事先在不同通道中加入相应呼吸链抑制剂的特殊盖子并加载入Seahorse分析仪中,分析仪自动加药并测量细胞的耗氧量以及细胞外酸化率。每组做3次重复,并做3次独立重复实验。
1.3 统计学处理方法 采用GraphPad Prism 6.0软件进行统计学分析。计量资料以±s表示,运用独立样本t检验进行2组比较,多组比较采用单因素方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 正常培养环境下AML-12细胞在3种培养基中的细胞活性比较 分别用ESC-M、CON-M和CM培养AML-12细胞,并置于含5% CO2、21% O2、37℃的细胞培养箱中,MTT法比较各实验组细胞活性情况。结果显示在正常培养环境下,AML-12细胞在3种培养基中细胞活性及生长情况差异均无统计学意义(P>0.05)。见图1。
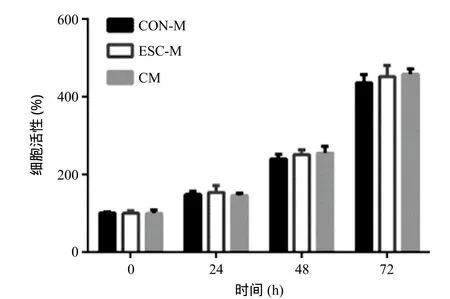
图1 AML-12细胞在3种培养基中的细胞活性比较
2.2 极端培养环境中AML-12细胞在2种培养基中的细胞活性比较 分别用CON-M和ESC-M培养AML-12细胞,并分别置于缺氧环境和室内非细胞培养箱环境(极低CO2浓度、20℃)中,MTT法比较各实验组细胞活性情况。结果显示在缺氧环境中,AML-12细胞生长缓慢且在ESC-M中培养的AML-12细胞显示出更强的增殖能力(见图2A-C)。在室内非细胞培养箱环境中,AML-12细胞逐渐凋亡且在ESC-M中培养的AML-12细胞显示出更持久的耐受能力(见图2D-F)。

图2 AML-12细胞在不同培养基中对极端环境的适应性比较
2.3 被ESC上清液处理之后AML-12细胞对无血清培养基的耐受性 分别用CON-M和ESC-M处理AML-12细胞48h后,MTT法比较不同处理组AML-12细胞在其无血清完全培养基中的细胞生长情况,结果显示细胞逐渐凋亡且被ESC-M处理后的AML-12细胞表出现出更强的无血清培养耐受能力,见图3。
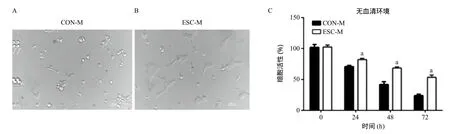
图3 被不同培养基处理之后AML-12细胞对无血清环境的耐受能力比较
2.4 被胚胎干细胞上清液处理之后AML-12细胞的糖酵解潜力和氧化呼吸潜力 Seahorse细胞代谢呼吸动态分析显示,被CON-M和ESC-M处理之后的AML-12细胞,其基础呼吸情况以及糖酵解情况类似。当用ATP合酶抑制剂寡霉素抑制氧化呼吸链ATP合成后,ESC-M组的AML-12细胞表现出更强的细胞糖酵解潜力;以解偶联剂FCCP干预后,ESC-M组的AML-12细胞表现出更强的氧化呼吸能力及氧化呼吸潜力,见图4。
3 讨论
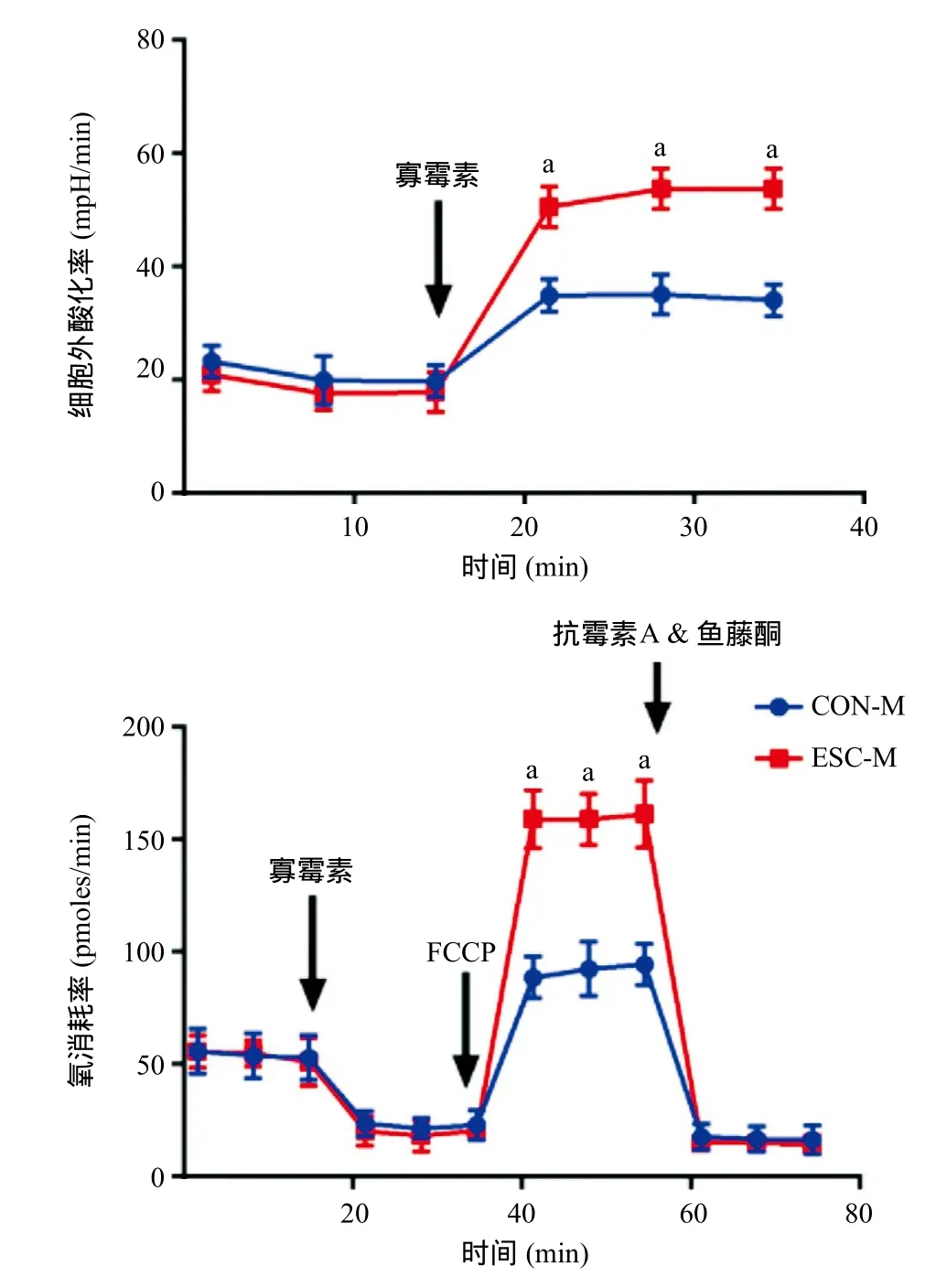
图4 被不同培养基处理之后AML-12细胞代谢呼吸情况比较
研究表明对急性肝损伤小鼠进行间充质干细胞(mesenchymal stem cells,MSCs)移植能够减轻肝脏结构紊乱和肝细胞功能的下降程度,并且能够促进肝脏的再生[12-13]。陈棉等[14]研究发现在体外缺氧条件下MSCs凋亡膜微粒可促进心脏成纤维细胞的增殖和胶原合成能力。陈志文等[15]研究发现MSCs移植增强了子宫切口的再生愈合,提高了切口局部的机械张力,有望降低再次妊娠时子宫破裂的风险。MSCs对急性肝损伤的治疗作用的具体机制目前并不明确,其分泌的细胞因子可能是发挥作用的关键,已经有研究发现MSCs的上清液能够改善肝脏损伤情况[16-18]。WOO等[19]单纯给急性肝损伤小鼠注射由ESC分化而来的不成熟“肝细胞样细胞”细胞分泌因子,发现在不进行细胞移植的情况下,肝脏也出现明显的再生和修复,并且证明了细胞移植治疗的成功不单单是移植的细胞取代了组织,还可能是由于移植细胞的分泌因子促进了组织的再生。MORIYA等[20]将未分化的ESC移植在已经用四氯化碳引起的肝纤维化的小鼠脾中,发现移植了ESC之后,小鼠肝脏的纤维化情况明显好转。这些研究都显示出ESC的分泌因子在肝脏疾病治疗中的应用价值。
本研究以鼠源性肝细胞系AML-12细胞来研究ESC上清液(即ESC-M培养基)对肝细胞在极端环境中抗凋亡能力的影响,研究发现ESC-M能够增强AML-12细胞在缺氧环境中的适应性,增强其在血清剥夺以及室内非细胞培养环境中的耐受能力。同时用Seahorse细胞代谢分析仪对分别经过CON-M和ESCM处理后的AML-12细胞呼吸代谢情况进行分析,当用ATP合酶抑制剂寡霉素抑制氧化呼吸链ATP合成之后,细胞所需能量全部由糖酵解提供,而糖酵解的产能效率低下,为满足细胞对能量的需求,糖酵解加快发生,此时以细胞外酸化率间接反应的细胞糖酵解能力为细胞最大糖酵解能力,结果显示ESCM处理组的AML-12细胞表现出更强的细胞糖酵解潜力。解偶联剂FCCP使得质子大量回流但不产生ATP,从而使得细胞大量耗氧,此时以细胞氧消耗率反应的细胞氧化呼吸能力为细胞最大氧化呼吸能力,同样显示ESC-M处理组的AML-12细胞表现出更强的细胞最大氧化呼吸能力以及氧化呼吸潜力。这与我们之前发现ESC-M中的AML-12细胞在缺氧、血清剥夺以及其他恶劣环境下具有更强适应性相吻合。
LOTFINIA等[12]研究发现血管内皮生长因子(vascular endothelial growth factor,VEGF)在MSC上清液对急性肝损伤中肝细胞的修复具有重要作用,而WANG等[21]发现ESC-M与CON-M相比,VEGF含量显著上升,这提示ESC-M中的VEGF或许是增强AML-12细胞抗凋亡能力的关键。然而SINGLA等[22]研究却发现ESC-M中TIMP1是抑制H9c2细胞凋亡的关键。
本研究发现ESC上清液能够增强AML-12细胞在极端环境中的抗凋亡能力。后续对其具体分泌因子的研究和机制的挖掘或许能够给肝脏疾病以及其他与细胞凋亡相关疾病的治疗提供新的思路,也可能对细胞的保存和运输提供借鉴意义。
[1] SULLIVAN G J, HAY D C, PARK I H, et al. Generation of functional human hepatic endoderm from human induced pluripotent stem cells[J]. Hepatology, 2010, 51(1): 329-335.
[2] SI-TAYEB K, NOTO F K, NAGAOKA M, et al. Highly efficient generation of human hepatocyte-like cells from induced pluripotent stem cells[J]. Hepatology, 2010, 51(1):297-305.
[3] BASMA H, SOTO-GUTIERREZ A, YANNAM G R, et al.Differentiation and transplantation of human embryonic stem cell-derived hepatocytes[J]. Gastroenterology, 2009,136(3): 990-999.
[4] hAY D C, FLETCHER J, PAYNE C, et al. Highly efficient differentiation of hESCs to functional hepatic endoderm requires ActivinA and Wnt3a signaling[J]. Proc Natl Acad Sci U S A, 2008, 105(34): 12301-12306.
[5] AGARWAL S, HOLTON K L, LANZA R. Efficient differ-entiation of functional hepatocytes from human embryonic stem cells[J]. Stem Cells, 2008, 26(5): 1117-1127.
[6] CAI J, ZHAO Y, LIU Y, et al. Directed differentiation of human embryonic stem cells into functional hepatic cells[J].Hepatology, 2007, 45(5): 1229-1239.
[7] BAXTER M, WITHEY S, HARRISON S, et al. Phenotypic and functional analyses show stem cell-derived hepatocytelike cells better mimic fetal rather than adult hepatocytes[J].J Hepatol, 2015, 62(3): 581-589.
[8] hE Z Y, DENG L, LI Y F, et al. Murine embryonic stem cell-derived hepatocytes correct metabolic liver disease after serial liver repopulation[J]. Int J Biochem Cell Biol, 2012,44(4): 648-658.
[9] BASMA H, SOTO-GUTIERREZ A, YANNAM G R, et al.Differentiation and transplantation of human embryonic stem cell-derived hepatocytes[J]. Gastroenterology, 2009,136(3): 990-999.
[10] SCHIERLE G S, HANSSON O, LEIST M, et al. Caspase inhibition reduces apoptosis and increases survival of nigral transplants[J]. Nat Med, 1999, 5(1): 97-100.
[11] EMGARD M, HALLIN U, KARLSSON J, et al. Both apoptosis and necrosis occur early after intracerebral grafting of ventral mesencephalic tissue: a role for protease activation[J]. J Neurochem, 2003, 86(5): 1223-1232.
[12] LOTFINIA M, KADIVAR M, PIRYAEI A, et al. Effect of secreted molecules of human embryonic stem cell-derived mesenchymal stem cells on acute hepatic failure model[J].Stem Cells Dev, 2016, 25(24): 1898-1908.
[13] LIU Z, MENG F, LI C, et al. Human umbilical cord mesenchymal stromal cells rescue mice from acetaminophen-induced acute liver failure[J]. Cytotherapy, 2014, 16(9): 1207-1219.
[14] 陈棉, 王珏, 耿志敏, 等. 骨髓间充质干细胞条件膜微粒对心脏成纤维细胞的影响[J]. 温州医科大学学报, 2016, 46(9): 625-628.
[15] 陈志文, 杨孝军, 张乾, 等. 骨髓间充质干细胞移植增强大鼠子宫切口再生修复[J]. 温州医科大学学报, 2014, 44(8):561-564.
[16] PAREKKADAN B, VAN POLL D, SUGANUMA K, et al.Mesenchymal stem cell-derived molecules reverse fulminant hepatic failure[J]. PLoS One, 2007, 2(9): e941.
[17] VAN POLL D, PAREKKADAN B, CHO C H, et al. Mesenchymal stem cell-derived molecules directly modulate hepatocellular death and regeneration in vitro and in vivo[J].Hepatology, 2008, 47(5): 1634-1643.
[18] CHRIST B, BRUCKNER S, WINKLER S. The therapeutic promise of mesenchymal stem cells for liver restoration [J].Trends Mol Med, 2015, 21(11): 673-686.
[19] WOO D H, KIM S K, LIM H J, et al. Direct and indirect contribution of human embryonic stem cell-derived hepatocyte-like cells to liver repair in mice[J]. Gastroenterology,2012, 142(3): 602-611.
[20] MORIYA K, YOSHIKAWA M, OUJI Y, et al. Embryonic stem cells reduce liver fibrosis in CCl4-treated mice[J]. Int J Exp Pathol, 2008, 89(6): 401-409.
[21] WANG X, CHEN T, LENG L, et al. MIF produced by bone marrow-derived macrophages contributes to teratoma progression after embryonic stem cell transplantation[J]. Cancer Res, 2012, 72(11): 2867-2878.
[22] SINGLA D K, MCDONALD D E. Factors released from embryonic stem cells inhibit apoptosis of H9c2 cells[J]. Am J Physiol Heart Circ Physiol, 2007, 293(3): H1590-1595.

