心脏手术IABP相关并发症、危险因素及预防措施分析
刘 婷,李晓涛
动脉内球囊反搏(IABP)是一种应用反搏动原理控制动脉内球囊节律性收缩和舒张的机械装置,使球囊在主动脉瓣开放前收缩,在心脏开始舒张时膨胀,提高舒张压和心肌收缩力,减轻收缩时左室后负荷,从而改善大脑、外周组织及器官灌注[1]。近年来,IABP已广泛应用于心脏外科手术的辅助治疗,临床疗效显著,但不可避免的是其相关并发症,如缺血、血小板减少、下肢动脉闭塞等,严重影响患者生存率和术后康复[2]。本研究回顾性分析医院125例应用IABP辅助治疗的心脏手术患者临床资料,旨在探讨IABP辅助治疗的心脏手术患者相关并发症发生情况及其危险因素和预防措施。
1 资料与方法
1.1 病例资料 回顾性分析医院2014年4月~2017年4月125例应用IABP辅助治疗的心脏手术患者临床资料,纳入标准:(1)符合心脏病诊断标准[3];(2)经心电图、心脏彩超等检查确诊为心脏病;(3)年龄 50~75 岁,可耐受心脏外科手术;(4)无手术禁忌证或麻醉禁忌证;(5)同意接受IABP辅助治疗。排除标准:(1)急性心肌梗死合并心源性休克;(2)中、重度主动脉瓣反流;(3)存在主动脉外伤、主动脉夹层等主动脉病变;(4)妊娠期或哺乳期妇女;(5)不接受 IABP辅助治疗;(6)临床资料不全者。125例中,男性87例,女性38例;冠心病93例,瓣膜病32例;术前应用IABP 28例,术中应用IABP 41例,术后于ICU应用IABP 56例。
1.2 IABP相关并发症诊断标准[4](1)穿刺相关并发症:包括假性动脉瘤、下肢动脉闭塞、血肿。(2)缺血:若在置入IABP后,血压下降、肢体动脉搏动消失,拔除IABP导管后好转,即判定为轻度缺血;若置入IABP的肢体苍白、皮肤温度异常、脉搏消失,需作切开减压,则判定为严重缺血。(3)坠积性肺炎:在置人IABP后3 d内,患者确诊为肺炎(以胸片结果为准),拔除IABP导管后好转。(4)IABP相关血小板减少:在置人IABP后3 d内,患者血小板低于100×109/L或减少超过1/4,于拔除IABP导管后恢复正常。(5)IABP失功:由于置入的IABP球囊破裂漏气、充盈不良或导管内血液等问题所致的IABP失功。
1.3 资料收集 收集所有患者年龄、性别、术前心脏射血分数(EF)、术前合并症、IABP相关并发症、体外膜肺氧合(ECMO)使用情况等资料。
1.4 统计学方法 应用SPSS19.0统计软件分析数据,计数数据以[n(%)]表示,采用χ2检验进行单因素分析,应用Logistic回归分析方程进行多因素影响因素分析,P<0.05为差异有统计学意义。
2 结果
2.1 IABP相关并发症发生情况 125例中,36例(28.8%)发生围手术期IABP相关并发症,而术前、术中、术后不同时段的IABP相关并发症发生率比较无显著差异(P>0.05,表1)。
2.2 围手术期IABP相关并发症的单因素分析
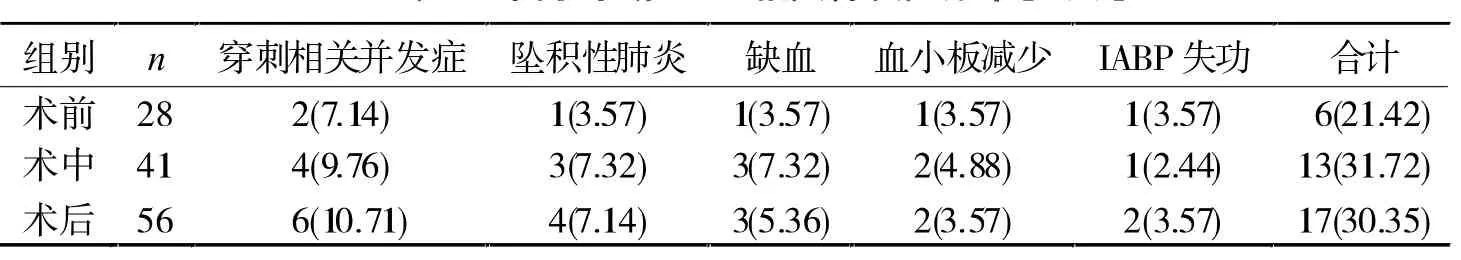
表1 围手术期IABP相关并发症分布[n(%)]
根据患者是否发生IABP相关并发症,将患者分为并发症组和无并发症组,进行影响IABP相关并发症的单因素分析。从表2可见,年龄、合并糖尿病、合并外周血管疾病、IABP持续时间及应用ECMO为影响IABP辅助治疗的心脏手术患者发生IABP相关并发症的危险因素(P<0.05)。
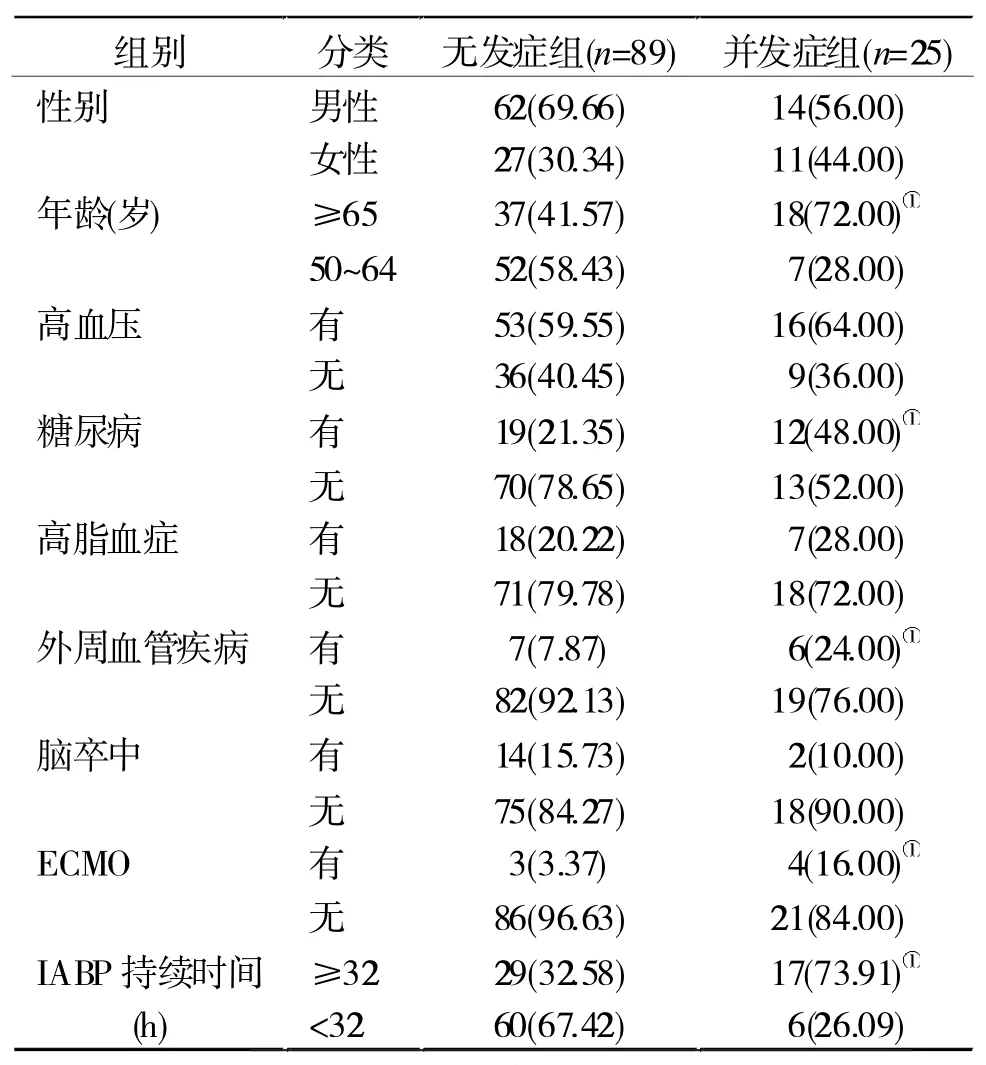
表2 围手术期IABP相关并发症的单因素分析
2.3 围手术期IABP相关并发症的多因素Logistic回归分析 ≥65岁、合并糖尿病、合并外周血管疾病、应用ECMO、IABP持续时间≥32 h为IABP辅助治疗的心脏手术患者发生IABP相关并发症的独立危险因素(P< 0.05,表 3)。

表3 围手术期IABP相关并发症的多因素Logistic回归分析
3 讨论
IABP是目前在心脏外科手术中应用最广泛的辅助治疗方法之一,不仅能改善冠脉血供,维持血压,减少室壁张力和心脏后负荷,还能增加心排血量,减少心肌耗氧量,改善患者血流动力学障碍和心肌缺血的症状[5]。但IABP是一种有创操作,其相关并发症发生率高达50%。虽随着球囊导管技术的进步和经皮穿刺术的应用而有所下降,但危重症心脏病患者在症状发作的48 h内仍有过多的死亡和并发症的发生[6]。本研究结果显示,IABP相关并发症发生率为28.8%,尤其以穿刺相关并发症的发生率较高;多因素Logistic回归分析显示,≥65岁、合并糖尿病、合并外周血管疾病、应用ECMO、IABP持续时间≥32 h为IABP辅助治疗的心脏手术患者发生IABP相关并发症的独立危险因素。
老龄心脏病患者动脉粥样硬化严重,加之动脉较细,穿刺时易出现血肿、下肢动脉闭塞等损伤,故临床中应规范操作,动作轻柔,若发现动脉硬化,应改用更小型号的气囊管[7]。由于患者长时间低血压、低血容量、抗凝不充分、穿刺血管狭窄等,易导致行IABP后肢体缺血。因此,在应用IABP辅助治疗前,应先检查患者股动脉和足背动脉搏动情况,根据患者身高选择合适的球囊管[8]。IABP球囊置入后,其表面会形成大量微血栓;球囊的充气和放气可刺激血小板的活化,使微血栓脱落,消耗血小板,出现IABP相关的血小板减少。所以,在IABP辅助治疗期间,应密切监测患者血小板功能及数量[9]。由于穿管技术、机械损伤等致使球囊破裂,导致IABP失功,应立刻拔除导管,避免脑部气栓的发生,必要时可行动脉切开。
本研究结果显示,年龄≥65岁的心脏手术患者IABP相关并发症发生率明显高于年龄50~64患者,说明年龄是一个重要的危险因素。合并糖尿病者冠脉狭窄常为多支,并伴有周围血管疾病,病情更复杂,IABP辅助治疗往往会提高患者肢体缺血的发生率[10]。有学者认为,IABP辅助持续时间与其并发症发生率有相关性,辅助治疗时间越长,出现下肢缺血的病患越多。本研究也发现,IABP辅助持续时间≥32 h的并发症发生率明显高于持续时间<32 h者,IABP辅助持续时间≥32 h为IABP相关并发症发生的独立危险因素[11]。ECMO是一种可用于体外呼吸支持和心脏支持的改良的人工心肺机,可承担肺功能受损患者气体交换的任务,其血泵可替代心功能严重受损患者的心脏泵血功能,为危重症患者的康复争取宝贵时间。但IABP、ECMO都需行有创的外周血管插管,增加血管并发症发生的风险[12]。为预防IABP相关并发症的发生,辅助治疗前应全面评估患者病情,制订个体化手术和辅助治疗方案,辅助治疗后及时给予抗凝治疗,积极监测各项指标,以便及时对症治疗[13]。
综上所述,肢体缺血、穿刺损伤、血小板减少是心脏手术患者围手术期IABP辅助治疗难以避免的并发症,≥65岁、IABP持续时间≥32 h、合并糖尿病、合并外周血管疾病、应用ECMO是IABP相关并发症发生的独立危险因素,临床中应对高危患者予以严密监测,以减少围手术期并发症的发生。
[1] 经子兰,任丽丽,赵昕,等.主动脉内球囊反搏辅助治疗冠心病合并慢性肾脏疾病的PCI患者临床疗效观察[J].解放军医学杂志,2015,40(4):266-270.
[2] 崔锦钢,吴元,赵冬云,等.主动脉内球囊反搏在急性冠状动脉综合征治疗中的临床应用及并发症情况分析[J].中国循环杂志,2015,30(2):107-110.
[3] 美国纽约心脏病学会标准委员会.心脏与大血管病命名法和诊断标准[M].哈尔滨:黑龙江人民出版社,1981:1-5.
[4] 杜萍,张杰,宋铁鹰,等.心脏手术后IABP相关并发症与危险因素的关系及分析[J].河北医药,2012,34(5):677-678.
[5] 崔锦钢,吴元,赵冬云,等.主动脉内球囊反搏在急性冠状动脉综合征治疗中的临床应用及并发症情况分析[J].中国循环杂志,2015,30(2):107-110.
[6] 陈少敏,王文亮,马贵洲,等.主动脉内球囊反搏联合前列地尔对急诊PCI术后无复流急性心梗患者的疗效评价[J].医学临床研究,2016,33(8):1619-1621.
[7] 周宏艳,张永辉,杜雨,等.心脏外科围手术期用主动脉内球囊反搏辅助的相关并发症及危险因素:附12年单中心数据分析[J].中华危重病急救医学,2017,29(6):506-510.
[8] 杨海平,郝懿,陈林,等.心脏外科围术期主动脉内球囊反搏应用及其并发症的临床分析[J].中国综合临床,2017,33(3):217-220.
[9] 池锐彬,周卉芬,叶铨秋,等.重症加强病房床旁安置主动脉球囊反搏泵的安全性分析[J].临床急诊杂志,2017,18(5):390-392.
[10] 谢波,薛松,徐根兴,等.主动脉内球囊反搏血管源性并发症的临床分析[J].中国循环杂志,2016,31(1):91-91.
[11] 潘宏伟,郑昭芬,张宇,等.急诊IABP循环支持脱机时间对AMI并泵衰竭患者心功能的影响[J].临床误诊误治,2016,29(6):40-43.
[12] 刘海霞.体外膜肺氧合联合主动脉内球囊反搏辅助治疗心脏术后严重低心排综合征[J].中国基层医药,2015,22(14):2132-2134.
[13] 胡绍娟,曲雪芹.联合应用ECMO、IABP、CRRT成功救治危重心脏外科患者的临床护理[J].护士进修杂志,2017,32(18):1687-1688.

