陈年茯砖茶多酚类对老年人肠道菌群的影响研究
吴根梁,侯爱香,李珂,李宗军
湖南农业大学食品科学技术学院,食品科学与生物技术湖南省重点实验室,国家植物功能成分利用工程技术研究中心,湖南 长沙 410128
茯砖茶具有调节肠道功能、促进消化、护肝、降三高及延缓衰老等多种功效[1-3],在一定年份内合理存放,其药理价值及保健功能会不断提升。研究表明,茶多酚是茯砖茶中含量较高的功能性物质之一,其成分在储藏过程中会不断氧化,这其中涉及到多种空间结构及官能团的改变,并最终形成种类繁杂的多酚成分[4-6]。有报道指出,经过10年的陈放,茯砖茶中主要儿茶素总量仍能占茶多酚总量的 20%~40%[7]。尽管人们熟知茶多酚对人体具有多方面的益处,但实际研究发现,茶多酚的生物利用率非常低,茶多酚进入小肠被人体直接吸收利用的只有一小部分,大概 90%以上需经过肠道菌群分解代谢为小分子化合物来提高生物利用率,进而能更好地被人体吸收利用[8-9]。
近年来,学者们基于肠道菌群与膳食营养素互作的研究,将微生物学、营养学及食品科学有机结合来阐明膳食影响人体健康的机理[10-12]。研究表明,肠道菌群与膳食营养素的相互作用是膳食营养素发挥其生物调节作用的重要途径,肠道菌群能通过水解反应、裂解反应、还原转化、官能团转移及基酶介导的转化等酶促反应类型来改变膳食营养素的化学结构,提高膳食营养素的生物活性和生物利用率,方便人体更好地对膳食营养素进行吸收利用,同时膳食营养素数量及结构的改变又能改善肠道微生物的菌相,促进SCFAs的产生,最终对人体健康产生积极的影响,形成双赢的局面[13-16]。因此,我们认为肠道菌群与茯砖茶多酚类互作在维护人体健康方面也具有重要的作用。
目前,我国人口老龄化进程加速,2016年底老年人口已超过2.3亿,如何让老年人健康地安度晚年,催发了大健康产业的蓬勃发展[17]。为此,本试验旨在通过模拟人体肠道微生物体外发酵技术,分析发酵过程中茯砖茶多酚类及 SCFAs的含量变化,并结合高通量测序分析发酵过程中老年人肠道菌群多样性及结构的改变,从而研究老年人肠道菌群与陈年茯砖茶多酚类的体外互作情况,希望能为以后进一步研究陈年茯砖茶对老年人的营养与保健方面的影响提供基础。
1 材料与方法
1.1 材料与试剂
陈放1年及7年的茯砖茶由湖南有关企业提供;没食子酸标准品(GA):上海瑞永生物科技有限公司;6种主要儿茶素单体的标准品:表没食子儿茶素没食子酸酯(EGCG)、表没食子儿茶素(EGC)、表儿茶素没食子酸酯(ECG)、表儿茶素(EC)、儿茶素(DL-C)、没食子儿茶素没食子酸酯(GCG),美国sigma公司;SCFAs标准溶液:乙酸、丙酸及丁酸,美国Sigma公司;试验用水均为超纯水。
1.2 仪器设备
紫外可见分光光度计,北京莱伯泰科仪器有限公司;YQX-II厌氧培养箱,上海跃进医疗器械厂;安捷伦1200型高效液相色谱仪,安捷伦科技有限公司;安捷伦 7890A气相色谱仪,安捷伦科技有限公司; GeneAmp® PCR System 9700系列PCR热循环仪,美国爱普拜斯公司。
1.3 试验方法
1.3.1 茯砖茶多酚的提取纯化
①将茶叶粉碎,按料液比1∶10(g∶mL)加入超纯水,调节pH值至4,在95℃恒温水浴中以120 r·min-1振荡浸提 30 min,接着室温冷却静置1 h,分别浸提2次,并合并2次浸提液;②将浸提液以5 000 r·min-1离心15 min,过滤后于 50℃减压旋转蒸发中浓缩至原来的1/3;③在浓缩液中加入等体积的二氯甲烷,上下振荡3 min,静置分层后收集上层水相,重复3次;④在上层水相中加入等体积的乙酸乙酯,上下振荡 3 min,静置萃取,共萃取 2次,合并2次的上层乙酸乙酯相;⑤30℃减压旋转蒸发回收乙酸乙酯,蒸发至干,得茶多酚固形物,再使用超纯水溶解于平皿内,-80℃冷冻过夜;⑥进行真空冷冻干燥,获得茶多酚冻干粉,备用。
1.3.2 茯砖茶多酚提取物的纯度测定
(1)茶多酚纯度测定
准确称取茶多酚冻干粉 0.1 g,加入超纯水充分溶解,根据GB/T 8313—2008福林酚比色法[18]使用紫外可见分光光度计测定吸光度值。结合没食子酸标准曲线按下式计算茯砖茶多酚纯度:

式中:C为测得的多酚含量,μg·mL-1;V为样品溶液的体积,mL;d为稀释倍数;m为茯砖茶多酚冻干粉的质量,g。
(2)提取物中茶多酚衍生物含量测定
茶黄素、茶红素及茶褐素含量测定根据《茶叶品质理化分析》分光光度法略作改动[19]。
1.3.3 老年人肠道微生物体外静态厌氧培养
参考张鑫等[20]报道的方法,对老年人肠道菌群的体外静态厌氧培养略作改动。收集受试者(2男1女,均为湖南省65岁健康老年人,在采集粪样前 3个月内均未服用过抗生素)的新鲜全便,在厌氧培养箱中进行样品处理(环境温度4℃)。
首先,取3位老年人的粪样等重混匀,并称取混匀粪样10 g,在90 mL无菌PBS缓冲液(pH 7.4)中旋涡振荡 3 min,混匀后用 4层纱布过滤,得到含老年人肠道菌群的 PBS混合液。接着在3个分装有225 mL无菌含氮基础培养基的试剂瓶中各加入PBS混合液25 mL,经漩涡振荡3 min,混匀后获得含老年人肠道菌群的混合培养基,得空白组(B组)。然后根据茯砖茶多酚的纯度差,将2.50 g(纯度83.15%)陈放1年及2.73 g(纯度76.56%)陈放 7年的茯砖茶的茶多酚冻干粉各加入一瓶混合培养基中漩涡振荡3 min,充分混匀后得到含老年人肠道菌群的1年陈茶多酚组(N组)和 7年陈茶多酚组(O组)。最后将 B组、N组和O组以每管5 mL在厌氧条件下各密闭分装45管,放入37℃恒温培养箱中进行静态厌氧培养,在培养 0 h、4 h、8 h、12 h及24 h时,分别取9管发酵液置于-80℃保藏,以备接下来的试验。
1.3.4茯砖茶多酚的含量测定
根据 1.3.2节的试验方法,测定 0.22 μm微孔滤膜过滤后的样品吸光度值。
根据没食子酸标准曲线,可列以下计算公式:
茶多酚含量=C×d
式中:C为测得的多酚含量,μg·mL-1;d为稀释倍数。
1.3.5主要儿茶素单体及GA的含量测定
(1)高效液相色谱检测条件
色谱柱:Calesil-C18液相色谱柱(4.6 mm×250 mm,5 μm)。柱温35℃,检测波长278 nm,进样量 10 mL,流速 1.0 mL·min-1。经 0.22 μm微孔滤膜过滤后,采用梯度洗脱,流动相A:超纯水;流动相 B:VN,N-2甲基甲酰胺∶V甲醇∶V冰醋酸=40∶2∶1.5,洗脱时间及流动相变化情况如表1所示。

表1 高效液相色谱检测洗脱时间及流动相变化情况Table 1 Elution time and mobile phase change of high performance liquid chromatography
(2)含量测定
根据各峰的峰面积利用外标法计算各种成份的含量,公式如下:
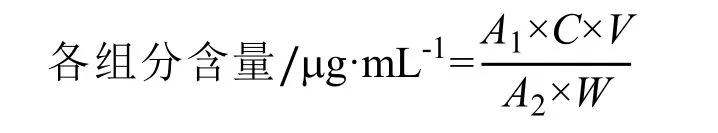
式中:A1为样品的峰面积;A2为标准品的峰面积;C为标准品的浓度;V为样品稀释倍数;W为样品的重量。
1.3.6 SCFAs的含量测定
(1)样品前处理
准确移取各样品 1 mL,12 000 r·min-1离心15 min取上清,按9∶1(V∶V)加入25%偏磷酸静置处理3 h,再经0.22 μm微孔滤膜过滤,待测。
(2)气相色谱检测条件
色谱柱:DB-FFAP气相色谱柱(30 m×250 μm×5 μm)。载气:99.99%高纯氮气,流速0.8 mL·min-1。辅助气:99.99%高纯氢气。FID检测器温度 280℃,进样口温度 250℃,分流比50∶1,进样量1 μ 。程序升温:初始温度60℃,以20℃·min-1的速率升温至220℃,维持 1 min。程序自动测定样品中乙酸、丙酸及丁酸的含量。
1.3.7 Illumina高通量测序试验
(1)样本DNA提取及PCR扩增
将各样本的3组平行样品进行等量混匀,采用DNA提取试剂盒对基因组DNA进行提取,再使用0.8%琼脂糖凝胶电泳检测总DNA的纯度及浓度。
以检测达标的基因组DNA为模板,使用带有Barcode的特异引物对样品的16 S rDNA V4区域进行扩增:
正向引物515F(5'-GTGCCAGCMGCCG CGGTAA-3')
反向引物806R(5'-GGACTACHVGGGT WTCTAAT-3')
每个样品重复3次,且所有的PCR反应终止于线性扩增期,PCR结束后将同一样品的PCR产物进行混合,再用 2%琼脂糖凝胶电泳检测,检测条件为5 V·cm-1,检测时间为20 min。使用OMEGA胶回收试剂盒切胶回收PCR产物,TE缓冲液洗脱回收目标DNA片段。
(2)待测样本的定量
参照电泳检测的初步结果,将 PCR回收产物用Qubit 2.0(ThermoFisher公司)进行定量,之后参照每个样品的测序要求,进行相应比例的混合。
(3)文库构建与测序
使用 Illumina公司的 Truseq DNA PCR-Free Sample Prep Kit试剂盒进行文库的构建,检测合格后使用Illumina公司的Hiseq Rapid SBS Kit v2测序试剂盒进行测序。
1.4 数据分析
茯砖茶多酚及 SCFAs含量变化的数据分析:试验均进行3次独立样品的测定,结果以±s表示,并运用SPSS 24.0软件的单因素分析方法(ANOVA)进行显著性分析。数据图通过Excel 2013软件完成。
Illumina高通量测序试验的数据分析:双端测序得到的PE reads首先运用FLASH[21]进行拼接,同时对序列进行质控,在去除低质量碱基及接头污染的序列后完成数据过滤,获得可供后续分析的高质量目标序列。后续的生物信息学操作运用QIIME[22]、Usearch[23]等完成,统计和作图方法主要参照参考文献[24]。
2 结果与分析
2.1 茯砖茶多酚提取物的成分构成
如表2所示,提取纯化的陈放1年及7年的茯砖茶的茶多酚纯度分别为 83.15%和76.56%,两者纯度相差 6.59百分点,因此本试验中N组和O组茯砖茶多酚每100 mL的添加量分别为1、1.09 g,从而保证两组中多酚总量一致。经过检测发现,茯砖茶多酚提取物中均无茶黄素及茶红素检出,仅检测到茶褐素的微少残留,且在两组中的残留量接近,可以基本排除这几类非多酚类功能性成分对试验的影响。由于茯砖茶多酚类成分种类繁多,本试验选取含量较高的 EGCG、EGC、ECG、EC、DL-C、GCG及GA等成分进行试验,发现在这两个年份的茯砖茶中这几类成分的含量差异较大,可用来阐释陈年茯砖茶多酚类成分的含量差异对老年人肠道菌群的影响,详见表3。

表2 茯砖茶多酚纯度及其衍生物的占比Table 2 The purity of polyphenols and proportion of derivatives in Fu brick teas

表3 茯砖茶多酚类中主要成分的占比Table 3 The main polyphenol components in the Fu Brick teas
2.2 茯砖茶多酚及其主要成分的含量变化
在混合粪样及 B组中检测不到多酚、主要儿茶素单体及GA的含量,可以排除粪样及培养基中可能残留的多酚类成分对试验结果的影响。通过表4可知,在发酵4 h时,N组和 O组的茶多酚含量分别下降 4.14%(P<0.05)、13.03%(P<0.01),而这两组中的主要儿茶素单体及 GA的含量均无较大改变;说明在0~4 h阶段,老年人肠道菌群对儿茶素单体及GA的利用较少,可能利用的主要是茯砖茶在杀青发酵、加工发酵及储藏发酵中由儿茶素类化合物转化而来的多酚成分,而7年陈茯砖茶多酚类中具有更多的转化成分,更易被老年人肠道菌群破坏酚羟基结构,导致茶多酚含量下降更明显。在 4~12 h阶段中,这两组中的茶多酚含量均无显著性变化,但出现EGCG、EGC、ECG及EC含量的显著下降(P<0.05),且N组中这4类儿茶素的降低量分别是O组的1.39倍、5.61倍、1.75倍及2.48倍;说明此阶段中,老年人肠道菌群对茯砖茶多酚类的转化作用没有停滞,只是对酚羟基结构的破坏作用降低,导致茶多酚含量变化不明显。而在12~24 h阶段,N组和O组的茶多酚含量极显著下降16.23%及15.09%(P<0.01),但主要儿茶素单体及 GA的含量均无明显降低(P>0.05);说明此阶段中这两组的老年人肠道菌群主要利用的多酚成分不是主要儿茶素单体及GA。
2.3 SCFAs的含量变化
乙酸、丙酸及丁酸是人体肠道菌群的发酵产物,约占肠道内SCFAs总量的80%以上,它们不仅可以作为肠道粘膜细胞的主要能量来源,还可以通过减少促炎症因子的产生来降低肠道炎症的发生[25]。如表5所示,N组及O组在发酵过程中,乙酸、丙酸及丁酸的含量均随着培养时间的延长而逐渐增加。在培养24 h后,N组中的乙酸、丙酸及丁酸的含量分别是B组的1.60倍、1.17倍和2.66倍;而O组中的乙酸、丙酸及丁酸的含量分别是B组的2.16倍、1.26倍和 3.46倍。以上数据表明,茯砖茶多酚类能有效促进发酵过程中乙酸、丙酸及丁酸的产生,其中以7年陈茯砖茶的茶多酚类作用效果更加显著。
2.4 Alpha多样性分析
在 97%的相似性水平上使用 UPARSE算法[26]进行 OTU(Operational Taxonomic Units)的聚类分析,并对样品间的OTU代表性序列进行计数,其OTU数可以代表样品中物种的丰度。Alpha多样性能反应出每个样品中菌群的丰度和多样性水平,其中Chao1指数和ACE指数均用来估计菌群中含有的OTU数目,指数值越高表示菌群中物种的丰度也越高;Shannon指数(香农-维纳指数)和 Simpson指数(辛普森指数)均用来估算样品中菌群的多样性,其指数值越大表明菌群多样性越高。
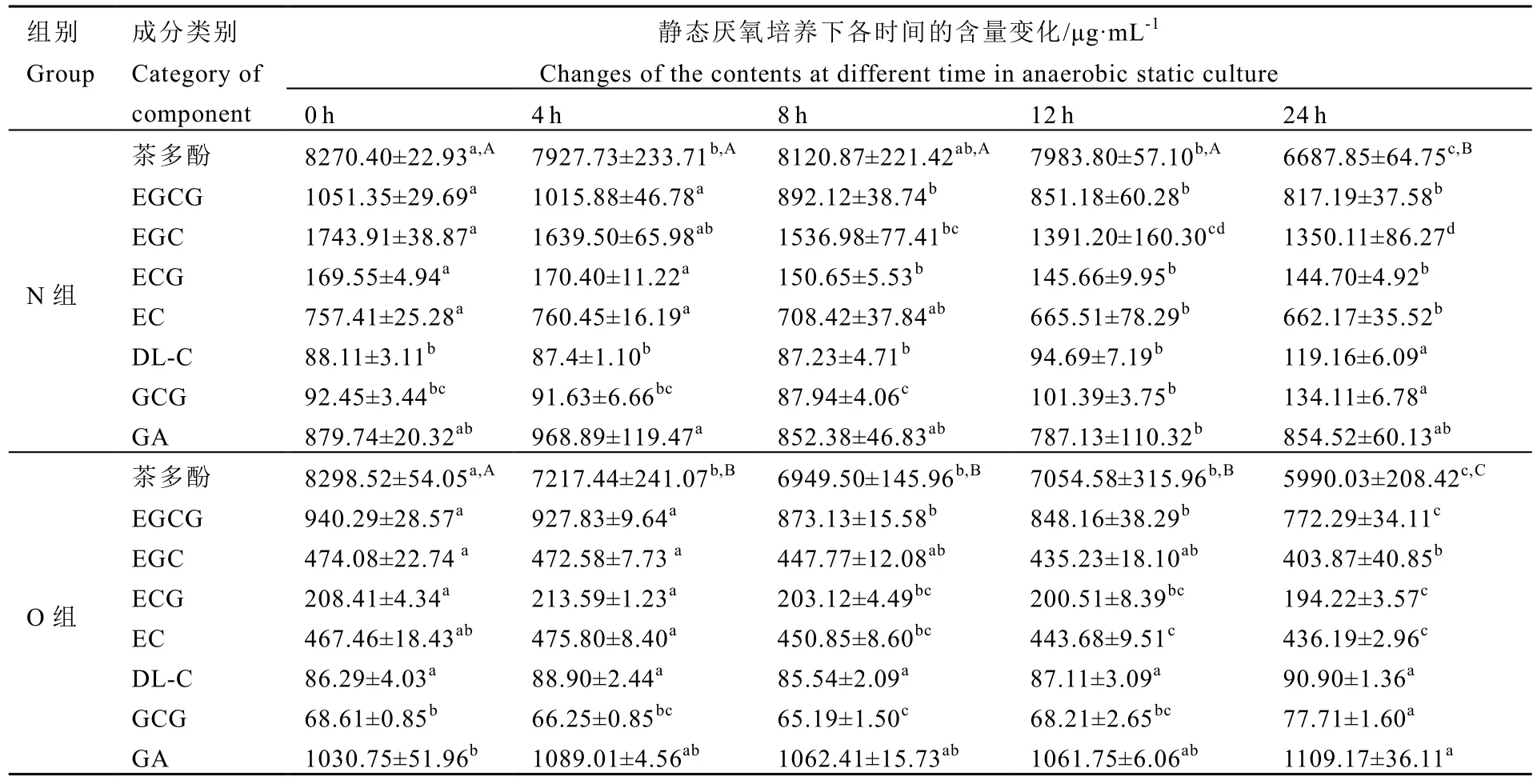
表4 茯砖茶多酚及其主要成分的含量变化Table 4 Changes of the main polyphenol contents in Fu brick teas

表5 SCFAs的含量变化Table 5 Changes of the SCFA contents
由表6可知,在4 h时,相比初始阶段,各组的菌群丰度和多样性水平有所下降,但是添加茯砖茶多酚类的组分对肠道菌群丰度和多样性的稳定作用较B组的强,其中O组比N组更突出。在8 h时,各组的菌群丰度和多样性水平开始上升,整体上O组>N组>B组。在 12 h及 24 h时,则呈现出 O组>B组>N组,这可能与 N组在4~12 h阶段中EGCG、EGC、ECG及EC的含量降低较多有关,这4种儿茶素类化合物对部分肠道有害菌群呈现出抑菌作用,从而稍微降低了N组的菌群丰度和多样性水平,这与许奇等[27]研究结果相同。

表6 样品Alpha多样性指数Table 6 Alpha-diversity values of samples
2.5 老年人肠道菌群的结构变化
2.5.1 门水平上老年人肠道菌群的结构变化
使用 Uclust分类法对 97%相似程度的OTU代表序列进行分类学分析,挑选出OTU的代表性序列使用 Uchime[28]去除嵌合体,通过Silva数据库[29]进行物种分类信息的划分,同时剔除注释为叶绿体、线粒体及非细菌或古菌界的OTU,统计各样本的群落组成。通过图1发现老年人肠道菌群所含细菌分属19个门,在这3组的各个厌氧培养阶段中相对丰度超过1%的优势菌门有:变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)及放线菌门(Actinobacteria),这4个门的菌群总和均在各样品中占99%以上。在各个培养阶段,各组的老年人肠道菌群在门水平上的变化均呈现出波动性变化的特征,其中 N组和 O组在这4个优势菌门的相对丰度变化趋势上较为接近,与B组的变化相左。以下统计相同时间段下各组中相同菌门的相对丰度变化在 5%以上的情况:在12 h时变形菌门的相对丰度大小为B组>N组>O组,而在24 h时则出现N组和O组大于B组的情况;拟杆菌门在4 h及12 h时的相对丰度大小为O组>N组>B组,在24 h时则为B组>N组>O组;厚壁菌门在4 h时的相对丰度大小为B组>N组>O组,而在24 h时B组>O组>N组;放线菌门丰度差异5%以上的阶段仅出现在12 h时,相对丰度大小为B组>N组>O组。
2.5.2 属水平上老年人肠道菌群的结构变化
根据物种注释结果,在属水平上得到256个不同的 OTU,再通过所有样品在属水平上的物种注释及丰度信息,挑选丰度排名在前50的属,根据其在所有样品中的丰度信息,从物种和样品两个层面进行聚类,绘制成Heatmap图,如图2。在Heatmap图上,通过Z-Score(Z值)来绘制颜色变化梯度,根据各样品间的相似程度来反应数据的相似性和差异性。图形上方的树形图是样品聚类关系树,它表示对不同样品的聚类分析结果,根据样品与样品间的差异,处于同一分支内的样品序列进化关系相近。图形左侧的树状图是物种丰度相似树,它表示对来自不同样品的不同物种的聚类分析结果,丰度最相近的物种会被分配到同一分支上。

图1 门水平上老年人肠道菌群变化Fig. 1 Changes in the intestinal flora of the elderly at the phylum level
为了方便了解这 3组在各时间段下的菌群相对丰度变化,选取相对丰度排名前8的属列表(表7)。发现埃希氏菌属(Escherichia)、拟杆菌属(Bacteroides)、双歧杆菌属(Bifidobacterium)、普雷沃菌9属(Prevotella 9)、普拉梭菌属(Faecalibacterium)、γ-变形菌纲_B38(γ-proteobacteria_B38)、罕见小球菌属(Subdoligranulum)及毛螺旋菌科(Lachnospiraceae)的相对丰度总和在各组中均占 70%~80%。其中,在 4 h及12 h时,埃希氏菌属及γ-变形菌纲_B38的相对丰度大小为B组>N组>O组,而拟杆菌属、双歧杆菌属及普拉梭菌属的相对丰度大小为 O组>N组>B组。在8 h时,上述8种肠道菌属在这3组中变化不明显,说明此时在 N组和O组中,陈年茯砖茶多酚类成分对老人肠道菌群的调节作用降低,难以影响菌群变化。在24 h时,相比B组,N组和O组中埃希氏菌属、双歧杆菌属及γ-变形杆菌属的相对丰度升高,而拟杆菌属及普拉梭菌属则降低。在各个时间段下,普雷沃菌9属、罕见小球菌属及毛螺旋菌科在各组中的相对丰度差异不明显,可以认为陈年茯砖茶多酚类对老年人肠道菌群的影响主要集中在埃希氏菌属、拟杆菌属、双歧杆菌属、普拉梭菌属及γ-变形菌纲_B38上。
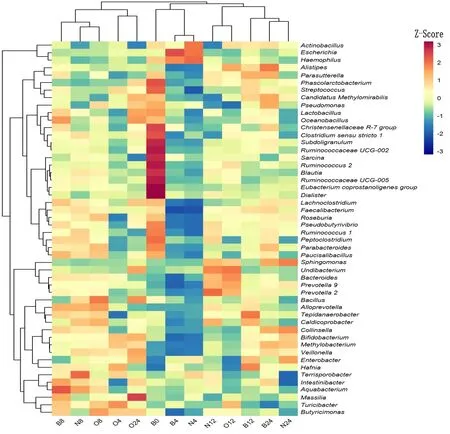
图2 属水平上老年人肠道菌群变化(Heatmap图)Fig. 2 Changes in intestinal microflora of elderly people at the gunus level(Heatmap)
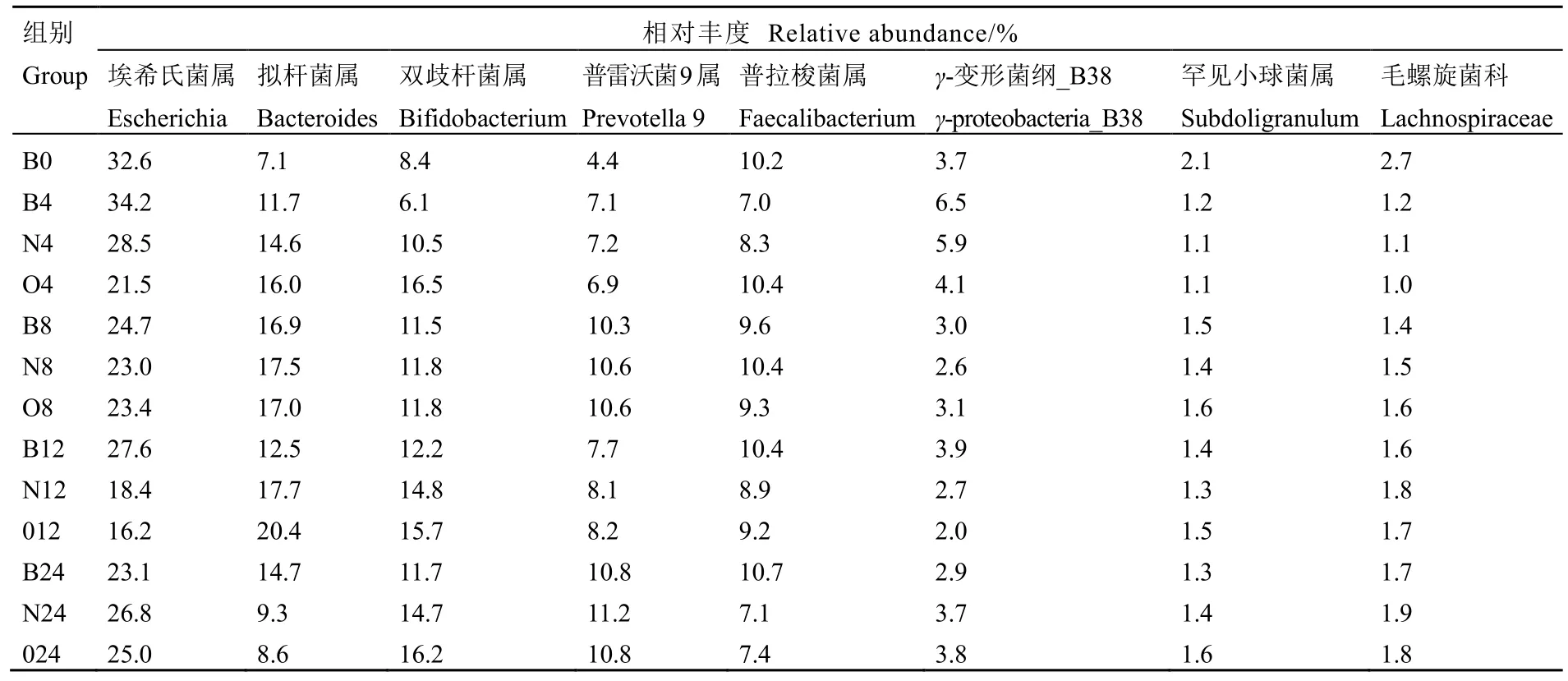
表7 属水平上老年人肠道菌群的相对丰度变化Table 7 Relative abundance changes in the intestinal flora of the elderly at the genus level
3 讨论
茯砖茶是后发酵茶,在陈放过程中仍进行着微生物代谢及内含物转化,其营养成分在组成及含量上均不断发生着改变,而这些改变能显著改善茶汤风味及提升医疗保健疗效。黄亚辉等[30]研究发现,茯砖茶陈放时间越久,其水浸出物、茶多酚、茶红素、氨基酸及果胶的含量会逐渐减少,而水溶性糖和茶褐素的含量会不断增加,这些生化变化在一定陈放年限内会使茶汤滋味由醇浓转为醇和,汤色由橙色逐渐转为红色。在医疗保健方面,陈年茯砖茶在民间经常被作为调理肠胃、治疗肠炎的“特效药”,萧力争等[31]研究了不同年份生产的茯砖茶对小鼠小肠推进运动的影响,发现陈放年份较长的茯砖茶对腹泻的治疗效果较新茶好,而行使治疗效果的功能性成分可能是陈年茯砖茶的茶多酚。
人体内的微生物主要寄居于结肠内,其数量可以达到人类细胞数量的10倍以上,它们能编码超过330万个基因,约为人体自身基因的150倍,其中包含糖苷降解、脂肪酸代谢、多酚类降解及修饰等相关基因[32]。而近年来,随着人们对肠道菌群的研究不断深入,发现肠道菌群与人体健康密切相关,膳食营养素能通过与肠道菌群互作来调节肠道微生物的生长变化,对癌症、炎症、心脑血管疾病、自身免疫性疾病、肥胖、营养不良、糖尿病、慢性肾病、艾滋病、肝病及神经障碍性疾病的预防和治疗有着密不可分的作用[33-34]。相关报道指出,茶多酚能被肠道菌群的多种代谢途径改变结构,并通过这些结构不同的产物被肠道吸收来累积发挥生物效应,另一方面多酚成分及其代谢产物能通过抑制肠道有害菌群及促进肠道有益菌群的增殖来改善肠道内环境[35]。肠道内环境的改善能促进肠道有益菌群产生更多的SCFAs,而SCFAs的增加,又能降低肠道内的 pH值,从而减少肠道有害菌的生长,进一步改善肠道健康[36]。
到目前为止,利用现代分子技术研究膳食多酚中的复杂成分与肠道菌群相互作用的案例较少,大多数研究仅局限在单一多酚成分或少数几种菌株上[37]。Zhang等[38]利用乌龙茶的EGCG、GCG及EGCG3''ME(EGCG甲基化衍生物)进行相关研究,结果表明不同的茶多酚成分及含量在肠道菌群的调节和促进SCFAs的含量增加等方面存在着一定的差异。因此,本试验将模拟人体肠道微生物体外发酵技术应用到老年人肠道菌群与陈年茯砖茶的茶多酚类的体外互作中,通过探究陈年茯砖茶的茶多酚对老年人肠道菌群的调节作用,来初步阐释陈年茯砖茶的茶多酚影响老年人身体健康的潜在作用。
本试验研究发现,在各时间段中O组比N组及B组显著提高乙酸、丙酸及丁酸的含量,同时提升老年人肠道菌群的丰度及多样性水平。在4 h及 12 h时,O组能明显降低埃希氏菌属及γ-变形菌纲_B38的相对丰度,同时提高拟杆菌属、双歧杆菌属及普拉梭菌属的相对丰度,其中,埃希氏菌属有 5种菌种,以大肠杆菌在人体肠道中最为常见,一般不致病,但部分菌株具有致病性强的特点,容易引起腹泻[39]。γ-变形菌纲中有很多常见的致病菌属,比如沙门氏菌属及耶尔辛氏菌属,且大肠杆菌也属于这个纲。近来,拟杆菌属中的代表菌株脆弱拟杆菌逐渐被学者们认定为继双歧杆菌及乳杆菌之后有益的菌种之一,在肠道中可能比大肠杆菌的含量高,它可以释放消炎物质,在预防或治疗炎症性肠病中具有优异的作用[40]。双歧杆菌属对人体功能具有调节作用,在老年人肠道菌群中的数量较年轻人少,学者们认为过少的双歧杆菌是引起衰老的原因之一[41],它的主要发酵产物是乙酸和丁酸。普拉梭菌属在肠炎患者的肠道中显著减少,研究表明它能通过产丁酸、上调TJ蛋白改善肠道通透性及对致病菌的抑制作用来预防及治疗肠道炎症[42]。因此,通过以上研究可以认为在一定年限内,随着陈放年份的增加,陈年茯砖茶的茶多酚类对老年人肠道菌群的改善作用会逐渐提升,这值得继续深入研究。
[1] Liu B, Yang T, Zeng L, et al. Crude extract of Fuzhuan brick tea ameliorates DSS-induced colitis in mice [J].International Journal of Food Science & Technology, 2016,51(12): 2574-2582.
[2] Foster M T, Gentile C L, Cox-York K, et al. Fuzhuan tea consumption imparts hepatoprotective effects and alters intestinal microbiota in high saturated fat diet-fed rats [J].Molecular Nutrition & Food Research, 2016, 60(5):1213-1220.
[3] Li Q, Liu Z, Huang J, et al. Anti-obesity and hypolipidemic effects of Fuzhuan brick tea water extract in high-fat diet-induced obese rats [J]. Journal of the Science of Food &Agriculture, 2013, 93(6): 1310-1316.
[4] Lin Y, Liu Z H, Lin H Y, et al. Study on influence of Fuzhuan brick tea aqueous extract on lipid metabolism in hyperlipidemia mice and its antioxidation [J]. Journal of Food Safety & Quality, 2015(5): 1561-1566.
[5] Yun-Fei Z, Jing-Jing C, Xiao-Ming J, et al. Changes of major tea polyphenols and production of four new B-ring fission metabolites of catechins from post-fermented Jing-Wei Fu brick tea [J]. Food Chemistry, 2015, 170:110-117.
[6] Jie X, Hu F L, Wei W, et al. Investigation on biochemical compositional changes during the microbial fermentation process of Fu brick tea by LC–MS based metabolomics [J].Food Chemistry, 2015, 186: 176-184.
[7] Zheng W J, Wan X C, Bao G H. Brick dark tea: a review of the manufacture, chemical constituents and bioconversion of the major chemical components during fermentation [J].Phytochemistry Reviews, 2015, 14(3): 499-523. DOI 10.1007/s11101-015-9402-8.
[8] Dueñ as M, Muñ oz-Gonzá lez I, Cueva C, et al. A survey of modulation of gut microbiota by dietary polyphenols [J].Biomed Research International, 2015, 2015: 850902.
[9] Espí n J C, Gonzá lez-Sarrí as A, Tomá s-Barberá n F A. The gut microbiota: a key factor in the therapeutic effects of(poly)phenols [J]. Biochemical Pharmacology, 2017, 139:82-93.
[10] Shanahan F, Van S D, O'Toole P W, et al. Feeding the microbiota: transducer of nutrient signals for the host [J].Gut, 2017, 66(9): 1709-1717.
[11] Singh R K, Chang H W, Yan D, et al. Influence of diet on the gut microbiome and implications for human health [J].Journal of Translational Medicine, 2017, 15(1): 73.doi.org/10.1186/s12967-017-1175-y.
[12] Barratt M J, Lebrilla C, Shapiro H Y, et al. The gut microbiota, food science, and human nutrition: a timely marriage [J]. Cell Host Microbe, 2017, 22(2): 134-141.
[13] Mckenzie C, Tan J, Macia L, et al. The nutrition-gut microbiome-physiology axis and allergic diseases [J].Immunological Reviews, 2017, 278(1): 277.
[14] Koppel N, Maini R V, Balskus E P, et al. Chemical transformation of xenobiotics by the human gut microbiota[J]. Science, 2017, 356(6344): eaag2770. DOI:10.1126/science.aag2770.
[15] Leulier F, Macneil L T, Lee W J, et al. Integrative Physiology: At the Crossroads of Nutrition, Microbiota,Animal Physiology, and Human Health [J]. Cell Metabolism,2017, 25(3): 522.
[16] Foster K R, Schluter J, Coyte K Z, et al. The evolution of the host microbiome as an ecosystem on a leash [J]. Nature,2017, 548: 43-51.
[17] 闻玉梅. “医老”可显著缓解老龄化的压力与负担[J]. 科技导报, 2017, 35(18): 1.
[18] 中华人民共和国国家监督检验检疫局, GB/T 8313—2008茶叶中茶多酚和儿茶素类含量的检测方法[S]. 北京: 中国标准出版社, 2008: 3-5.
[19] 钟萝. 茶叶品质理化分析[M]. 上海: 上海科学技术出版社, 1989.
[20] 张鑫, 马丽苹, 张芸, 等. 茶叶儿茶素对肠道微生态的调节作用[J]. 食品科学, 2013, 34(5): 232-237.
[21] Magoč T, Salzberg S . F ASH: fast length adjust ent of short reads to improve genome assemblies [J].Bioinformatics, 2011, 27(21): 2957.
[22] Magoč T, Salzberg S L. FLASH: fast length adjustment of short reads to improve genome assemblies [J].Bioinformatics, 2011, 27(21): 2957-5963.
[23] Schloss P D, Westcott S L, Ryabin T, et al. Introducing mothur: open-source, platform-independent, communitysupported software for describing and comparing microbial communities [J]. Applied & Environmental Microbiology,2009, 75(23): 7537-7541.
[24] Team C R, Team RDC. R: a language and environment for statistical computing. r foundation for statistical computing:Vienna, Austria [J]. Computing, 2016, 1: 12-21.
[25] 刘松珍, 张雁, 张名位, 等. 肠道短链脂肪酸产生机制及生理功能的研究进展[J]. 广东农业科学, 2013, 40(11):99-103.
[26] Edgar R C. UPARSE: highly accurate OTU sequences from microbial amplicon reads [J]. Nature Methods, 2013, 10(10):996.
[27] 许奇, 王丽, 余碧丽, 等. 茶多酚影响肠道菌群活的非可培养状态(VBNC)状态转变的研究[J]. 食品与发酵工业,2014, 40(8): 12-17.
[28] Edgar R C, Haas B J, Clemente J C, et al. UCHIME improves sensitivity and speed of chimera detection [J].Bioinformatics, 2011, 27(16): 2194.
[29] Quast C, Pruesse E, Yilmaz P, et al. The SILVA ribosomal RNA gene database project: improved data processing and web-based tools [J]. Nucleic Acids Research, 2013,41(Database issue): 590-596.
[30] 黄亚辉, 陈建华, 周筠, 等. 不同年代茯砖茶感官品质和化学成分的差异性[J]. 食品科学, 2010, 31(2): 228-232.
[31] 萧力争, 余智勇, 黄建安, 等. 茯砖茶对小鼠小肠推进运动的影响[J]. 茶叶科学, 2010, 30(s1): 579-582.
[32] 杨阳, 张鑫, 翁佩芳, 等. 茶叶儿茶素的益生元活性研究[J]. 现代食品科技, 2015(4): 128-136.
[33] Lamas B, Richard M L, Leducq V, et al. CARD9 impacts colitis by altering gut microbiota metabolism of tryptophan into aryl hydrocarbon receptor ligands [J]. Nature Medicine,2016, 22 (6): 598-605.
[34] 郭慧玲, 邵玉宇, 孟和毕力格, 等. 肠道菌群与疾病关系的研究进展[J]. 微生物学通报, 2015, 42(2): 400-410.
[35] Cheng M, Zhang X, Guo X, et al. The interaction effect and mechanism between tea polyphenols and intestinal microbiota: Role in human health [J]. Journal of Food Biochemistry, 2017: e12415. doi.org/10.1111/jfbc.12415.
[36] Sá nchez-Patá n F, Barroso E, Van d W T, et al. Comparativein vitrofermentations of cranberry and grape seed polyphenols with colonic microbiota [J]. Food Chemistry,2015, 183: 273-282.
[37] Kemperman R A, Gross G, Mondot S, et al. Impact of polyphenols from black tea and red wine/grape juice on a gut model microbiome [J]. Food Research International, 2013,53(2): 659-669.
[38] Zhang X, Zhu X, Sun Y, et al. Fermentationin vitroof EGCG, GCG and EGCG3"Me isolated from Oolong tea by human intestinal microbiota [J]. Food Research International,2013, 54(2): 1589-1595.
[39] Mihai Cirstea, Nina Radisavljevic, B Brett Finlay. Good bug,bad bug: breaking through microbial stereotypes [J]. Cell Host & Microbe, 2018, 23: 10-13.
[40] 智发朝, 白杨, 王晔, 等. 一种脆弱拟杆菌在预防和/或治疗炎症性肠病中的应用, CN105434476A[P]. 2016-03-30.
[41] 王舒悦, 于晓红, 李鸣, 等. 双歧杆菌对中老年人健康影响的菌种特异性初探[J]. 四川大学学报(医学版), 2017,48(5): 745-749.
[42] 徐豪明, 周有连, 聂玉强. 普拉梭菌与炎症性肠病的关系及机制研究[J]. 广东医学, 2017, 38(2): 318-321.

