茶树叶片氟亚细胞分布及其与细胞壁结合特性的研究
刘思怡,朱晓静,房峰祥,张豪杰,邱安东,陈玉琼
华中农业大学园艺林学学院/园艺植物生物学教育部重点实验室,湖北 武汉, 430070
氟是人和动物必需的微量元素,适量的氟摄入可以促进哺乳动物骨骼中的磷酸钙转化为磷灰石,有利于防止龋齿和骨质变形症等[1-2],但是过量摄入氟会造成软组织硬化,干扰人体钙代谢和骨组织中胶原蛋白合成等[1-4]。茶树(Camellia sinensis)是富集氟能力较强的几种植物之一,叶片是茶树富集氟的主要器官,饮茶成为人们摄入氟的渠道之一,因此,茶氟安全也备受人们的关注。茶叶中氟含量受品种、栽培环境、叶片成熟度等多种因素的影响[5-6]。自然生长状态下,茶树叶片富集氟的量从几十至 1 000 mg·kg-1以上而未表现出中毒症状,是生长于同一地点其他植物的10~100倍[7-8],表明茶树对氟有极强的调节能力。已有研究表明,植物超富集某种元素的能力与其对超富集元素在细胞和亚细胞水平上的区隔化密切相关[9]。李刚等[10]研究发现,小麦根系上的 77% Al吸附于细胞壁上。FeiBo研究表明,大麦中Cd主要分布在根或枝梢细胞壁及可溶性组分里[11]。李春雷、蔡荟梅等研究发现,水培条件下的茶树幼苗在氟胁迫下,茶树叶片氟含量随培养液氟浓度增加而增加,其中细胞壁和可溶性部分是叶片氟主要的存储部位[12-13]。而在自然生长条件下,茶树叶片氟的富集部位及其亚细胞分布是否具有同样规律?细胞壁作为结合氟的重要部位,其结合氟的可能机理是什么?对此,本文分析了同一生长条件下3个具有不同聚氟能力的茶树品种氟的亚细胞分布及氟与细胞壁的结合特点,以期为明确茶树富氟的机理,为健康饮茶及茶树低氟品种的选育提供理论基础。
1 材料与方法
1.1 试验材料
茶叶原料:鲜叶采自华中农业大学茶园的乌牛早(WNZ)、福鼎大白(FD)、福云 6号(FY No.6)品种的成熟叶片,采回的鲜叶经蒸馏水洗净后晾干,–80℃保存备用。
试验所用Trisbase(三羟甲基氨基甲烷)、果胶酶(CalBio M0002)、纤维素酶均购置于Biosharp公司;DTE(二硫赤鲜醇)购置于北京索莱宝科技有限公司;CDTA(反式-1,2-环己二胺四乙酸)购置于成都市科龙化工试剂厂;高氯酸,过氧化氢,咪唑,盐酸羟胺,蔗糖等其他化学试剂均为分析纯(国药集团化学试剂有限公司)。
1.2 试验方法
1.2.1亚细胞组分分离
亚细胞组分采用差速离心法[11]。称取一定量新鲜叶片,加入预冷过的缓冲液(50 mmol·L-1Tris-HCl,250 mmol·L-1蔗 糖 , 1.0 mmol·L-1DTE , 5.0 mmol·L-1抗 坏 血 酸(pH7.5),料液比 1︰40(g·mL-1),研磨匀浆。匀浆过100 μm尼龙网,滤渣用缓冲液淋洗2次,滤渣为细胞壁组分(F1)。上清液在4 500 r·min-1下离心 15 min,沉淀为细胞核和叶绿体组分(F2)。收集离心后的上清液在15 000 r·min-1下离心 35 min,沉淀为线粒体组分(F3),上清液为含核糖体的可溶性组分(F4),所有操作均在4℃下进行,冷冻干燥得所需样品。
1.2.2 细胞壁组分分离
参照文献[14]的方法。取 1.2.1中所得细胞壁组分,用预冷磷酸缓冲(pH7.0)淋洗残渣(料液比1︰100,g·mL-1),除去水溶性物质。然后用–20℃预冷丙酮(1︰50,g·mL-1)淋洗除去脂溶性物质,再用少量缓冲液淋洗,抽干,最后用 LiCl(3 mol·L-1,柠檬酸-磷酸缓冲液配制,pH5.5,)4℃下浸泡24 h(料液比 1︰10,g·mL-1),除去蛋白质,抽干,残余物冷冻干燥。
取适量上述样品于离心管,按料液比1︰40(g·mL-1)加入 0.5 mol·L-1咪唑溶液(pH 7.0),在 25℃下振荡提取 24 h,5 000 r·min-1离心20 min,沉淀物用咪唑溶液洗涤2~3次,合并上清液,冷冻干燥得螯合态果胶(CW-P1);沉淀物加入 50 mmol·L-1Na2CO3(内含 20 mmol·L-1CDTA),按上述同样条件,离心后的上清液冷冻干燥即为碱溶性果胶(CW-P2);沉淀物用4 mol·L-1KOH按同样条件提取,离心后的上清液用 4 mol·L-1HCl中和至 pH5.0,冷冻干燥即为半纤维素(CW-HC);残渣冷冻干燥即为纤维素(CW-C)。
1.2.3 细胞壁化学改性
参照文献[15]的方法。将茶树鲜叶按 1︰10(g·mL-1)加入-20℃预冷 75%乙醇溶液匀浆,5 000 r·min-1离心,沉淀用预冷75%乙醇溶液浸提 2次,每次于 4℃下 5 000 r·min-1离心 10 min。沉淀物依次用预冷的丙酮、甲醇-三氯甲烷混合液(l︰l,V/V)和甲醇溶液进行洗涤,沉淀物冷冻干燥即为细胞壁,液氮磨碎,于4℃保存备用。
细胞壁甲基化改性:称取2 g细胞壁于锥形瓶中,加入80 mL甲酸和40 mL甲醛,置于25℃恒温摇床振荡反应6 h,振荡转速125 r·min-1。反应结束后离心分离,沉淀物用去离子水冲洗3次,得到经甲基化改性处理后的细胞壁,冷冻干燥后,4℃保存备用。对照组用相应量的纯水代替甲酸、甲醛,其余处理同改性组。
细胞壁酯化改性:称取2 g细胞壁于锥形瓶中,先加入140 mL无水甲醇,再加入1.2 mL浓 HCl。悬浮液在 125 r·min-1下振荡 12 h,离心后沉淀物用去离子水洗涤3次,冷冻干燥后4℃保存备用。对照组用相应量的纯水代替甲醇和浓盐酸,其余步骤同处理组。
1.2.4 果胶酶、纤维素酶酶解
果胶酶酶解:取2 g细胞壁于锥形瓶中,加入120 mL l%果胶酶及0.1% BSA(柠檬酸-柠檬酸钠缓冲液配制,pH3.5)。混合均匀后在50℃水浴中酶解2 h,离心分离沉淀,去离子水洗涤3次,冷冻干燥后4℃保存备用。对照组用相应量失活的果胶酶和BSA处理。
纤维素酶酶解:取 2 g细胞壁于锥形瓶中,加入120 mL l%纤维素酶及0.1% BSA(柠檬酸-柠檬酸钠缓冲液配制,pH 5.0)。混合均匀后在 50℃水浴中酶解 2 h,离心分离沉淀,去离子水洗涤3次,冷冻干燥后4℃保存备用。对照组用相应量失活的纤维素酶和BSA处理。
1.2.5 氟的测定
氟含量测定:采用碱熔灰化-氟电极测定,参照文献[16]。
不同组分氟所占细胞壁总氟的百分含量换算方法:(不同组分氟含量×该组分的质量)/细胞壁总氟量。
1.2.6 金属离子含量
准确称取样品0.1 g于锥形瓶中,加10 mL混合酸(V硝酸︰V高氯酸=4︰1),置于电热板上慢慢升温加热至 140~180℃,使黄棕色烟(NO2)慢慢挥发,再适当提高温度继续消化,消化至消化液呈无色透明,冷却至室温后将消化液过滤,转移至 25 mL容量瓶,超纯水定容。火焰-原子吸收分光光度计测定金属离子含量。
1.3 数据处理
数据表示为3次重复的平均值±标准差。采用 SPSS(17.0)软件进行数据分析处理,最小显著差数法(LSD法)进行多重比较分析。以百分数为单位的数据先做平方根反正弦转换后再进行方差分析。
2 结果与分析
2.1 茶树叶片氟的亚细胞分布
从图1~2可以看出,茶树叶片亚细胞组分中氟含量存在显著差异(P<0.05),3个品种的细胞壁组分氟含量都最高,乌牛早、福云6号和福鼎大白细胞壁氟含量分别为2 676.94、2 225.42、1 854.79 mg·kg-1,占叶片总氟的39.74%、50.63%和 56.42%。其次是细胞核和叶绿体组分,含量分别为1 037.51、756.54、750.80 mg·kg-1,占叶片总氟的 15.59%、14.68%和 21.54%。可溶性组分氟含量最低,分别为320.74、244.89、288.41 mg·kg-1,但由于该组分在细胞中的总量较高,因此,其所含的氟总量占叶片总氟的31.35%、28.35%和37.32%,仅次于细胞壁组分。线粒体组分中氟含量分别为 686.93、457.63、395.82 mg·kg-1,所含氟总量仅为叶片氟总量的0.55%,1.39%和2.43%,氟分布量最少。
2.2 氟在细胞壁各组分中的分布
细胞壁中累积了大量氟,进一步分离褔云6号细胞壁组分,分析叶片细胞壁组分氟含量分布。结果表明,细胞壁各组分对氟的富集能力差异显著(图3~4)。螯合态果胶组分氟含量最高,为 1 400.14 mg·kg-1,占细胞壁总氟的 38.58%;其次为碱溶性果胶,氟含量为1091.47 mg·kg-1,但由于该组分在细胞壁中的总量较少,因此其所含的氟仅占细胞壁总氟的16.86%;半纤维素氟含量为 241.91 mg·kg-1,占细胞壁总氟的36.60%;纤维素氟含量最低,为 167.68 mg·kg-1,显著低于其他组分中氟含量(P<0.05),占细胞壁总氟的7.96%。
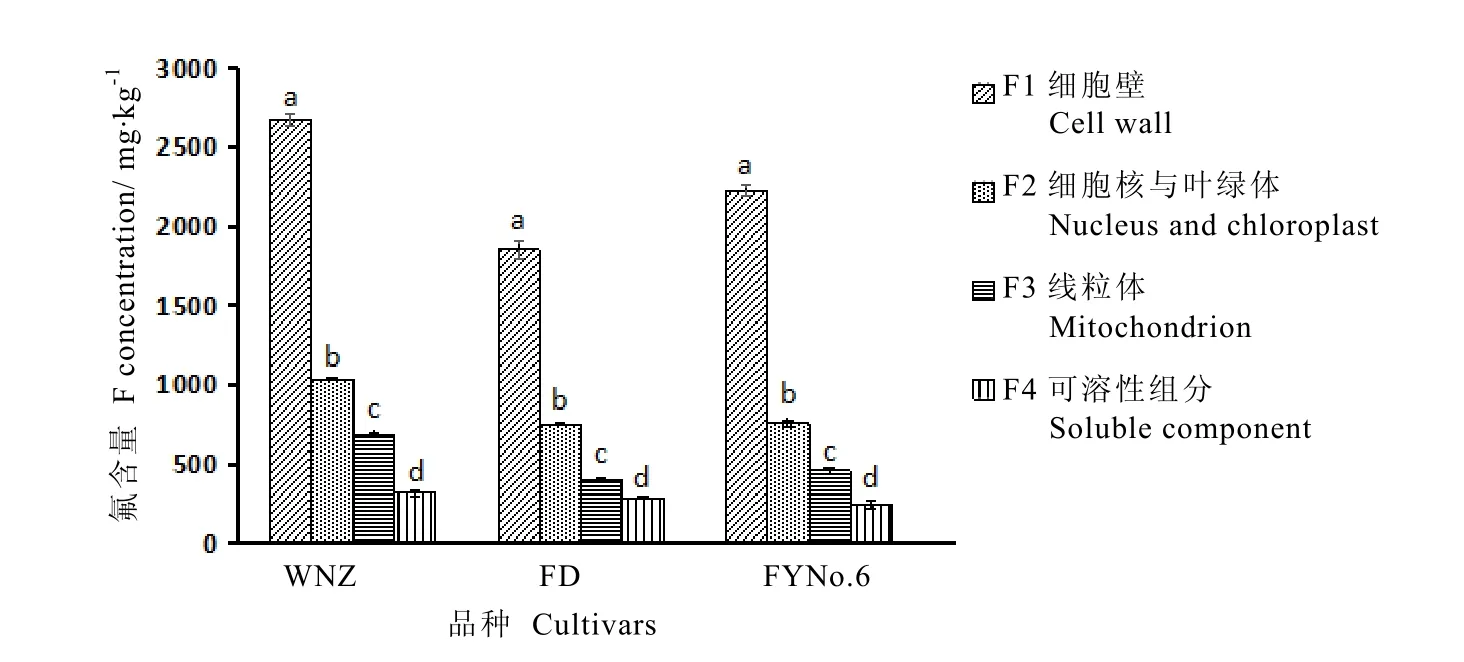
图1 氟在茶树叶片中的亚细胞分布Fig. 1 Subcellular distribution of F in tea leaves
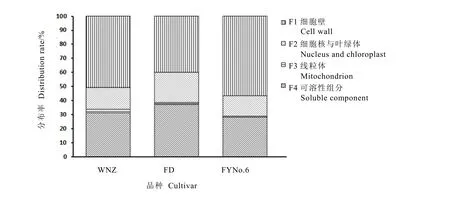
图2 茶树叶片中氟亚细胞分布的相对比例Fig. 2 Relative F percentages in subcellular fractions of tea leaves
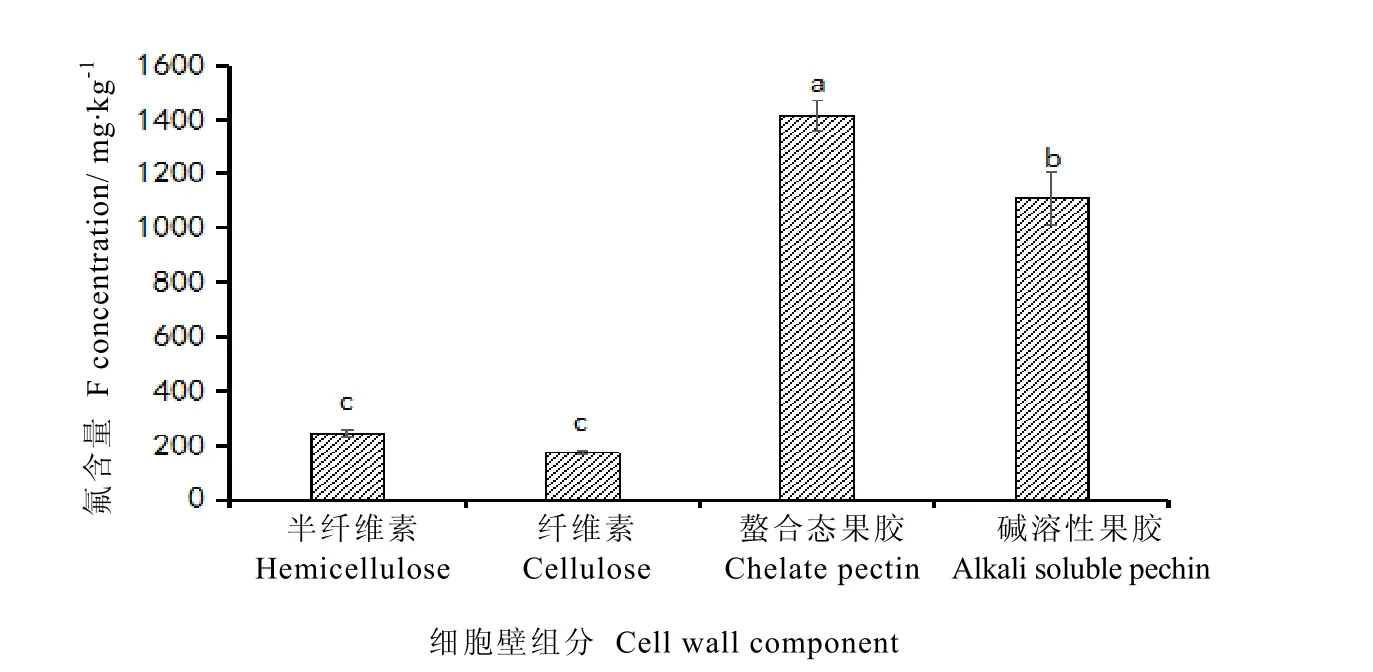
图3 氟在茶树叶片细胞壁各组分的分布Fig. 3 F distribution in cell wall fractions
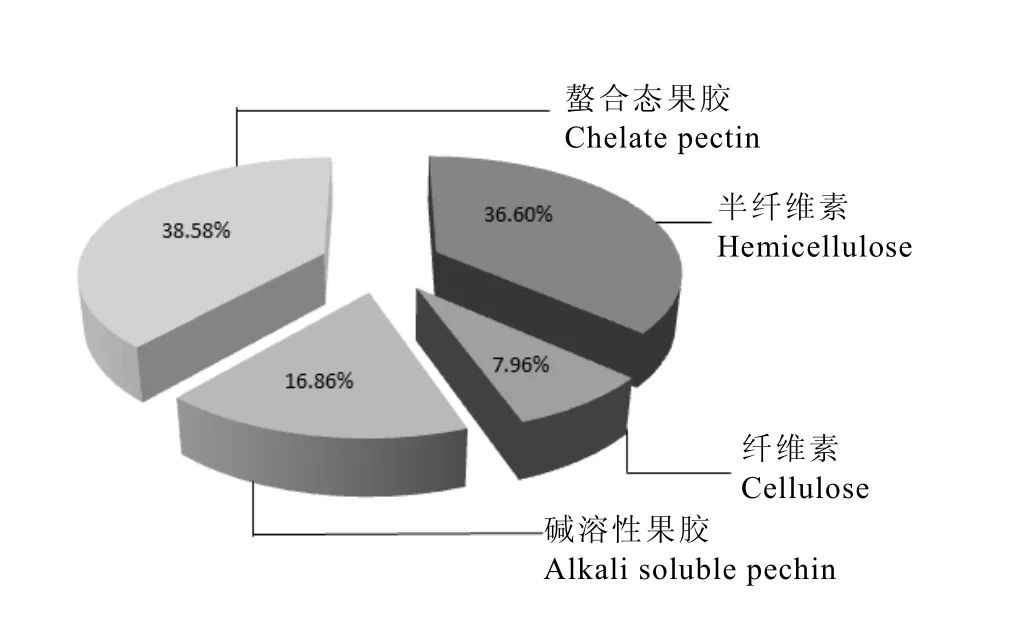
图4 茶树叶片细胞壁各组分中氟分布的相对比例Fig. 4 Relative F percentages in cell wall fractions
2.3 细胞壁结构变化对结合氟的影响
为探究叶片细胞壁结构变化对结合氟的影响,对叶片细胞壁进行了甲基化、酯化改性和酶解处理。结果(图5)表明,细胞壁甲基化和酯化后氟含量显著降低,比对照分别降低55.82%和 27.54%,细胞壁分别经纤维素酶和果胶酶处理后氟含量的变化和对照处理差异均不显著。说明,细胞壁中基团发生改变,对结合氟影响较大;而细胞壁中纤维素和果胶分子链大小对细胞壁结合氟的作用影响不明显。
2.4 细胞壁金属离子对结合氟的影响
2.4.1 细胞壁组分金属离子含量
由试验结果(表1)可以看出,茶树叶片细胞壁组分中 F与 Ca2+、Mn2+和 Al3+具有显著正相关,相关性系数分别为 0.749、0.841和 0.844,提示这几种金属元素可能对细胞壁结合氟起着重要作用。
2.4.2 细胞壁改性后金属离子及氟含量变化
茶树叶片细胞壁经改性后金属离子和氟含量如图6所示。细胞壁经甲基化处理后,随着氟含量的降低,镁、铁、钙、锰和铝离子含量较对照组下降显著,分别降低 82.08%、26.47%、31.27%、65.44%和 34.03%(图 6-A);酯化改性后镁、铁、钙、锰和铝离子含量较对照分别降低63.84%、14.71%、73.46%、62.16%和26.09%(图6-B)。
纤维素酶酶解处理细胞壁后镁含量显著降低,钙、铁、锰和铝金属离子含量变化不显著(图6-C);果胶酶酶解后镁、铁含量显著降低,而其他元素变化不明显(图6-D)。
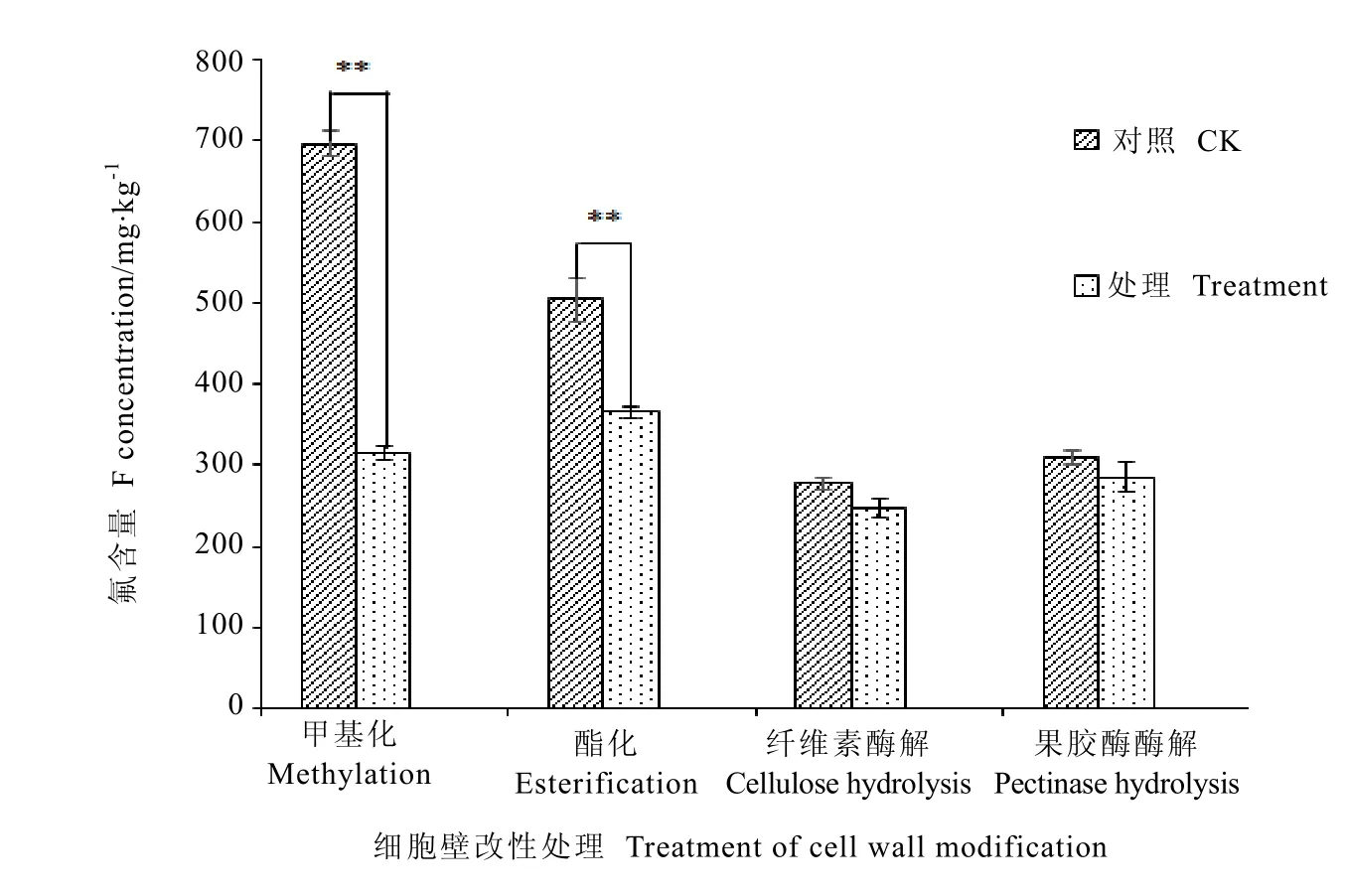
图5 细胞壁改性后氟含量变化Fig. 5 The F content of cell wall with methylation modification
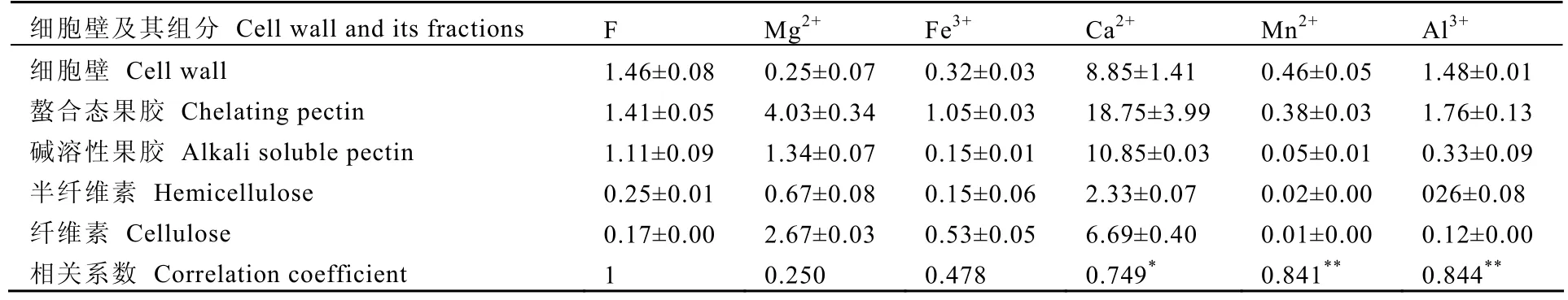
表1 细胞壁组分氟和金属离子含量及相关系数Table 1 Correlation coefficients of F and metallic elements in subcellular fractions mg·g-1
3 讨论
茶树对氟的高耐受性及强富集性,表明茶树体内必然存在着某种解毒机制。本文通过对茶树叶片中氟的亚细胞分布及其与细胞壁结合特性研究,发现在茶树3个品种乌牛早、福鼎大白和福云六号中,均表现为茶树叶细胞壁氟(1 854.79~2 676.94 mg·kg-1)最高,占细胞氟总量的 39.74%~56.49%,其次是可溶性组分,氟含量占细胞总量28.35%~37.32%,表明细胞壁和可溶性部分是茶树氟富集的最主要部位,这与重金属等元素在相关抗性植物亚细胞结构中的分布规律相似[17-21]。可溶性组分包括细胞质和液泡。液泡中含有丰富蛋白质,有机酸和有机植物碱等物质,是植物积累和贮存养料及多种代谢产物的重要器官,胞质中过剩的中间产物可被液泡吸收和贮存,减少对酶和细胞器的伤害[22]。植物液泡对过剩物质或有毒物质的区隔化作用已被很多研究证实,如在高铝介质中,大麦根细胞内Al3+通过Al3+/nH+交换机制贮存于液泡当中[17];蜈蚣草羽叶胞液是砷富集的最主要部位,减少了砷对蜈蚣草的毒性作用[19]。茶树吸收的氟一部分贮存于液泡中,可有效减少氟对细胞器的毒害作用,这可能也是茶树耐氟的重要原因之一。植物细胞壁主要是由多糖、蛋白质和木质素等组成的一个复合体,广泛参与植物生长发育及各种逆境胁迫响应,是重金属离子及其他有害元素进入细胞质的第一道屏障[23]。细胞壁中的蛋白质、多糖和果胶等生物大分子含有醛基、羧基、氨基和磷酸盐等基团结构,可提供大量离子交换位点[24-25]。
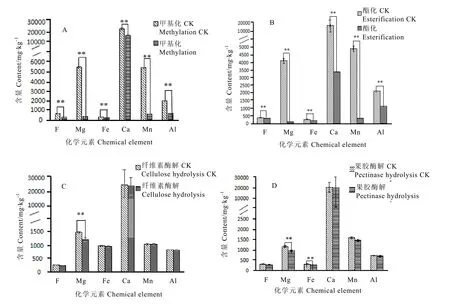
图6 细胞壁改性后金属离子及氟含量变化Fig. 6 The changes of metal ion and F contents in modified cell wall
本文研究表明,细胞壁中累积了叶片40%以上的氟,其中,果胶螯合的氟最多,占细胞壁氟55%以上,其次为半纤维素,占细胞壁氟36%以上。果胶和半纤维素都含有大量官能团-OH、-COOH、-CHO,可通过氢键、共价键、酯键、离子键等与蛋白质、其他糖分子、金属离子和氟离子结合形成复杂的网络共聚体,维持细胞正常生命活动。细胞壁经甲基化和酯化处理后,氟和镁、铁、钙、锰和铝等金属离子含量显著减少,而果胶酶和纤维素酶处理后,除镁、铁外,其他离子变化不明显,说明-COOH和-NH2可能在结合氟及金属离子中起主要作用,而糖分子链长短对结合氟及金属离子作用不明显。通过对细胞壁中金属离子与氟含量的相关性分析发现Ca2+、Mn2+和Al3+与F具有显著正相关,推测这几种金属离子在细胞壁结合氟方面发挥重要作用。
综合以上试验结果,茶树叶片中氟主要存在于细胞壁和可溶性组分中,细胞壁结合氟可能有两种形式,一方面氟可能与细胞壁中的-NH2、-COOH和-OH以氢键形式存在,另一方面与细胞壁中的金属离子以离子键结合而间接被细胞壁固定。细胞壁和液泡对氟的蓄积作用可能是茶树免遭氟毒害的重要机制之一。
[1] 张云桂, 张昊, 朱雯. 砖茶氟的防龋功效及其应用[J]. 茶叶通讯, 2010, 37(4): 7-8.
[2] Borah K K, Bhuyan B, Sarma H P. Lead, arsenic, fluoride,and iron contamination of drinking water in the tea garden belt of darrang district, Assam, India [J]. Environmental Monitoring and Assessment, 2010, 169: 347-352.
[3] Fan Z, Gao Y, Wang W, et al. Prevalence of brick tea-type fluorosis in the tibet autonomous region [J]. Journal of Epidemiology, 2016, 26(2): 57-63.
[4] 赵平花. 茶叶氟含量的研究及对人体健康的影响分析[J].福建茶叶, 2016(2): 28-29.
[5] 陈瑞鸿, 梁月荣, 陆建良, 等. 茶树对氟富集作用的研究[J]. 茶叶, 2002, 28(4): 187-190.
[6] 马立锋, 石元值, 阮建云, 等. 我国茶叶氟含量状况研究[J]. 农业环境保护, 2002, 21(6): 537-539.
[7] 吴命燕. 茶叶氟积累特性及降氟措施研究[D]. 杭州: 浙江大学, 2011.
[8] 郜红建, 刘腾腾, 张显晨, 等. 安徽茶园土壤氟在茶树体内的富集与转运特征[J]. 环境化学, 2011(8): 1462-1467.
[9] Hall J L. Cellular mechanisms for heavy metal detoxification and tolerance [J]. Journal of Experimental Botany, 2002, 53: 1-11.
[10] 李刚, 唐剑锋, 林咸永, 等. 小麦根尖细胞壁对铝的吸附/解吸特性及其与耐铝性的关系[J]. 植物营养与肥料学报,2007, 13(2): 192-199.
[11] Wu F B, Dong J, Qian Q Q, et al. Subcellular distribution and chemical form of Cd and Cd-Zn interaction in different barley genotypes [J]. Chemosphere, 2005, 60(10): 1437-46.
[12] 李春雷. 氟对茶树幼苗生理生化的影响及其作用机制研究[D]. 武汉: 华中农业大学, 2011.
[13] 蔡荟梅, 彭传燚, 侯如燕, 等. 三个品种茶树氟富集特性及其在亚细胞中的分布[J]. 中国农业科学, 2013, 46(8):1668-1675.
[14] 杨玉华, 喻敏, 杜昌文, 等. 不同硼效率油菜品种细胞壁组分中硼的分配[J]. 作物学报, 2005, 31(5): 608-611.
[15] 徐劼. 茶树(Camellia sinensisL.)对铅的吸收累积及耐性机制研究[D]. 杭州: 浙江大学, 2011.
[16] 朱晓静, 房峰祥, 张月华, 等. 茶叶及茶多糖中氟测定前处理方法的比较研究[J]. 茶叶科学, 2015, 35(2): 145-150
[17] Kasai M, Sasaki M, Tanakamaru S, et al. Possible involvement of abscisic acid in increases in activities of two vacuolar H+-pumps in barley roots under aluminum stress.Plant and cell physiology [J]. 1993, 34(8): 1335-1338
[18] Taylor GJ, Mcdonald-Stephens JL, Hunter DB, et al. Direct measurement of aluminum uptake and distribution in single cells ofChara coralline[J]. Plant Physiology, 2000, 123(3):987-996.
[19] 陈同斌, 阎秀兰, 廖晓勇, 等. 蜈蚣草中砷的亚细胞分布与区隔化作用[J]. 科学通报, 2006, 50(24): 2739-2744.
[20] 王爱霞, 方炎明. 空气重金属元素在悬铃木叶中的亚细胞分布及其区隔化效应[J]. 西北植物学报, 2011, 31(3):479-485.
[21] Gao H J, Zhao Q, Zhang X C, et al. Localization of fluoride and aluminum in subcellular fractions of tea leaves and roots[J]. Journal of Agricultural and Food Chemistry, 2014,62(10): 2313-2319.
[22] 汪良驹, 刘友良. 植物细胞中的液泡及其生理功能[J]. 植物生理学通讯, 1998, 34(5): 394-400.
[23] 刘清泉, 陈亚华, 沈振国, 等. 细胞壁在植物重金属耐性中的作用[J]. 植物生理学报, 2014, 50(5): 605-611.
[24] Allan D, Jarrell W. Proton and copper adsorption to maize and soybean root cell walls [J]. Plant Physiol, 1989, 89(3):823-832.
[25] 刘婷婷, 彭程, 王梦, 等. 海州香薷根细胞壁对铜的吸附固定机制研究[J]. 环境科学学报, 2014, 34(2): 514-523.

