临床指标不能可靠地识别急性前循环大动脉闭塞性卒中
黄 镪,张静泽,宋晓微,刘效风,马青峰,宋海庆,武 剑,3
急性前循环大动脉闭塞性卒中是缺血性卒中常见类型,其临床自然预后往往不良。急性期再灌注治疗(静脉溶栓和血管内干预)是此类卒中的有效且安全的治疗方法,其主要通过快速实现病变动脉的再通以改善预后[1,2]。再灌注治疗的临床决策需要考虑有效治疗时间窗,技术操作要求和再通率等影响因素。一方面,静脉溶栓治疗的技术操作要求简便且快捷,其技术可行性明显高于血管内干预[3,4];另一方面,静脉溶栓不仅有效治疗时间窗较短(二者分别为4.5 h和7.3 h)[1,5],而且再通率(二者的24 h再通率分别为34.1%和75.8%)及良好预后比例也明显低于血管内干预治疗[6];此外,血管内干预相对标准静脉溶栓治疗的平均发病至治疗时间往往需要延长60 min或更长时间[7],而且其也是早期的血管内干预与静脉溶栓疗效比较的随机对照试验失败的主要原因之一[8]。因而对前循环卒中病例,早期识别其病变动脉部位(近端的大动脉还是远端的分支小动脉),是选择合理的再灌注方案(静脉溶栓或血管内干预)的前提和获得最佳临床获益的重要依据。
目前诊断急性前循环大动脉闭塞性卒中的主要血管影像学检查依据包括全脑血管造影(digital subtraction angiography,DSA),CT血管成像(computed tomography angiography,CTA),磁共振血管成像(magnetic resonance angiography,MRA)和经颅多普勒(transcranial doppler,TCD)等,但上述检查均需要专职技术人员和较长的时间耗费,难以成为临床常规的再灌注治疗病例的筛选工具[9]。有研究结果显示平扫CT的大脑中动脉高密度征象(hyperdense sign of MCA,HDS-MCA)[10],美国国立卫生院神经功能缺损评分(National Institute of Health Stroke Scale,NIHSS)[11],早期结构影像学判定的卒中严重程度(如the Alberta Stroke Program Early CT Score,ASPECTS)[12]和改良的面-臂-语言-时间评分(FAST)[13]有助于早期识别及诊断急性大动脉闭塞性卒中。然而,单一指标的较低准确度[10~12]以及验证人群的总体代表性不足(混入了后循环卒中或单纯静脉溶栓治疗的缺血性卒中)[11,13]是上述研究结果推广的局限之处;此外,单纯应用临床评分可能难以可靠地识别大动脉闭塞病例,对应的可致高达20%的此类病例被漏诊[14]。本研究旨在探索上述指标联合应用于早期识别急性前循环大动脉闭塞性卒中的准确性,以期指导此类卒中的临床决策过程。
1 对象与方法
1.1 对象 研究回顾性纳入2011年4月~2014年12月北京宣武医院连续性收治的发病6 h内的具有完整的术前血管影像资料的前循环梗死病例资料进行分析。其中急性期的血管影像资料包括头部平扫CT和脑血管影像(CTA或DSA)结果。所有入选病例的院内诊治流程如前文所述[15]。简言之,急性卒中疑似病例经卒中绿色通道的快速临床及辅助检查筛选,对其中具有再通治疗适应症且无相关禁忌证的病例进行静脉溶栓治疗和(或)血管内干预。急性期静脉溶栓和血管内干预的适应证及禁忌证条件分别参照《中国急性缺血性脑卒中诊治指南2010》[3]和《中国缺血性脑血管病血管内介入诊疗指南》[4]。头部平扫CT和CTA检查均采用64排GE LightSpeed VCT扫描仪完成扫描。
1.2 方法 本研究中急性前循环大动脉狭窄/闭塞性卒中定义为大脑中动脉主干(M1段)和(或)颈内动脉闭塞性病变所致急性缺血性卒中,其血管病变诊断依据为发病6 h内再灌注术前的DSA或CTA判读的结果。HDS-MCA(+)定义为再通治疗术前平扫CT提示责任半球中有相对脑实质密度更高的大脑中动脉主干血管影像,其可能是颈内动脉末端至大脑中动脉起始段闭塞的征象[10]。单纯基线NIHSS≥10分被认为是独立预测前循环大动脉闭塞的指标[16],本文中还将探索NIHSS的其它阈值(如NIHSS分别为7~13分)的预测效能;ASPECTS按照Alberta卒中项目设定的评估大脑中动脉区早期缺血性变化的半定量评分系统评定,将发病6 h内平扫CT的ASPECTS≤7分定义为前循环大动脉闭塞性卒中[17]。本研究中将分析NIHSS,HDS-MCA及ASPECTS作为急性前循环大动脉闭塞结果的独立预测指标的准确度,而其它纳入分析的联合指标组包括:(1)HDS-MCA(+)和ASPECTS≤7;(2)HDS-MCA(+)和基线NIHSS≥7分;(3)HDS-MCA(+)和基线NIHSS≥8分;(4)HDS-MCA(+)和基线NIHSS≥9分;(5)HDS-MCA(+)和基线NIHSS≥10分;(6)HDS-MCA(+)和基线NIHSS≥11分;(7)HDS-MCA(+)和基线NIHSS≥12分;(8)HDS-MCA(+)和基线NIHSS≥13分;(9) ASPECTS≤7和基线NIHSS≥7分;(10)ASPECTS≤7和基线NIHSS≥8分;(11) ASPECTS≤7和基线NIHSS≥9分;(12)ASPECTS≤7和基线NIHSS≥10分;(13)ASPECTS≤7和基线NIHSS≥11分;(14)ASPECTS≤7和基线NIHSS≥12分;(15)ASPECTS≤7和基线NIHSS≥13分;(16)HDS-MCA(+),ASPECTS≤7和基线NIHSS≥7分;(17)HDS-MCA(+),ASPECTS≤7和基线NIHSS≥8分;(18)HDS-MCA(+),ASPECTS≤7和基线NIHSS≥9分;(19)HDS-MCA(+),ASPECTS≤7和基线NIHSS≥10分;(20)HDS-MCA(+),ASPECTS≤7和基线NIHSS≥11分;(21)HDS-MCA(+),ASPECTS≤7和基线NIHSS≥12分;(22)HDS-MCA(+),ASPECTS≤7和基线NIHSS≥13分。研究纳入分析的变量包括年龄、性别、危险因素、发病原因(心源性栓塞和非心源性栓塞)、发病至血管影像检查时间(onset to imaging time,OTI)、基线血压及血糖水平、身高体重指数(body mass index,BMI)、HDS-MCA、ASPECTS和基线NIHSS。其中发病时间指患者本次卒中的明确发病时间或者发病时间不明确时(如睡醒后卒中)已知的最后正常状态的时间点;血管影像检查时间指患者进行术前CTA或者DSA检查的开始时间。

表1 病例基线资料总体及组间比较结果
注:NIHSS为美国国立卫生院神经功能缺损评分;HDS-MCA为大脑中动脉高密度征象;ASPECTS 为Alberta卒中项目的早期平扫CT评分
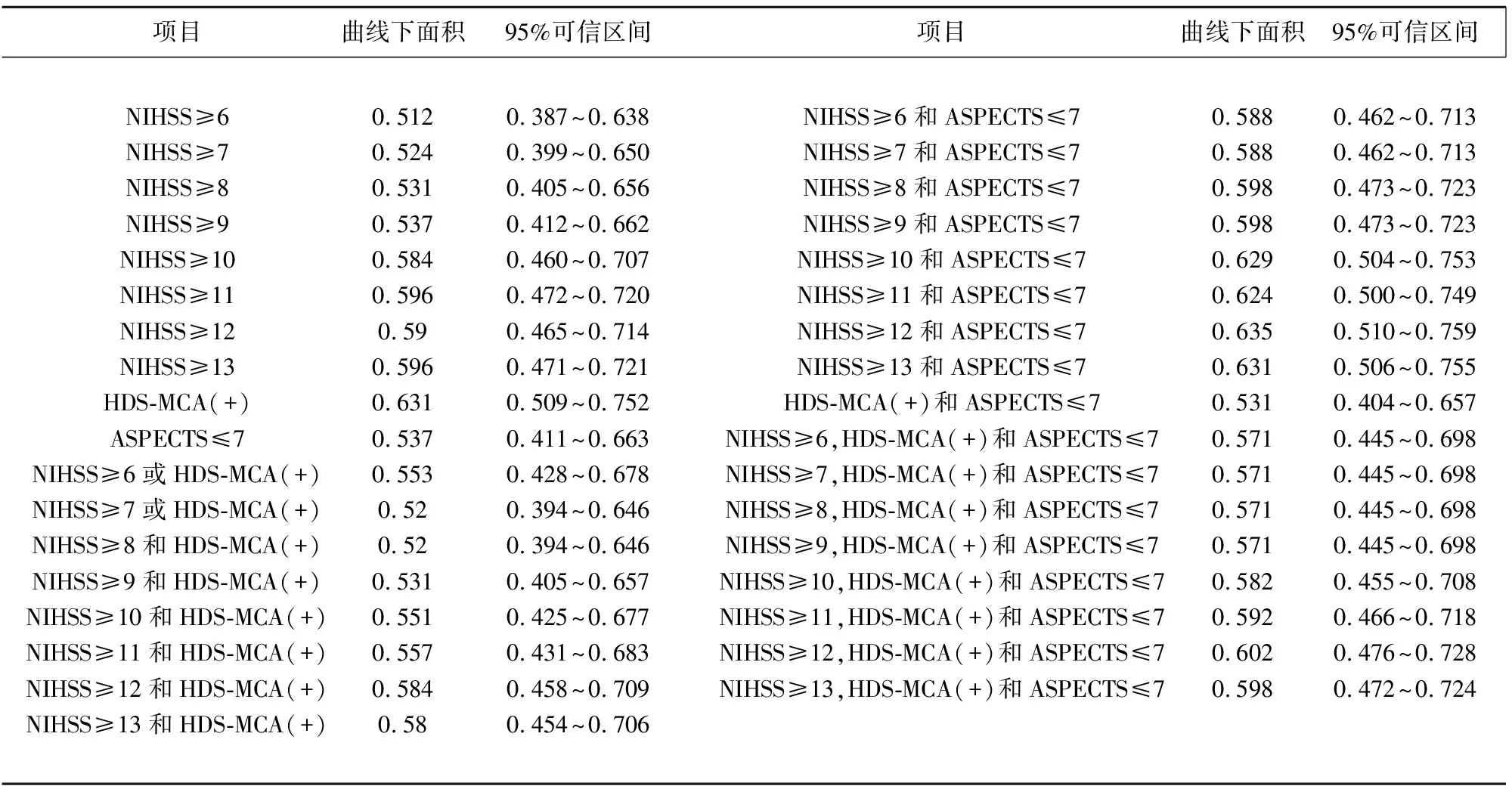
表2 不同判定方法的受试者工作特征曲线下面积及相关指标
NIHSS为美国国立卫生院神经功能缺损评分;HDS-MCA为大脑中动脉高密度征象;ASPECTS 为Alberta卒中项目的早期平扫CT评分
1.3 统计学分析 统计学计算应用SPSS 17.0软件,以Kruskal-Wallis检验变量正态性,以双侧P<0.05代表统计学差异。其中连续变量如年龄、NIHSS、OTI和BMI等以中位数及四分位数间距(interquartile range,IQR)表示。利用Mann-WhitneyU检验和Pearson Chi-Square检验比较对应变量的组间差异。以受试者工作特征曲线(receiver operator characteristic curve,ROC)比较上述预测指标的准确度,并绘制对应ROC曲线下面积图。
2 结 果
2.1 病例入选结果 研究期间共连续收治1078例急性卒中患者,其中141例(前循环缺血性卒中84例,占59.6%)完成了发病6 h内的血管影像学检查。前循环缺血性卒中病例中有58.3%(49/84)为大动脉闭塞性卒中,其平均年龄为58(49~68)岁,女性占26.2%(22/84),平均发病至血管影像检查的时间为210(141~312)min,平均基线NIHSS为10(6~15)分,其余基线资料结果(见表1)。根据有无前循环大动脉闭塞影像学结果分组后,有大动脉闭塞组的基线NIHSS(12比8,P=0.008),HDS-MCA阳性率(63.3%比37.1%,P=0.018)及房颤比例(22.4%比5.7%,P=0.037)显著高于无大动脉闭塞组;其它变量的组间比较无统计学差异(见表1)。
2.2 研究的主要统计结果 以发病6 h内的血管影像学诊断结果为参照标准,纳入分析的早期识别前循环大动脉闭塞性缺血性卒中的三种独立预测指标(NIHSS,HDS-MCA及ASPECTS)和22项联合指标的ROC分析结果分别见图1~图3,其对应的ROC面积结果见表2。其中单一预测指标中HDS-MCA(+)的预测准确度最高(ROC下面积为0.631,见图1),两项指标联合的复合指标中NIHSS≥12及ASPECTS≤7的预测准确度最高(ROC下面积为0.635,见图2),而三项指标联合的复合指标中NIHSS≥12,ASPECTS≤7及HDS-MCA(+)的预测准确度最高(ROC下面积为0.602,见图3)。
3 讨 论
本研究结果提示依据基线NIHSS,HDS-MCA和ASPECTS中的独立或联合指标预测急性前循环大动脉闭塞性缺血性卒中的准确度总体结果欠佳(0.512~0.635)。由于对急性前循环大动脉闭塞性缺血性卒中的漏诊和误诊均能带来严重的不良后果。一方面采用现有预测量表可能导致20%以上的此类病例因被送至无急性期血管内干预技术的医疗机构;另一方面,如果将已知量表的预测结果的假阴性率降至10%以下,则会导致几乎所有的缺血性卒中病例都需要接受急性期脑动脉造影检查[14]。因而仅凭借临床评分可能不能有效地识别急性前循环大动脉闭塞性缺血性卒中,而需要借助准确度更高的脑血管影像学技术。HDS-MCA阳性,低ASPECTS评分和高NIHSS评分都可以作为前循环大动脉急性闭塞的依据[10~12],但其均有各自对应的缺陷。首先,HDS-MCA阳性和ASPECTS≤7分两项指标本身的阳性率均较低[10,12],如国人急性缺血性卒中的HDS-MCA阳性率仅约为38.5%~60.0%[18,19],而本研究中其阳性率也仅53.4%。而且阳性率低可以解释HDS-MCA(+)判定前循环大动脉狭窄性卒中的准确度仅为低-中等程度,这与近期的一项第三次国际卒中试验的事后分析结果一致[20]。而尽管已有多项研究探索了不同NIHSS阈值作为识别前循环大动脉闭塞依据的可行性[11,16],但目前观点认为其固定阈值的差异性太大而降低了其预测结果的可靠性[21]。一项大规模队列研究结果也未能证实NIHSS存在可除外急性大动脉闭塞性卒中的固定阈值[14]。因而上述指标可能均难以成为识别急性前循环大动脉闭塞性卒中稳定及可靠的依据。
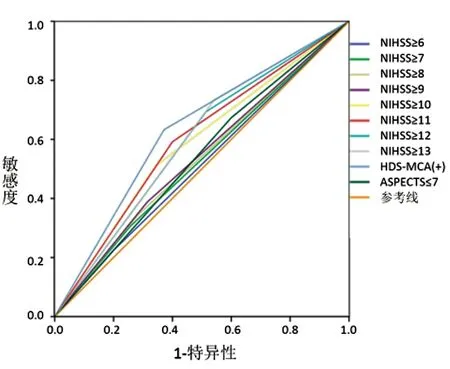
图1 单一指标预测结果的受试者工作特征曲线图(NIHSS为美国国立卫生院神经功能缺损评分;HDS-MCA为大脑中动脉高密度征象;ASPECTS 为Alberta卒中项目的早期平扫CT评分)

图2 两项指标组成的复合指标的预测结果的受试者工作特征曲线图(NIHSS为美国国立卫生院神经功能缺损评分;HDS-MCA为大脑中动脉高密度征象;ASPECTS 为Alberta卒中项目的早期平扫CT评分)

图3 3项指标组成的复合指标的预测结果的受试者工作特征曲线图(NIHSS为美国国立卫生院神经功能缺损评分;HDS-MCA为大脑中动脉高密度征象;ASPECTS 为Alberta卒中项目的早期平扫CT评分)
新型的改良评分可以提高预测结果的准确度,但其临床实用价值尚待进一步验证。近期三项大型研究分别对NIHSS中部分项目进行了重新组合以建立新型改良版评分(3-ISS,RACE及PASS评分),其预测急性大动脉闭塞结果的准确度分别为0.86,0.82和0.76[22~24]。此外,一项基于827例大动脉闭塞性缺血性卒中病例资料衍生的FAST改良评分(G-FAST),其内部验证结果显示相对原有量表可以显著提高预测结果的准确度[13]。值得说明的是,上述改良后的评分多未经过大规模外部数据的验证,而且其中大部分研究纳入了包括后循环卒中及前循环大脑中动脉远端(M2及M3段)的非经典急性期血管内干预适应症病例[11,13],部分研究还仅纳入静脉溶栓病例[13],这些局限削弱了其结论的可靠性及适用性。近期一项外部验证上述临床评分的结果提示其可靠性不足以取代再灌注治疗前的脑血管影像学检查[14]。
本研究的主要局限之处在于仅使用了单中心较小的样本量数据验证了NIHSS、HDS-MCA和ASPECTS预测急性前循环大动脉闭塞性卒中的可靠性,其结论尚需多中心数据的进一步验证。然而,研究中纳入了同一时期连续性入组的囊括了保守治疗,静脉溶栓治疗和血管内干预三种不同治疗方法的急性前循环缺血性卒中病例,其较好地克服了既往研究样本代表性不足的缺陷。
总而言之,NIHSS、HDS-MCA和ASPECTS不宜作为早期识别急性前循环大动脉闭塞性卒中的可靠性依据。尽管改良评分(如FAST评分)能一定程度上提高预测结果的准确性,但其仍不足以完全取代急性期血管影像学检查的作用。
[参考文献]
[1]Emberson J,Lees KR,Lyden P,et al. Effect of treatment delay,age,and stroke severity on the effects of intravenous thrombolysis with alteplase for acute ischaemic stroke:a meta-analysis of individual patient data from randomised trials[J]. Lancet,2014,384(9958):1929-1935.
[2]Sardar P,Chatterjee S,Giri J,et al. Endovascular therapy for acute ischaemic stroke:a systematic review and meta-analysis of randomized trials[J]. Eur Heart J,2015,36(35):2373-2380.
[3]中华医学会神经病学分会脑血管病学组急性缺血性脑卒中诊治指南撰写组. 中国急性缺血性脑卒中诊治指南2010[J]. 中国全科医学,2011,(35):4013-4017.
[4]中华医学会神经病学分会脑血管病学组缺血性脑血管病血管内介入诊疗指南撰写组. 中国缺血性脑血管病血管内介入诊疗指南[J]. 中华神经科杂志,2011,44(12):863-869.
[5]Saver JL,Goyal M,van der Lugt A,et al. Time to Treatment With Endovascular Thrombectomy and Outcomes From Ischemic Stroke:A Meta-analysis[J]. JAMA,2016,316(12):1279-1288.
[6]Badhiwala JH,Nassiri F,Alhazzani W,et al. Endovascular Thrombectomy for Acute Ischemic Stroke:A Meta-analysis[J]. JAMA,2015,314(17):1832-1843.
[7]Meschia JF,Barrett KM,Brott TG. Reperfusion therapy for acute ischemic stroke:how should we react to the Third Interventional Management of Stroke (IMS III) trial[J]. Mayo Clin Proc,2013,88(7):653-657.
[8]Pierot L,Soderman M,Bendszus M,et al. Statement of ESMINT and ESNR regarding recent trials evaluating the endovascular treatment at the acute stage of ischemic stroke[J]. Neuroradiology,2013,55(11):1313-1318.
[9]Wintermark M,Sanelli PC,Albers GW,et al. Imaging recommendations for acute stroke and transient ischemic attack patients:a joint statement by the American Society of Neuroradiology,the American College of Radiology and the Society of NeuroInterventional Surgery[J]. J Am Coll Radiol,2013,10(11):828-832.
[10]Jensen UR,Weiss M,Zimmermann P,et al. The hyperdense anterior cerebral artery sign (HACAS) as a computed tomography marker for acute ischemia in the anterior cerebral artery territory[J]. Cerebrovasc Dis,2010,29(1):62-67.
[11]Cooray C,Fekete K,Mikulik R,et al. Threshold for NIH stroke scale in predicting vessel occlusion and functional outcome after stroke thrombolysis[J]. Int J Stroke,2015,10(6):822-829.
[12]Han M,Choi JW,Rim NJ,et al. Cerebral infarct volume measurements to improve patient selection for endovascular treatment[J]. Medicine (Baltimore),2016,95(35):e4702.
[13]Scheitz JF,Abdul-Rahim AH,MacIsaac RL,et al. Clinical Selection Strategies to Identify Ischemic Stroke Patients With Large Anterior Vessel Occlusion:Results From SITS-ISTR (Safe Implementation of Thrombolysis in Stroke International Stroke Thrombolysis Registry)[J]. Stroke,2017,48(2):290-297.
[14]Turc G,Maier B,Naggara O,et al. Clinical Scales Do Not Reliably Identify Acute Ischemic Stroke Patients With Large-Artery Occlusion[J]. Stroke,2016,47(6):1466-1472.
[15]黄 镪,武 剑,马青峰,等. 全脑CT灌注成像指导静脉溶栓的有效性和安全性评价[J]. 中华医学杂志,2013,93(43):3419-3423.
[16]Broderick JP,Palesch YY,Demchuk AM,et al. Endovascular therapy after intravenous t-PA versus t-PA alone for stroke[J]. N Engl J Med,2013,368(10):893-903.
[17]Barber PA,Demchuk AM,Zhang J,et al. Validity and reliability of a quantitative computed tomography score in predicting outcome of hyperacute stroke before thrombolytic therapy. ASPECTS Study Group. Alberta Stroke Programme Early CT Score[J]. Lancet,2000,355(9216):1670-1674.
[18]Li Q,Davis S,Mitchell P,et al. Proximal hyperdense middle cerebral artery sign predicts poor response to thrombolysis[J]. PLoS One,2014,9(5):e96123.
[19]Man S,Hussain MS,Wisco D,et al. The location of pretreatment hyperdense middle cerebral artery sign predicts the outcome of intraarterial thrombectomy for acute stroke[J]. J Neuroimaging,2015,25(2):263-268.
[20]Mair G,Boyd EV,Chappell FM,et al. Sensitivity and specificity of the hyperdense artery sign for arterial obstruction in acute ischemic stroke[J]. Stroke,2015,46(1):102-107.
[21]Cappellari M,Bovi P. Threshold for NIH stroke scale in predicting vessel occlusion and functional outcome after stroke thrombolysis can change[J]. Int J Stroke,2016,11(9):91-92.
[22]Hastrup S,Damgaard D,Johnsen SP,et al. Prehospital Acute Stroke Severity Scale to Predict Large Artery Occlusion:Design and Comparison With Other Scales[J]. Stroke,2016,47(7):1772-1776.
[23]Singer OC,Dvorak F,du Mesnil DRR,et al. A simple 3-item stroke scale:comparison with the National Institutes of Health Stroke Scale and prediction of middle cerebral artery occlusion[J]. Stroke,2005,36(4):773-776.
[24]Perez DLON,Carrera D,Gorchs M,et al. Design and validation of a prehospital stroke scale to predict large arterial occlusion:the rapid arterial occlusion evaluation scale[J]. Stroke,2014,45(1):87-91.

