鼠神经生长因子联合依帕司他及甲钴胺治疗糖尿病周围神经病变的临床观察
陈福莲,安 颖,江晓龙,王慎田,郭世彪,董振华
糖尿病周围神经病变(diabetic peripheral neuropathy,DPN)是糖尿病最常见的慢性并发症之一,临床症状常表现为感觉异常、痛觉过敏、自发痛等,其存在较高的致残率及致死率,严重危害人们的健康。DPN发病机制尚不明确,目前研究认为DPN主要与氧化应激、神经生长因子(NGF)缺乏、血管性缺血缺氧等因素相关[1]。
神经生长因子(nerve growth factor,NGF)缺乏是DPN发生发展中的重要环节,NGF具有神经保护、神经营养以及促进神经生长的作用,应用外源性NGF可作为治疗DPN的一种方法[2]。氧化应激反应中最值得关注的就是多元醇通路的异常激活,其也是糖尿病患者DPN的重要发病机制之一。依帕司他 (epalrestat) 是一种可逆性非竞争型醛糖还原酶抑制剂 (aldose reductase inhibitor,ARI),它可特异性地阻断多元醇通路,有效干预糖尿病神经并发症的发生。目前《糖尿病周围神经病变临床诊疗规范》将甲钴胺作为对症处理的第一阶梯用药,但目前对于联合依帕司他及鼠神经生长因子在治疗糖尿病DPN方面的临床疗效差别尚未见相关研究报道。本研究通过随机分组、前瞻性研究分析方法,用甲钴胺做对照治疗组,通过联合应用鼠神经生长因子(mouse nerve growth factor,mNGF)或依帕司他以及三者联合治疗4 w后的疗效对比,评价依帕司他及鼠神经生长因子在治疗糖尿病患者DPN中的临床疗效,为临床用药的选择提供指导。
1 资料与方法
1.1 研究对象 选取2012年8月~2015年12月内分泌科就诊的2型糖尿病病史大于10 y合并DPN患者160例,其中男76例,女84例。糖尿病诊断符合中国2型糖尿病防治指南(2013年版)[3]提出的2型糖尿病诊断标准。DPN诊断根据中华医学会神经病学分会肌电图与临床神经电生理学组和中华医学会神经病学分会神经肌肉病学组联合制定的糖尿病周围神经病诊断和治疗共识[4]。纳入标准:(1)有明确的糖尿病周围神经病变的症状和体征;(2)肌电图检查四肢神经传导速度(nerve conduction velocity,NCV),包括感觉神经和运动神经的传导速度,有两项或者两项以上减慢者;(3)感觉定量检测温度觉阈值(thermal threshold,TT)、振动觉阈值(vibratory threshold,VT)4个部位有2个部位阈值高于正常参考值;(4)已停用治疗DPN的其他药物4 w以上。排除标准:1型糖尿病、恶性肿瘤、甲状腺疾病、严重心、肝、肾功能不全,2型糖尿病合并严重下肢血管病变者,其他疾病如颈椎病、腰椎间盘突出症、椎管狭窄等所致的周围神经病变或患有神经系统疾病的患者。脱落标准:治疗期间出现严重糖尿病急性并发症、因严重药物不良反应停止该治疗方案、因自觉疗效欠佳未完成治疗或加用其他药物、失访患者。所有患者均知情同意并签署知情同意书,研究经医院伦理委员会审核通过。160例DPN患者随机分为A(n=40)、B(n=40)、C(n=40)、D(n=40)4组,治疗过程中,A组有2例患者脱落,其中1例发生糖尿病酮症酸中毒,1例因单用甲钴胺疗效差擅自加用硫辛酸胶囊治疗;B组有1例患者因不能坚持服用依帕司他脱落;C组有2例患者因注射mNGF感注射部位疼痛停止治疗;D组患者因1例出现低血糖昏迷、1例治疗期间突发急性心急梗死未完成实验。最后完成治疗的A组38例,B组39例,C组38例,D组38例。4组患者在年龄、性别、病程、血糖水平、血脂水平等基线资料方面的差异无统计学差异(P>0.05),具有可比性(见表1)。

表1 各组一般资料与生化指标比较
1.2 研究方法
1.2.1 治疗方法 所有研究对象治疗期间均饮食控制、使用胰岛素或口服降糖药物控制血糖(血糖控制在空腹血糖<7.0 mmol/L,餐后2 h血糖<10.0 mmol/L),合并高血压者服用常规降压药物(血压控制在140/90 mmHg以下),合并高脂血症患者常规应用他汀类或贝特类降脂药物(血浆总胆固醇<4.5 mmol/L,低密度脂蛋白胆固醇<2.6 mmol/L,甘油三酯<1.7 mmol/L),所有受试者均未使用拜阿司匹林、氯吡格雷等抗血小板药物、硫辛酸、抗惊厥、抗抑郁、止痛药及其他改善循环、营养神经药物。A组(甲钴胺组):给予甲钴胺(生产厂家:卫才中国药业有限公司;批准文号:国药准字H20030812;规格:500 μg/片)口服,500 μg/次,1 d 3次;B组(甲钴胺联合依帕司他组):A组基础上加用依帕司他(生产厂家:扬子江药业集团;批准文号:国药准字H20040012;规格:50 mg/片)50 mg/次,1 d 3次;C组(甲钴胺联合鼠神经生长因子治疗组):A组基础上应用鼠神经生长因子(生产厂家:丽珠集团丽珠制药厂;批准文号:国药准字S20100005;规格:30 μg/支)30 μg/d,1 d 1次,肌肉注射;D组(鼠神经生长因子联合依帕司他、甲钴胺):B组基础上应用鼠神经生长因子 30 μg/d,1 d 1次,肌肉注射。上述4组均连续治疗4 w。试验期间监测空腹血糖、糖化血红蛋白、血脂、血压、肝肾功能等指标以及不良反应。
1.2.2 神经症状评分(neurological symptom assessment score,NSS) 对患者上下肢的四类神经症状(麻木、感觉异常、刺痛、烧灼痛)进行评分,根据每类症状发生频率及严重程度分别记分:发生频率,无:0分;偶尔:1分;经常:2分;几乎持续:3分;严重程度,无:0分;偶尔:1分;经常:2分;几乎持续:3分。根据最后的总分得分评定:轻度(0~8分)、中度(9~16分)、重度(17~24分)。
1.2.3 肌电图测定 患者治疗前后正中神经运动及感觉传导速度、腓总神经运动传导速度、腓肠神经感觉传导速度,参考临床症状测定左侧或右侧[5],结果判断参照汤晓芙所著的《临床肌电图学》[6]标准(按不同年龄分组建立,低于-2s的患者诊断为存在DPN)。
1.2.4 感觉定量的检测 各组治疗前后采用以色列Medoc生产的TSA-II定量温度觉分析仪及VSA3000定量振动觉分析仪进行感觉定量检测,检测部位为左侧或右侧(临床症状较重的一侧)食指与中指侧面、小鱼际表面、足背、小腿后侧。检测温度觉(冷觉、温觉、冷痛觉、热痛觉)时,应用半导体热敏探头接触患者受检区皮肤,给予5~52 ℃温度刺激,以0.25 ℃/s的速度进行递减或者递增;当受检者产生感觉时立即停止刺激,记录温度阈值,刺激重复3次后取平均值,值最终结果记录取4个部位平均值。温觉、热痛觉温度升高说明阈值增大,冷觉、冷痛觉温度值下降说明阈值增大。检测振动觉阈值时,检测部位与温度觉阈值相同,应用上升方法测出现阈值,振动频率为100 Hz,基础强度为0,最大强度为 25 μm,刺激强度变化率0.2 μm /s,每个部位刺激4次,每次间隔4 s,取平均值,最终结果记录取4个部位平均值。数值越大,说明振动觉阈值越高。
1.2.5 疗效 判断标准:(1)临床症状:肢体远端的四类神经症状麻木、感觉异常、刺痛、烧灼痛,治疗后周围神经症状基本消失或明显改善为显效,症状减轻为有效,无改善或加重为无效;(2)NCV、TT、VT值接近参考范围为显效,NCV、TT、VT值较治疗前有统计学差异为有效,NCV、TT、VT值较治疗前无统计学差异为无效。
2 结 果
2.1 治疗前后NSS比较 治疗前4组NSS总评分比较,差异无统计学意义(P>0.05);治疗后4组DPN患者麻木、感觉异常、刺痛、烧灼痛症状均较治疗前明显得到改善,治疗后NSS分值较治疗前均明显下降(P<0.05);并且治疗后B组、C组NSS分值明显均明显低于A组(P<0.05),D组NSS分值明显明显低于A、B、C 3组(P<0.05),但B组与C组比较,差异无统计学意义(P>0.05)(见表1)。
2.2 治疗前后神经传导速度结果比较 4组治疗前神经传导速度差异无统计学意义(P>0.05);治疗后4组神经传导速度较治疗前均明显增加(P<0.05),且治疗后B组、C组神经传导速度明显快于A组(P<0.05),D组治疗后神经传导速度明显快于A、B、C 3组(P<0.05);但B组与C组比较,差异无统计学意义(P>0.05)(见表2)。
2.3 治疗前后感觉定量检测结果比较 4组治疗前感觉定量检测各组冷觉、温觉、冷痛觉、热痛觉、振动觉阈值差异无统计学意义(P>0.05);治疗后4组温觉、热痛觉、振动觉阈值较治疗前均明显下降(P<0.05),冷觉、冷痛觉阈值较治疗前明显升高(P<0.05),且治疗后B组、C组温度觉阈值(TT)、振动觉阈值(VT)优于A组(P<0.05),D组治疗后温度觉阈值(TT)、振动觉阈值(VT)优于A、B、C 3组(P<0.05),但B组与C组比较,差异无统计学意义(P>0.05)(见表3)。
2.4 4种治疗方法总有效率的比较 D组治疗后有效率明显高于A、B、C 3组,B组、C组有效率高于A组,差异均有统计学意义(P<0.05);C组与B组比较,虽有效率略升高,但差异无统计学意义(P>0.05)(见表4)。
2.5 不良反应 4组均无心、肝、肾功能损害等严重的不良反应发生。C组患者有2例出现鼠神经生长因子注射部位疼痛,患者要求停药,退出试验。D组患者有1例出现mNGF注射部位疼痛,改变注射部位后,疼痛缓解,继续应用该药物治疗。

表1 4组治疗前后NSS比较
注:与同组治疗前比较*P<0.05;与 A组治疗后比较#P<0.05;与 B组治疗后比较&P<0.05;与C组治疗后比较¥P<0.05
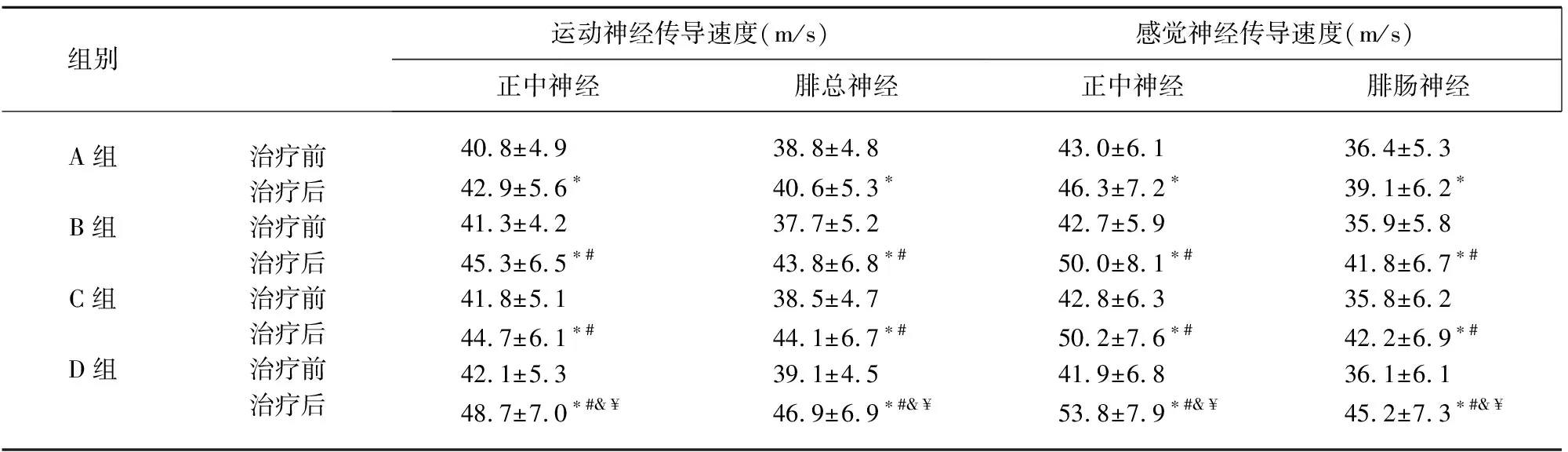
表2 4组治疗前后不同的NCV测定结果比较
注:与同组治疗前比较*P<0.05;与 A组治疗后比较#P<0.05;与 B组治疗后比较&P<0.05;与C组治疗后比较¥P<0.05
注:与同组治疗前比较*P<0.05;与 A组治疗后比较#P<0.05;与 B组治疗后比较&P<0.05;与C组治疗后比较¥P<0.05

表4 4组患者临床疗效比较[例(%)]
注:与A组比较*P<0.05;与B组比较#P<0.05;与C组比较&P<0.05
3 讨 论
DPN发病机制复杂,是高血糖、晚期糖基化终末产物、蛋白激酶C 通路和多元醇通路的激活、神经内膜代谢改变、神经营养因子缺乏、神经血流速度减慢等多因素共同作用的结果[7]。糖尿病患者,若血糖控制不达标,长期高血糖刺激,导致施旺细胞受损,NGF合成减少,轴突转运能力下降,使逆向运输至神经元的NGF也相应减少,影响神经的再生和修复,从而促进DPN的发生发展[8]。李书林等在研究中发现给予大鼠局部注射外源性神经生长因子后,发现大鼠受损的坐骨神经功能得到明显恢复[9]。目前研究已证实DPN患者的血清NGF水平与DPN的严重程度呈负相关,给予DPN患者重组人神经生长因子治疗,可显著改善患者神经病变的症状和体征[10,11],与本研究结果一致。在糖尿病高血糖状态时,糖酵解达到极限水平,多元醇通路的代谢明显加强,依帕司他 (epalrestat) 是一种可逆性非竞争型醛糖还原酶抑制剂 (aldose reductase inhibitor,ARI)。它可特异性地阻断多元醇通路,有效干预糖尿病神经并发症的发生[12]。Meta分析显示依帕司他对DPN症状改善的有效率与甲钴胺相似[RR1.12,95%CI0.89~1.41,P=0.32];在神经传导速度方面,依帕司他改善正中运动/感觉神经、腓总运动/感觉神经、胫神经运动/感觉神经传导速度的疗效与甲钴胺比较差异无统计学意义[13]。
甲钴胺又称甲基维生素B12,在临床中广泛应用于DPN的治疗,其可以通过甲基化反应起到修复受损细胞、提高神经传导速度的作用[14],目前已作为糖尿病周围神经病变诊疗规范的第一阶梯用药,但联合治疗方案诊疗规范没有明确推荐。因此,本研究从DPN多方面的发病因素入手,应用鼠神经生长因子联合依帕司他、甲钴胺治疗DPN,以期为DPN的治疗提供可行、安全、有效的方法。鼠神经生长因子是一种活性蛋白,从小鼠颌下腺中提取,具有神经营养、神经保护和促神经生长作用,依帕司他通过抑制葡萄糖通过多元醇通路产生代谢蓄积,从机制上阻断高血糖带来的周围神经损伤,因此两药合用具有优势互补作用。
本研究中,4组患者治疗后NCV、TT、VT均较治疗前显著改善(P<0.05)。B组在甲钴胺治疗基础上加用依帕司他及C组甲钴胺治疗基础上加用鼠神经生长因子,虽临床疗效、神经症状改善程度优于A组甲钴胺治疗组,但B、C组间比较没有差异,说明鼠神经生长因子和依帕司他在DPN近期临床疗效无明显差异。D组在依帕司他联合甲钴胺基础上补充外源性鼠神经生长因子,相对于A、B、C 3组,不仅NCV、TT、VT明显改善,患者的临床症状也明显改善,NSS显著下降,考虑由于甲钴胺、依帕司他、鼠神经生长因子作用机制不同,其联合用药有作用叠加效应,可作为治疗DPN一种推荐治疗方案。
本研究结果说明,鼠神经生长因子和依帕司他有效地缓解了病程大于10 y的糖尿病患者DPN的临床症状,改善神经病变的严重程度。与临床治疗DPN的常用药物甲钴胺作为对照,甲钴胺联合鼠神经生长因子及依帕司他三药治疗组的DPN治疗效果明显优于甲钴胺单药及双药治疗组,鼠神经生长因子联合甲钴胺组及依帕司他联合甲钴胺双药治疗组DPN疗效优于甲钴胺单药治疗组。但对比甲钴胺联合鼠神经生长因子和甲钴胺联合依帕司他治疗组未发现疗效差异。本研究证实了鼠神经生长因子联合依帕司他、甲钴胺治疗DPN的临床疗效显著,但研究的样本量偏少,观察时间偏短,此结论有待需更大样本量、观察时间更长、多中心的随机对照研究进一步验证。本研究进行4 w时间,仅对DPN的近期疗效进行观察,由于各种药物作用机制不同,远期疗效的差别有待进一步考证。在研究对象的选择上,本研究选取的是病程大于10 y的血糖控制良好的糖尿病患者,研究对象糖尿病患病病程较长,对于早期糖尿病神经病变患者参考价值有限。
[参考文献]
[1]史 蕊,孙 佩,王璐璐,等. 鼠神经生长因子联合维生素D、甲钴胺治疗糖尿病周围神经病变的临床观察[J]. 山东大学学报(医学版),2016,54(4):64 -67.
[2]沈 丽,王 妍. 神经生长因子的研究及应用进展[J]. 微生物学免疫学进展,2015,43(6):48-52.
[3]中华医学会糖尿病学分会. 中国2型糖尿病防治指南(2013年版)[J]. 中华糖尿病杂志,2014,6(7):447-498.
[4]中华医学会神经病学分会肌电图与临床神经电生理学组,中华医学会神经病学分会神经肌肉病学组. 糖尿病周围神经病诊断和治疗共识[J]. 中华神经科杂志,2013,46(11):787-789.
[5]肖凌凤,李文娟,孟利平,等. 血清25羟维生素D缺乏与2型糖尿病周围神经病变的相关性[J]. 中国糖尿病杂志,2014,22(8):711-714.
[6]汤晓芙. 临床肌电图学[M]. 北京:中国协和医科大学出版社,1995. 134.
[7]杨秀颖,张 莉,陈 熙,等. 2型糖尿病周围神经病变机制研究进展 [J]. 中国药理学通报,2016,32(5):598-602.
[8]Dey I,Midha N,Sigh G,et al. Diabetic Schwann cells suffer from nerve growth factor and neurotrophin-3 underproduction and poor associability with axons[J],Glia,2013,61(12):1990-1999.
[9]李书林,蒋晓江,陈曼娥. 大鼠坐骨神经损伤后髓鞘碱性蛋白与神经功能的变化及神经生长因子的影响[J]. 中国临床康复,2002,6(6):798-799.
[10]Kim HC,Cho YJ,Ahn CW,et al. Nerve growth factor and expression of its receptors in patients with diabetic neuropathy[J]. Diabet Med,2009,26(12):1228-1234.
[11]Apfel SC,Kessler JA,Adornato BT,et al. Recombinant human nerve growth factor in the treatment of diabetic polyneuropathy. NGF Study Group[J]. Neurology,1998,51(3):695-702.
[12] 王 杨,刘 畅. 依帕司他治疗糖尿病周围神经病变的疗效及机制[J]. 中国老年学杂志,2015,1(35):93-95.
[13] 贾 佳,余江毅. 依帕司他治疗糖尿病周围神经病变的Meta分析[J]. 中国糖尿病杂志,2013,21(9):782-788.
[14] 吕 锐,潘鑫辉,朱肖群,等. 甲钴胺联合前列地尔治疗糖尿病周围神经病变46例[J]. 中国现代医生,2012,50(6):59-60.

