急性脑梗死患者血清Apelin-13水平及其临床研究
高红安,王彦喆,唐 菱,席天阳,刘 慧,姚晓濛,何志义
急性脑梗死(Acute Cerebral Infarction,ACI)是神经科的常见病,具有较高的致死率、致残率,是一类严重危害中老年人身体健康的常见疾病。动脉粥样硬化是脑梗死的主要原因。Apelin是G蛋白偶联受体-血管紧张素1型受体(Angiotensin Ⅱ receptor type 1,AT1)相关蛋白(putative receptor protein related to AT1,APJ)的天然配体。既往基础研究结果显示,Apelin在神经元的胞体和神经纤维中均有大量的表达,且具有神经保护作用,能对抗兴奋性毒性损伤、氧化应激损伤,抑制神经细胞的凋亡等,是一种内源性神经保护因子[1,2]。而在心血管疾病中发现Apelin和(或)/APJ系统有潜在的心功能代偿效应,因此其表达与功能的下调成为心衰发生发展的可能原因之一[3]。基于缺血性疾病的共同病理生理,那么在急性缺血性脑血管病变中,Apelin的水平是否也在不同的阶段有着不同的变化,其不同的水平变化是否与脑梗死病情轻重和预后有着相关性[1,2]。Apelin作为一种血管活性肽,其蛋白前肽可被蛋白酶分解成有活性的Apelin片段,如Apelin36、Apelin31、Apelin13和Apelin12等,目前在亚洲地区人群中Apelin最为常见的亚型为Apelin-13[4]。Apelin-13是神经系统中的一种表达丰富的肽,Apelin-13可保护大脑,免受缺血、缺氧、再灌注的损伤,且通过抑制自噬来减轻创伤性脑损伤[3],其血清水平与急性脑梗死病情以及预后的关系尚不清楚。因此,本研究将对急性脑梗死不同时期的血清Apelin-13水平进行检测,并对ACI患者进行NIHSS评分、随访患者mRS分组;分析NIHSS评分、梗死部位及面积大小、随访患者mRS与血清Apelin-13水平的关系,探讨血清Apelin-13水平对急性脑梗死病情变化的临床意义。
1 资料与方法
1.1 一般资料 病例组:选择2016年8月~2017年10月期间在本溪市中心医院神经内科病房住院的首次发作的急性脑梗死患者82例,均符合中国急性缺血性脑卒中诊治指南 2014年制定的急性脑梗死诊断标准[5],并经头部MRI和/或CT证实。排除标准:(1)既往脑卒中病史者;(2)合并心、肝、肾、血液系统和内分泌系统等严重原发性疾病者;(3)合并自身免疫性疾病和肿瘤的患者;(4)合并严重感染性疾病患者;(5)近3 m有严重外伤史和重大手术史者。
对照组:来自同期本溪市中心医院体检中心健康对照组30例,均为汉族,无血缘关系。对照组年龄、性别、高血压患病率、血脂异常、糖尿病患病率与病例组比较情况(见表1)。所有正常对照均排除既往脑卒中病史、近3 m有脑病外伤史、患有严重心、脑、肝、肾、感染性疾病;自身免疫性疾病及血液病、肿瘤疾病的患者。研究经过本溪市中心医院伦理委员会通过,所有受试者均签署书面的知情同意书。

表1 ACI患者与对照组基线资料比较
注:有统计学差异P<0.05
1.2 方法 ACI组在入院1 d、7 d、14 d采集静脉血5 ml,对照组在体检当日采集静脉血5 ml,采用 ELISA法检测所有受检者的血清Apelin-13水平,试剂盒购自上海杏宜有限公司,严格按照试剂盒说明进行操作。ACI患者采用NIHSS评分进行神经功能缺损评分,ACI组按牛津郡社区卒中计划(oxfordshire community stroke project,OCSP)分型标准[6],分为完全前循环梗死(total anterior circulation infarct,TACI)、部分前循环梗死 (partial anterior circulation infarct,PACI)、 后循环梗死(posterior circulation infarct,POCI)、腔隙性脑梗死(lacunar infarct,LACT),同时测量病灶的最大层面的长径,将病例组分为3组:大梗死组(最大直径≥5 cm)、中梗死组(5 cm>最大直径≥3 cm)及小梗死组(最大直径<3 cm)[7]。对病例组随访3 m,期间进行改良Rankin量表(mRS)评分,将病例组分为预后良好组(mRS≤2分)和预后不良组(mRS>2分),比较两组患者血清Apelin-13水平的差异。

2 结 果
2.1 两组人群血清Apelin-13水平比较 从表2可以看出,入院1 d、7 d、14 d血清Apelin-13水平差异有统计学意义,即随着入院时间的延长血清Apelin-13水平呈升高的趋势。与对照组比较,ACI患者不同时间点血清Apelin-13水平均低于对照组血清Apelin-13水平(即P<0.05)。
2.2 ACI组不同的OCSP分型与血清Apelin-13水平的相关性 从表3可以看出,OCSP分型后各组的血清Apelin-13水平比较有差异,其组间存在差异(P<0.05),TACI组Apelin-13 水平低。
2.3 ACI组不同的梗死面积与血清Apelin-13水平的相关性 从表4可以看出,按梗死面积分组后各组血清Apelin-13 水平比较有差异(P<0.05),小面积组血清Apelin-13 水平高。
2.4 血清Apelin-13水平与NIHSS评分的相关性 从表5及图1可以看出,NIHSS评分随入院时间的延长呈现逐渐降低的趋势,相应血清Apelin-13水平呈逐渐上升趋势。急性脑梗死患者入院1 d、7 d、14 d血清Apelin-13水平与脑梗死严重程度分别呈负相关(r分别为-0.912、-0.986、-0.778,P均<0.05)。
2.5 ACI组患者90 d后不同预后情况(mRS)的比较 从表6可以看出,根据随访患者mRS分组后两组患者血清Apelin-13 水平有差异,P<0.05。预后良好组血清Apelin-13 水平高。

表2 ACI组和对照组在不同时期Apelin-13水平比较(ng/ml)
注:ACI组1 d、7 d、14 d血清Apelin-13水平比较,a:ACI组1 d、7 d、14 d血清Apelin-13水平和对照组比较P<0.05;b:ACI组14 d和7 d比较P<0.05;c:ACI组7 d、14 d分别和1 d比较P<0.05;(两两比较应用Dunnet法)。

表3 ACI组OCSP分型的血清Apelin-13水平比较(ng/ml)
注:TACI:完全前循环梗死;PACI:部分前循环梗死;POCI:后循环梗死;LACT:腔隙性脑梗死。与TACI型比较a:P<0.05;与PACI型比较b:P<0.05;与POCI 型比较c:P<0.05
表4 ACI组脑梗死面积大小与血清Apelin-13水平比较(ng/ml)
注:1 d、7 d、14 d时不同梗死面积组之间比较,a:与大梗死组比较P<0.05;b:与中梗死组比较P<0.05。梗死面积相同组1 d、7 d、14 d比较,与1 d比较c:P<0.05;与7 d比较d:P<0.05

表5 ACI组不同时期血清Apelin-13水平与NIHSS评分的比较(ng/ml)
注:入院1 d、7 d、14 d血清Apelin-13水平与NIHSS评分比较及相关性,a:P<0.05
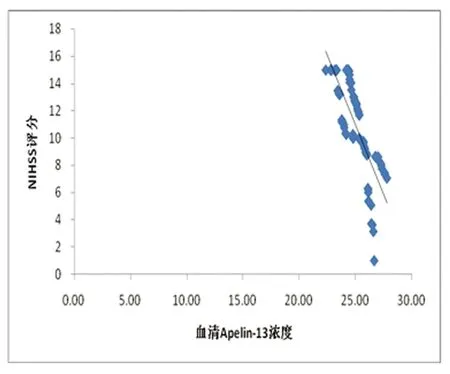
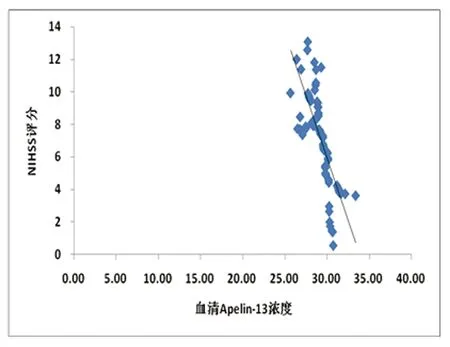

图1 入院1 d、7 d、14 d血清Apelin-13水平分别与当日NIHSS评分呈负相关

表6 ACI组患者不同预后的指标比较(mRS)
注:取入院1 d Apelin-13 水平及NIHSS评分进行比较;预后不良与预后良好组比较,a:P<0.05
3 讨 论
急性脑梗死是神经科急症,不但具有较高的致死率、致残率,而且常伴有多种严重并发症。寻找急性脑梗死严重程度以及预后的影响因素并加以干预,已经成为近期针对缺血性脑血管病研究的热点问题。
刘宇欣等[8]在研究中发现,颈动脉内膜正常组血浆Apelin水平显著高于内膜增厚组、斑块形成组及血管狭窄组,血浆Apelin水平与收缩压、总胆固醇、低密度脂蛋白、颈动脉内层中膜厚度等脑梗死的传统危险因素呈负相关,并且血浆Apelin水平在脑梗死急性期下降。在心血管疾病的研究中,倪萍等[9]研究显示冠心病实验组的血浆Apelin水平显著低于对照组。与以往研究结果类似,我们在本研究中发现:ACI组血清Apelin-13水平明显低于对照组,且随着治疗时间的延长(从1 d~14 d),血清Apelin-13水平逐渐升高。本研究还对ACI组患者的梗死面积进行了统计,并将其与Apelin-13水平进行了分析。通过显著性分析得出结论:梗死面积小的患者其血清Apelin-13水平较梗死面积大的患者血清Apelin-13水平高。在梗死位置及OCSP分型中,TACI组血清Apelin-13水平与其他三组有明显统计学差异,且梗死部位越广泛、面积越大,Apelin-13水平越低。并且,通过随访根据患者mRS进行分组后进一步分析,预后良好组血清Apelin-13 水平高,说明Apelin-13水平增高对患者病情严重程度的评估、预后也有一定的提示作用。综合以上研究结果,Apelin-13可能是急性脑梗死的保护性因子,且血清Apelin-13水平可以作为判断急性脑梗死早期预后的生物标志物。
在动物模型中,董昕等[10]通过对脑缺血模型大鼠脑侧室给药,注射0.1 μg/kg、1.0 μg/kg、10 μg/kg 3种不同剂量的Apelin-13,2 h后其神经功能评分均较对照组低,且体现出剂量效应。在临床实验中,张学敏等[11]发现健康对照组、ACI组不同时期的血清Apelin-13水平比较,差异有统计学意义(P<0.05),其中ACI组1 d Apelin-13水平低于健康对照组,ACI组14 d、21 d、30 dApelin-13水平高于ACI组1 d(P<0.05);并且此研究通过ACI患者预后情况分析,发现Apelin-13与预后显著相关(P<0.05),其中预后差者Apelin-13水平低于预后好和预后一般者。本研究通过对ACI组入院1 d、7 d、14 d血清Apelin-13水平和NIHSS评分进行直线相关性分析,发现3个时间点的血清Apelin-13水平均与NIHSS评分呈负相关,可见Apelin-13与ACI患者的神经功能缺损程度有关,且血清Apelin-13水平越高,其神经功能缺损程度越轻,病情预后越好,进一步证实了血清Apelin-13水平在急性脑梗死中的神经保护作用。
Apelin-13如何作为脑梗死保护因子的作用机制尚不明确,通过既往对Apelin-13的研究结果,我们推测出如下几点:(1)Bao等学者发现Apelin可以减轻大脑外伤损伤后的二次损伤,表现出对神经细胞的保护作用[12],其可能机制是通过减少大脑的水含量、减少血脑屏障的破坏、减少水通道蛋白-4的表达、减少大脑皮质和海马体的Caspase-3的表达、减少细胞凋亡。(2)Xin[13]对脑缺血再灌注损伤大鼠模型脑室内注射 Apelin-13,发现髓过氧化物酶活性被明显抑制,大鼠血清炎症因子如肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-1β (interleukin 1β,IL-1β)、细胞间黏附分子-1(intercellular adhesion molecule-1,ICAM-1)水平亦明显降低,APJ 表达上调;Apelin-13 脑室给药明显抑制再灌注损伤后离子钙接头蛋白(ionized calcium binding adaptor molecule 1,Iba1)、神经胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)和高迁移率族蛋白1 (high mobility group box-1 protein,HMGB1)的表达,提示 Apelin-13可通过抑制小胶质细胞、星形胶质细胞和其他炎症细胞的功能而起到抗炎作用[14],因此推测 Apelin-13在急性脑梗死的病理过程中是通过抗炎机制发挥对缺血再灌注损伤脑组织的保护作用。(3)张学敏等学者[11]提出Apelin-13在患者发病时降低可能与ACI发病时其表达减少有关;也可能是因为患者体内Apelin-13及其受体减少从而降低了对缺血性脑卒中的保护作用,从而可能诱发了疾病的发生。综上所述,Apelin-13在急性脑梗死中可能通过多种途径产生神经保护作用,其具体机制值得我们进一步探索。
本研究依然存在一些不足,首先我们的研究样本量较少,其病例数量不多,可能缺乏普遍性。其次,仅仅分析NIHSS、梗死位置及梗死面积大小与血清Apelin-13水平的关系,试图探讨急性脑梗死患者血清Apelin-13水平的临床意义,但是其相关指标探讨的并不够全面,而且其结果可能具有一定的局限性。在以后的研究过程中,我们尽量采用多中心临床试验、并增加纳入研究的病例数以便能得到更加确定的结论。
综上所述,Apelin-13水平与患者的神经功能缺损程度负相关。血清Apelin-13可能为急性脑梗死的保护性因子,可以作为急性脑梗死治疗及判断预后的血清标志物。
[1]O’Carroll AM,Lolait SJ,Harris LE,et al. The apelin receptor APJ:journey from an orphan to a multifaceted regulator of homeostasis [J]. J Endocrinol,2013,219 (1):R13-35.
[2]刘益民,韩远远,张慧敏,等. 经鼻给予TGF-β1对匹罗卡品诱导的癫痫持续状态大鼠海马内炎症反应的影响[J]. 中风与神经疾病杂志,2012,29(2):109-112.
[3]邓 琳,周宇宏,乔国芬. APJ/Apelin系统心血管保护作用的研究进展[J]. 中国医药导报,2013,10(30):35-38.
[4]Niso li E,Clementi E,Paolucci C,et al. Chronic rapid atrial pacing:structureal functional and electrophysiological characteristics of a new model of sustained atrial fibrillation[J]. Circulation,1995,91:1588.
[5]中华医学会神经病学分会. 中国急性缺血性脑卒中诊治指南2014[J]. 中华神经科杂志,2015,48(4):246-257.
[6]Bamford J,Sandercock P,Dennis M,et al. Classification and
natural history of clinically identifiable subtypes of cerebral infarction [ J ]. Lancet,1991,337 (8756):1521-1526.
[7]刘 丹,陆丽丽,张 伟,等. 髓样细胞触发受体样转录因子-1与急性脑梗死的相关研究[J]. 中风与神经疾病杂志,2017,34(6):516-518.
[8]刘宇欣,付 研. 急性颈动脉硬化性脑梗死患者血浆Apelin水平的相关性研究[J]. 中国病案,2017,18(5):102-106.
[9]倪 萍,赵志强. 血浆Apelin在不同类型冠心病中的表达及与左心室重构的关系[J]. 中国循证心血管医学杂志,2016,8(7):868-871.
[10]董 昕,陆素青,廖慧颖,等. Apelin-13对大鼠脑缺血-再灌注损伤的保护作用[J]. 天津医药,2015,43 (5):484-487.
[11]张学敏,唐建国,谢 娟,等. 急性脑梗死患者不同时期Apelin-13及应激相关蛋白水平的变化及其与预后的关系研究[J]. 中国全科医学,2016,19(19):2302-2306.
[12]Bao HJ,Qiu HY,Kuai JX,et al. Apelin-13 as a novel target for intervention in secondary injury after traumatic brain injury [J]. Neural Regeneration Research,2016,11(7):1128-1133.
[13]Xin Q,Cheng B,Pan Y,et al. Neuroprotective effects of apelin-13 on experimental ischemic stroke through suppression of inflammation[J]. Peptides,2015,63:55-62.
[14]Xiang Z,Shan Y,Like ZH,et al. Neuroprotective effect of the endogenous neural peptide apelin in cultured mouse cortical neurons [J]. Exp Cell Res,2010,316(11):1773-1783.

