经乙状窦后-内听道入路微创手术治疗听神经瘤
陈立华 徐如祥 李文德 于斌 张洪钿 赵浩
听神经瘤理想的治疗目标是在保留面听神经功能的前提下,做到肿瘤全切除,避免严重的并发症,以提高术后生存质量。神经影像融合技术、术中实时电生理监测以及微创显微神经外科技术的进步,使听神经瘤手术治疗的重点由全切除肿瘤以延长生命转变到保留面听神经功能以提高生活质量,这一理念的变化使笔者对听神经瘤的治疗有了新的认识[1-3]。术中应用多模态技术辅助手术,采用包膜下肿瘤分离,不仅提高了听神经瘤的全切除率,也提高了面神经的功能保护率[4]。本文回顾性分析陆军总医院附属八一脑科医院自2000年1月至2017年12月收治的听神经瘤患者887例,均经乙状窦后-内听道入路,采用微创显微神经外科技术,获得良好的手术疗效,现报道如下。
资料与方法
一、一般资料
本组患者共887例,其中男性438例,女性449例,年龄 21.6~74.0 岁,平均(45.7±4.3)岁。 病程范围4个月~16年,平均(2.9±0.5)年;左右侧病变位置无差异,左侧439例,右侧448例。术前外院行伽玛刀治疗者36例,其中27例伽玛刀术后肿瘤继续增大或出现囊性变,另9例听力严重下降。
临床表现:最典型和最常见的症状是患侧耳鸣伴进行性听力下降。首发症状表现为耳鸣,后出现听力障碍者754例;以耳蜗神经的破坏性症状-听力障碍,无耳鸣就诊者107例;以其他症状,如头晕或眩晕、头痛、面部感觉异常、吞咽障碍、平衡障碍就诊者26例。查体:所有患者均有不同程度的听力障碍,其中继发性三叉神经痛者4例,面部感觉减退或麻木者32例,声音嘶哑、吞咽困难者15例,面肌轻瘫者7例,行走不稳或肢体平衡障碍者87例,对侧肢体力弱、轻瘫试验阳性者11例,头痛、伴或不伴视乳头水肿等颅高压症状者23例,幕上脑室不同程度地扩大者42例。
二、术前影像学评估
所有病例均行MRI检查,其中775例患者同时行CT检查,包括内听道薄层CT骨窗位像。CT表现为类园形或分叶状肿块,增强扫描有明显强化。骨窗位像除31例骨性内听道扩大不明显外,其余均为不同程度的内听道扩大,呈漏斗状。
MRI检查的序列包括T1和T2加权像(T1-WI、T2-WI)平扫和增强扫描、磁共振静脉成像和DTI等。表现为以内听道口为中心向桥脑小脑角区生长,紧贴岩骨,以锐角与岩骨相交;肿瘤位于桥小脑角池。肿瘤在T1-WI表现为低信号或等低信号,T2-WI呈高信号或等高信号,增强强化明显(图1)。肿瘤边界清楚、边缘光整、周围常有一环形低信号带(785例);部分肿瘤边界不清晰,呈毛刺状(102例)。瘤内有陈旧性出血8例(均为伽玛刀术后)。根据MRI轴位像测得肿瘤在桥小脑角的最大直径,肿瘤大小约1.5~5.7 cm,平均3.87 cm。

图1 左侧听神经瘤术前增强MR资料
三、手术主要步骤及要点
所有患者均采用枕下乙状窦后-经内听道锁孔入路,除67例取半坐位外,其余均采用侧卧位。神经导航引导下定位横窦和乙状窦交汇处钻一孔,铣刀骨瓣成形(2.5 cm×3.0 cm)。骨窗上缘显露横窦下缘,外侧暴露乙状窦后缘。根据肿瘤的大小和位置决定骨窗范围。
1.显露肿瘤:依次打开小脑延髓外侧池、枕大池和延髓前池,充分释放脑脊液,使小脑组织自然回缩。镜下完全剪开、松解颈静脉孔区的蛛网膜,游离后组脑神经和小脑后下动脉,以小脑不需牵拉为原则,调整牵开器将小脑半球向后外侧牵开,防止其下陷影响术野。
2.肿瘤分离:在神经电生理监测仪的辅助下,电凝切开覆盖在肿瘤背侧的蛛网膜,向肿瘤上、下两极推开,沿肿瘤表面的蛛网膜间隙分离肿瘤与小脑、桥脑的界面。肿瘤与毗邻的小脑、脑干、血管和脑神经大部分区域存在蛛网膜层,术中要尽量保持蛛网膜的完整,便于沿蛛网膜间隙分离肿瘤与毗邻结构。中小型肿瘤(2.0~3.9 cm),可优先分离肿瘤周围的蛛网膜,边分离边切除肿瘤;大型肿瘤(≥4.0 cm),则需先行肿瘤内减压,待肿瘤壁松弛后,再分离肿瘤壁周围的神经与血管。辨别肿瘤与后组脑神经的关系,切开并游离覆盖在Ⅸ、Ⅹ、Ⅺ脑神经上的蛛网膜,再进行游离、保护;细心分离并用海绵、棉片或橡皮片妥善保护岩上静脉、小脑上动脉、滑车和三叉神经,避免牵拉肿瘤壁时,神经血管因过度牵张而损伤。早期分离时不要力求看到整个肿瘤,需采用边分离、边切除、再分离肿瘤的方法。
3.内听道后壁的磨除:中小型听神经瘤,可直接磨开内听道,寻找内听道内的面听神经,辨别其行走方向,依次分离切除肿瘤;大型肿瘤,需先行肿瘤内减压,待肿瘤壁松驰后,再磨开内听道后唇,寻找内听道端的面听神经,最后清理内听道口的肿瘤。电凝内听道背外侧的硬膜并半圆形切开,剥离、翻向内耳道。先用切割钻头,磨一个长10~12 mm的浅沟(不是很深、很窄的沟),接近内听道时改用小金钢钻磨头。内听道后壁磨开的宽度和深度都应达到能充分暴露内听道内肿瘤为止,术中可用剥离子来探查内听道磨除是否彻底,一般磨除6.0~7.5 mm。
4.肿瘤内切除:用取瘤镊或超声吸引器(cavitrom uitrasonic surgical aspirtor,CUSA)行瘤内分块吸除,尽可能使包膜变薄,边分离边切除。使用CUSA时切忌吸引力过大,以免将包膜吸住打穿。肿瘤内切除最重要的是保留肿瘤壁的完整性,以免损伤肿瘤壁周围尚未鉴别、分离出来的神经和血管。重复、间歇、分层去除中心部分的肿瘤组织,肿瘤内减压充分,使瘤壁松驰、塌陷。多模态辅助技术可实时监测肿瘤分离切除过程中是否影响到脑干,使肿瘤切除更安全。术中MRI可动态纠正神经导航的漂移误差,亦可明确肿瘤切除是否彻底。
5.肿瘤壁分离切除:当肿瘤内减压充分,瘤壁松弛、塌陷时,采用1 mm的吸引管,时刻保持术野清晰,将松动的肿瘤壁用持瘤钳向内听道方向、自外向肿瘤中心持续、柔和地提拉,以评估剩余肿瘤的范围和厚度,再决定是否需要进行必要的瘤内减压。仔细分离肿瘤表面的蛛网膜、瘤壁与周围组织的黏连,逐步分次、分块切除瘤壁。依次有序分离肿瘤下极、上极、肿瘤内侧的肿瘤壁,边分离边切除。分离肿瘤壁时要先易后难,即先从无组织黏连的瘤壁处分离,最后处理黏连紧密的部位。不要尝试在神经已经变得又宽又薄的部位做无效的肿瘤分离。分离肿瘤与面听神经时,需注意一手提肿瘤壁,一手提面神经周围的蛛网膜(图2A)。根据肿瘤壁与小脑、桥脑和桥臂的黏连程度将肿瘤壁的切除分为两种情况:(1)由内向外的方法,即先分离切除桥脑侧的肿瘤包膜,再处理内听道的肿瘤;(2)由外向内的方法,即先处理内听道内的肿瘤,再分离内侧肿瘤包膜。大部分肿瘤均可采用第一种方法将肿瘤全切除,但如果肿瘤包膜与桥脑黏连紧密,分离有困难时应改为由外向内的方法。其优点是切除内听道内的肿瘤后可清楚辨认内听道口的面听神经,可有的放矢地保护神经。
6.内听道内肿瘤的处理:内听道内的肿瘤最后清除(图2B)。面神经内听道段几乎不与肿瘤黏连,细心分离内听道内的肿瘤,寻找最内端的肿瘤边缘,将肿瘤从面听神经表面轻轻分离出来,避免盲目钳夹。术前尚有听力的患者,要自桥小脑角向内听道内的方向分离肿瘤,确保耳蜗神经不被撕裂;处理内听道内肿瘤时避免过多地使用双极电凝,保护好内听动脉。
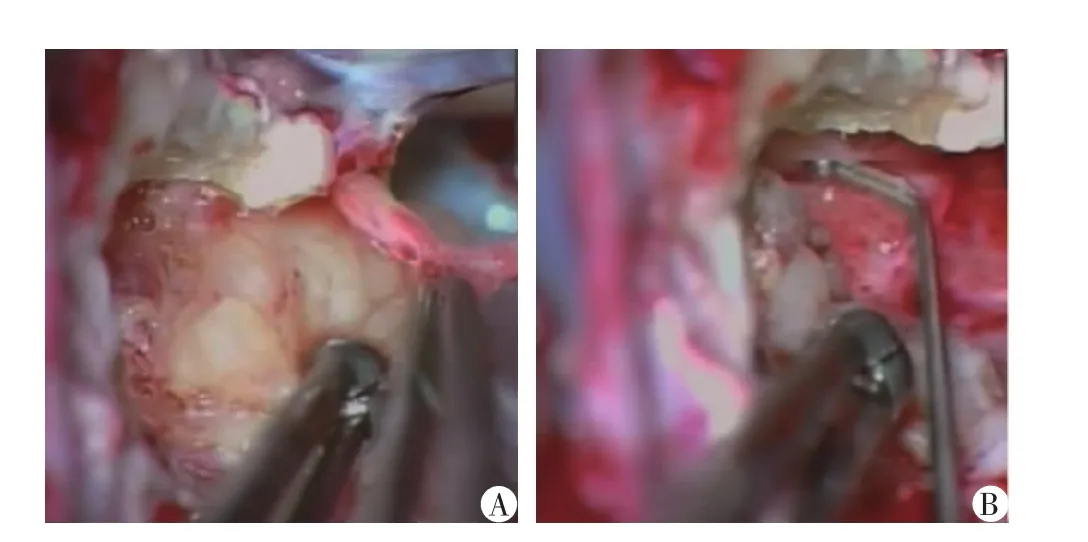
图2 经乙状窦后-内听道入路微创手术术中图像
7.面听神经的寻找和分离:面听神经脑池段受肿瘤的压迫而伸长、变薄、移位,需要在神经电生理监测下准确寻找与辨认,并定位其走行路径。无论肿瘤大小及位置如何,面听神经从脑干发出点和在内听道的位置恒定不变,可先从内听道端寻找与保护面听神经,待内听道端和脑干端分别分离出神经后,再向脑池段会师。在没有明确辨认出面听神经之前,不要轻易电凝或切割肿瘤壁。术中面神经未能保护者寻找面神经的内听道、脑干端,行面神经断端的端-端吻合,采用10-0的无损伤缝合线吻合2-3针,在吻合部位下方垫以明胶海绵做支撑,吻合口覆盖速止纱,再用脑蛋白胶粘合在一起。
8.血管的保护:术中除确认穿入瘤内的小动脉分支可电灼切除外,在没有确认进入瘤体的肿瘤表面血管均应予以分离并保护,不要处理囊壁上较粗的绕行静脉,否则将引起脑干的部分性缺血。分离小动脉和静脉时应采用细小吸引管,依次将供应肿瘤的分支血管电凝、离断,避免因吸引力过大将血管误吸。
四、术后评估标准
所有患者出院前和术后3个月均复查MRI增强扫描,判定肿瘤切除程度及骨瓣复位情况。面听神经功能均以术后3个月复查为评定标准。面神经功能评估,采用 House-Brackmann(H-B)分级;术后状况根据 Karnofsky(KPS)评分分为 3 类:优:KPS 评分80~100分,无任何神经功能障碍(不包括面听神经功能);良:KPS评分60~70分,遗留不同程度神经功能障碍,如面瘫、外展障碍、肢体共济运动障碍、构音或声嘶等;差:KPS评分为≤50分,有严重的神经功能障碍。
结 果
一、术后一般状况
术前表现为继发性三叉神经痛者3例,术后症状均消失;面部感觉减退或麻木者23例,术后均有不程度的缓解或消失。术后KPS评分统计:(1)优:841 例(94.82%);(2)良:41 例(4.62%);(3)差:5 例(0.56%)。术后共济运动障碍和颅内高压及脑干受压症状均得到改善。
二、肿瘤切除程度
术后常规复查MRI增强扫描(图3),肿瘤全切者841例,全切除率为94.8%。肿瘤次全切除者46例,其中32例肿瘤与面听神经黏连紧密,无法分离;余14例肿瘤嵌入脑干内,术中无法分离或分离脑干侧肿瘤时,出现生命体征的改变,若强行分离势必会损伤脑干,故仅行肿瘤次全切除。术前行伽玛刀治疗史者36例,仅19例(52.8%)做到肿瘤全切除,另17例均行次全切除。

图3 经乙状窦后-内听道入路微创手术术后复查增强MRI
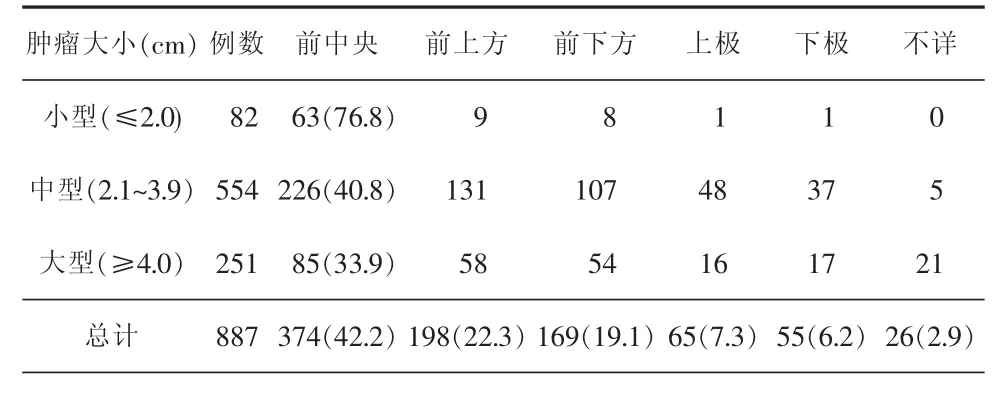
表1 听神经瘤大小与面神经位置的关系[例(%)]
三、面神经解剖及功能保留
术中面神经解剖保留者832例(93.7%);解剖未能保留者55例,其中16例术中行面神经端-端吻合,3例术后行面神经移植,15例因面神经与肿瘤黏连极紧密、神经已发生变性而无法保留,另21例因面神经被肿瘤侵袭或面神经被肿瘤包裹,无法辨认(表1)。肿瘤切除3个月后复查,按H-B分级进行面神经功能评估,面神经功能Ⅰ~Ⅱ级695例(78.4%),Ⅲ~Ⅳ级 176例 (19.8%),Ⅴ级 16例(1.8%)。
四、术后并发症
术后并发脑干水肿者21例,脑脊液漏、颅内感染者5例,皮下积液者12例,短暂性外展、后组颅神经功能障碍者各11例,颅内积气者13例,均经对症处理后恢复。并发脑干和小脑挫伤后出血、梗塞后出血者共13例,其中3例术后成为植物状态,2例死亡。
讨 论
一、听神经瘤治疗方法和时机的选择
大型听神经瘤选择微创显微手术治疗已成为共识,中小型听神经瘤的最佳治疗方案尚存有争议。伽玛刀治疗后肿瘤的体积在一定时间内会缩小,但很少有报道肿瘤会消失,肿瘤的平均控制率为92.2%[5]。伽玛刀治疗后肿瘤质地变硬,肿瘤黏连神经血管结构的风险会增加,同时放射也会导致神经变性,从而增大手术治疗难度[6]。Nonaka等[6]报道39例经立体定向放射治疗失败后再手术的经验,术中发现肿瘤纤维化、囊肿形成,囊液呈棕黄色,肿瘤壁变成紫色。其中肿瘤壁与颅神经、血管和脑干严重黏连占69.2%。有文献报道,听神经瘤随访观察期间有丧失听力的风险,甚至在肿瘤生长的稳定期,亦有听力丧失的风险[7]。Carlson等[8]报道了642例听神经瘤采用立体定向治疗、随访观察和显微手术治疗,平均随访间隔时间为7.7年,发现3组患者的生活质量差异很小,并主张若发现肿瘤明确生长或有顽固性症状,应积极手术治疗。Paldor等[9]回顾性分析4000余例听神经瘤,随访1~3年,发现约有1/3的患者肿瘤生长,随访5年有1/2的患者肿瘤生长,而且肿瘤的大小和位置不能预测。总之,该类型的肿瘤是典型并生长缓慢的,但其生长速率是不规则的,即使在同一个患者的不同时期,其生长速率也不同。笔者通过887例微创手术治疗的成功经验,认为早期微创手术才是听神经瘤最佳、最正确的治疗方案。
二、肿瘤切除的方法与技巧
(一)切除的原则
要实现听神经瘤全切除和神经功能保留的完美统一,仍是一门值得探寻的学问。肿瘤切除过程中,需先辨别面听神经行走方向,始终在肿瘤与脑干、小脑和颅神经及血管之间的界面分离肿瘤壁,最后全切除内听口和内听道内的肿瘤。
1.肿瘤内减压应充分:充分地肿瘤内减压,可解除肿瘤对周围神经血管的牵张,便于分离肿瘤壁上的神经血管。但要注意保留肿瘤壁的完整性,避免穿透肿瘤壁而误伤神经。对于高度血管化和质地较硬的肿瘤,应用激光辅助是安全的,有利于肿瘤切除[10]。
2.瘤内充分减压的标准:肿瘤减压充分后,瘤体会塌陷,瘤壁即松动,脑搏动将会促使肿瘤组织自然推出;如黏连仍紧,提示瘤内或囊内减压不充分,仍需进一步行肿瘤内切除。
(二)肿瘤切除方法与技巧
熟练的显微外科技术,可借助于术中神经监测的引导,是提高听神经瘤预后效果的关键[11]。
1.大型肿瘤切除方法:先行瘤内切除肿瘤主体,瘤内充分切除减压后,后磨除内听道后壁,辨明面听神经的走行方向,再沿肿瘤与脑干、小脑之间的蛛网膜界面悉心分离切除,最后切除内耳道内肿瘤,以避免肿瘤的重力作用牵拉面神经造成损伤。先找到不与肿瘤黏连的面神经脑干端,证实后沿着其走行方向逐步锐性分离,是获得解剖保留面神经的有效方法。
大型肿瘤由于内听道口不易显露,需优先行肿瘤充分减压,瘤壁塌陷后,才有机会去寻找面神经的脑干端。面听神经的内听道和脑干端均已证实并分离出来后,沿着其走行方向采用顺行和逆行相结合的方法逐步分离神经与肿瘤之间的黏连,分块全切除之。术前若能通过影像技术辨别神经与肿瘤的关系,术中就可以做到心中有数,有目的地去寻找和保护相关的神经。盲目地从脑池段分离面神经是危险的,因为肿瘤的挤压使面神经移位变形,并与肿瘤黏连紧密,面听神经之间的正常解剖关系已经紊乱,很容易造成损伤。若肿瘤与毗邻的神经或血管黏连紧密无法做到全切除,也要尽可能地清除肿瘤体积,因为肿瘤的体积与生长速度密切相关,残留体积越大,肿瘤生长越快[12]。
2.中小型肿瘤切除:先磨开内听道后壁辨清面听神经走向后,依次分块切除肿瘤、肿瘤壁。磨开内听道清除部分内听道内的肿瘤是为了寻找面听神经的内听道端,明确辨认清楚听神经的走行方向后,才能依次分离桥脑小脑角池内的肿瘤部分的瘤壁并切除肿瘤,这有利于下一步的神经与肿瘤的分离。最后清除内听道口的肿瘤,以免肿瘤的重力作用牵拉面神经造成损伤。
3.肿瘤壁的分离与切除:分离肿瘤壁时应保持肿瘤壁的完整,采用锐性与钝性相结合的分离方法,由神经相对正常区到异常区沿着神经的轴向分离。钝性分离无黏连的肿瘤部分,遇黏连部分的肿瘤壁则采用锐性分离法。脑干侧肿瘤壁的分离切除是难点,避免用尖锐的手术器械直接接触、分离脑干组织。可采用小明胶海绵棉片轻轻沿肿瘤包膜将脑干推开。分离神经与肿瘤壁时,应牵拉肿瘤而不是神经,即听神经瘤手术的原则是将肿瘤从神经组织上分离出来,而不是将神经从肿瘤上剥离。肿瘤壁分离时避免电凝,尤其是面神经与肿瘤黏连较紧密时,避免由于电凝的热损伤而间接损伤面听神经,对保证术后面听神经的血供也是有益的。
4.内听道内肿瘤的切除:肿瘤在内耳道口与硬脑膜紧密黏连,通常最后切除内耳道内肿瘤,以免肿瘤的重力作用牵拉面神经造成损伤。因此,内听道内肿瘤的切除首先取决于内听道后壁的充分磨除。磨开内听道后壁后,纵行切开内听道内硬膜,即可直视切除内听道内肿瘤,寻找最内端的肿瘤边缘。面神经内听道段几乎不与肿瘤黏连,沿面神经与肿瘤包膜的界面,用剥离子将内听道内残留的肿瘤自面神经表面轻轻剥下。为了切除内听道内肿瘤,且又能保护面听神经,术中应注意以下几点:(1)磨除内听道后壁时应尽量多冲水,以免热传导损伤面神经。(2)磨除内听道后壁的程度要适当:磨除不足,显露内听道内的肿瘤不充分;过分磨除,可能损害外侧半规管,并增加脑脊液鼻漏的危险。(3)由于肿瘤的压迫,在近内耳门处面神经可被压扁、拉长,并被挤向不同方向,常将面神经推挤而在内听道口的前缘上形成一个角度,有时与肿瘤壁难以区别,面神经在该部位最易受损伤。因此,在处理内听道口肿瘤时,要避免不恰当地挤压面神经。(4)术中应保留内听动脉,处理内听道内肿瘤时不要轻易使用双极电凝,尤其是面神经与肿瘤黏连较紧密时,这对保证其血供是有益的。内听动脉的保留与耳蜗神经的保留一样重要,是听力保留的先决条件,亦不要盲目钳夹致面听神经继发性损害。(5)内听道内肿瘤与面听神经间往往存在间隙,充分利用这一间隙,用显微剥离子器探入内听道肿瘤的外侧轻轻推移,借助吸引器的力量可将肿瘤从内听道内完整分离。若剥离出的肿瘤有完全的光滑面,表明肿瘤无破碎且不会原位残留。剥离过程中若肿瘤破碎,可用刮匙将面神经与内听道后壁间的肿瘤彻底刮除。(6)内听道开口处的硬脑膜常常与肿瘤、神经形成黏连,不能勉强分出面神经与肿瘤的界面,使用显微刮匙分层剥离内听道内肿瘤,可将内听道的肿瘤切除。(7)当肿瘤与面神经黏连紧密时采用钝性或锐性相结合的方法沿内听道纵轴分离,可防止面神经的进一步损伤。
(三)肿瘤切除技巧
1.显露桥小脑角应循序渐进:一方面要尽所能地减轻小脑组织的张力,包括放出枕大池的脑脊液,有脑积水的患者术前行分流术或术中切开硬脑膜前行脑室引流术等。另一方面,显露桥小脑角时要逐渐用棉片推开小脑组织,使小脑组织对小脑外侧的压迫有一个适应的过程。手术中切忌为了快速显露肿瘤组织而盲目地用脑压板强行推开小脑组织,忽视这一点,可造成术后严重的小脑水肿。
2.肿瘤附着处的双向分离:听神经瘤起源于内听道开口处附近前庭神经上神经膜细胞和少突胶质细胞间的移行区,肿瘤常压迫推挤近内耳门的面神经,面神经可被压扁、拉长,勉强由内向外分离容易损伤面神经。缩小肿瘤体积后,应先将内听道内肿瘤剔出,然后充分利用肿瘤与神经间的界面,从内、外两个方向向肿瘤附着处分离,锐性分离肿瘤附着部位与面神经的黏连。
3.分离技巧:分离肿瘤应钝性分离和锐性分离相结合,在锐性剪开听神经瘤周围的蛛网膜后,在面神经与肿瘤间尚有肿瘤的供血动脉,应将其凝断,再钝性分离面神经,以免对小血管的牵拉可能导致的面神经损伤。分离过程中牵拉肿瘤的方向应尽可能顺行神经纤维的走行方向,牵引力量应柔和,避免拉断神经纤维。
4.肿瘤切除技巧:保留面神经的关键是先行包膜内切除肿瘤主体,脑压板不要强行牵拉小脑,以避免间接牵拉面神经。需强调的是脑压板的作用是扶持并保护小脑半球,而不是牵拉小脑进行显露。切除肿瘤下极内侧囊壁时,注意寻找从四脑室侧孔突出至蛛网膜下腔的脉络丛,面神经根部即位于脉络丛的下外侧,再用神经监测仪刺激加以证实,之后将肿瘤囊壁向外侧翻转分离并分块切除,面神经起始段位置固定,且不与肿瘤囊壁黏连。
5.肿瘤全切除与神经功能保留间的合理取舍:实现肿瘤的全切除和神经功能的保留一直是听神经瘤手术追求的目的。但是有些肿瘤与神经间黏连紧密,难以解剖出肿瘤与神经间的界面,如强行切除肿瘤,可能导致面神经离断。大型听神经瘤,由于肿瘤黏连神经,术中为了保护面神经,为了减少新的神经功能障碍的风险,对黏附在神经上的、残留的肿瘤壁选择放弃全切除,而残留一部分肿瘤壁是值得的。Sammi是公认的听神经瘤手术经验丰富的神经外科医生,其报道的听神经瘤全切率为98%[13]。这意味着即使是技术娴熟的医生,术后仍有近2%的听神经瘤患者将长期面临肿瘤复发的风险。因此,应在保留面神经功能的前提下,实现肿瘤切除的最大化[14]。
6.神经内镜辅助:神经内镜可弥补显微镜对内听道口、脑干侧方的视角暴露缺陷,有助于术中对面神经内听道、脑干端的辨认与寻找。利用神经内镜经内听道口与面神经及前庭蜗神经的间隙观察内听道内结构。在某些小型、内侧型听神经瘤病例中可尝试不磨除内听道后壁,在神经内镜下完成对内听道内肿瘤的完全切除。目前,国内外已有这方面的经验报道,这也是我们今后工作的努力方向[15]。
综上所述,微创显微手术处理听神经瘤,能明显提高肿瘤的全切除率以及手术的安全性。熟练掌握听神经瘤的显微手术技巧是提高肿瘤全切除、面神经解剖和功能保护率的关键。
[1] Li H,Wang L,Hao S,et al.Identification of the facial nerve in relation to vestibular schwannoma using preoperative diffusion tensor tractography and intraoperativetractography-integrated neuronavigation system[J].World Neurosurg,2017,107:669-677.
[2] Borghei-Razavi H,Darvish O,Schick U.Disabling veaigo and tinnitus caused by intrameatal compression of the anterior inferior cerebellar artery on the vestibulocochlear nerve:a case repon,surgical considerations,and review of the literature[J].J Neural Surg Rep,2014,75(1):e47-e51.
[3] Taddei G,Marrelli A,Trovarelli D,et al.Facial functional outcome in monitored versus not-monitored patients in vestibular schwannomas surgery[J].Asian J Neurosurg,2016,11(4):402-406.
[4] Zhang Y,Chen Y,Zou Y,et al.Facial nerve preservation with preoperative identification and intraoperative monitoring in large vestibular schwannoma surgery[J].Acta Neurochir(Wien),2013,155(10):1857-1862.
[5] Pannullo SC,Fraser JF,Molitemo J,etal.Stereotactic radiosurgery:a meta-analysis of current therapeutic applications in neuro-oncologic disease[J].J Neurooncol,2011,103(1):1-17.
[6] Nonaka Y,Fukushima T,Watanabe K,etal.Surgical management of vestibular schwannomas after failed radiation treatment[J].Neurosurg Rev,2016,39(2):303-312.
[7] Hajioff D,Raut VV,Walsh RM,et al.Conservative management of vestibular schwannomas:third review of a 10-year prospective study[J].Clin Otolaryngol,2008,33(3):255-259.
[8] Carlson ML,Tveiten OV,Driscoll CL,et al.Long-term quality of life in patients with vestibular schwannoma:an international multicenter cross-sectional study comparing microsurgery,stereotactic radiosurgery,observation,and nontumor controls[J].J Neurosurg,2015,122(4):833-842.
[9] PaldorI,Chen AS,Kaye AH.Growth rate ofvestibular schwannoma[J].J Clin Neurosci,2016,32:1-8.
[10] Mastronardi L,Cacciotti G,Scipio ED,et al.Safety and usefulness of flexible hand-held laser fibers in microsurgical removal of acoustic neuromas (vestibular schwannomas)[J].Clin Neurol Neurosurg,2016,145:35-40.
[11] HuangX,Xu J,Xu M,etal.Functionaloutcomeand complications after the microsurgical removal of giant vestibular schwannomas via the retrosigmoid approach:a retrospective review of 16-year experience in a single hospital[J].BMC Neurol,2017,17(1):18.
[12] Tomita Y,Tosaka M,Aihara M,et al.Growth of primary and remnant vestibular schwannomas:a three-year follow-up study[J].World Neurosurg,2015,83(6):937-944.
[13] Samii M,Gerganov V,Samii A.Improved preservation of hearing and facial nerve function in vestibular schwannoma surgery via theretrosigmoid approach in a seriesof200 patients[J].J Neurosurg,2006,105(4):527-535.
[14] Jacob JT,Carlson ML,Driscoll CL,et al.Volumetric analysis of tumor control following subtotal and near‐total resection of vestibular schwannoma[J].Laryngoscope,2016,126(8):1877-1882.
[15] Pieper DR.The endoscopic approach to vestibular schwannomas and posterolateral skull base pathology[J].Otolaryngol Clin North Am,2012,45(2):439-454.

