抗阻力运动促进衰老的心功能和心肌线粒体重构
徐席斌,刘晨涛
(1.咸阳师范学院 体育学院,陕西 咸阳 712000;2.西北大学 体育教研部,陕西 西安 710069)
目前老龄化社会的出现,以及生活压力增加、生活节奏加快使衰老的问题备受关注,预防衰老和延缓衰老是近几年生命科学的研究热点。衰老的发生发展过程与线粒体功能异常有关[1-2]。衰老的线粒体理论认为,活性氧与细胞随年龄的增长而恶化有密切关系,而线粒体是活性氧的主要产生场所[3]。在研究衰老的预防和延缓中,药物干预仍是主流,但其副作用和局限性共存。运动干预抗衰老因其经济性、安全性和对机体的积极作用,使得近年来随着研究的不断深入[4-6]。目前,对于运动改善心肌线粒体功能预防衰老的报道较少,本研究选择抗阻力运动作为干预手段,观测抗阻运动对心肌线粒体结构和功能的影响,并探讨其可能的分子机制。
1 材料和方法
1.1 实验动物及分组
30只雄性SD大鼠,其中青年大鼠(2月龄,10只)和老年鼠(24月龄,20只),购自西安交大医学动物中心。将老年鼠随机分为2组: 老年对照组(elderly control group, e-Ctrl,n=10)和老年抗阻力运动组(elderly resistance training group, e-RT,n=10)。青年鼠作为青年对照组(young control group, y-Ctrl,n=10)。各组大鼠每天自由摄食饮水。
1.2 运动方案
参照Bedford等[7]的方法进行老年抗阻力负重跑台运动。大鼠背部负重为自体重的30%,跑台速度15m/min,无坡度。每次训练10min,间歇2min,每天6次,每周6天,共8周。
1.3 血流动力学指标检测
大鼠称重麻醉后,采用RM6240多通道生理信号采集处理系统采集信号并记录血流动力学各项指标变化。
1.4 取 材
测试完血流动力学后,立即处死取心脏,对心脏称量并计算心系数。
1.5 H&E染色
将在4%(体积分数)中性甲醛固定液中固定的心脏组织取出,切取需要观察部位后,依次通过浓度梯度为 70%,80%,90%,95%,100%Ⅰ,100%Ⅱ的酒精进行脱水,脱水完成后,经氯仿透明 8h后,置于石蜡中脱氯仿,最后经石蜡包埋。石蜡经5μm切片后,用二甲苯及酒精脱蜡脱水,苏木精染色8min,伊红复染 5min,树胶封片。光镜下进行观察,拍片。
1.6 Masson染色
石蜡切片用Masson复合染色液染色5min,经0.2%(体积分数)醋酸水溶液稍洗后置于5%(体积分数)磷钨酸10min,洗涤2次,苯胺蓝浸染5min,洗涤2次后脱水透明封片,光镜下进行观察,拍片。
1.7 超微结构观察
在低温下切取左心室肌组织,迅速固定。经梯度漂洗、脱水后用Epon812包埋,进行超薄50~60nm切片,醋酸铀柠檬酸铅双染,日立 H-7650透射电镜观察,拍摄。
1.8 Western Blot
采用BCA蛋白定量试剂盒对心肌组织实施总蛋白浓度测定。将定量后的总蛋白用10%(体积分数)SDS-PAGE分离,NC膜进行转膜,3%(体积分数)BSA封闭45min,孵育一抗Anti-PGC1 alpha 抗体(1∶1 000),Anti-SIRT1抗体(1∶800), Anti-AMPK alpha 1(1∶600),Anti-AMPK alpha 2(1∶1 000),24℃过夜。复温1h后TBST洗膜3次, 3min/次。用山羊抗兔的二抗(1∶10 000)室温摇床孵育1h,TBST洗膜3次, 3min/次,ECL发光。GAPDH(1∶5 000)作为内参。用Quantity One4.62软件分析并计算蛋白表达量变化。
1.9 图像处理、数据统计与分析
实验数据均采用平均数±标准偏差(x±SD)表示用SPSS17.0统计软件对实验数据进行统计分析,P<0.05表示差异显著,P<0.01表示差异极显著。采用 GraphPad Prism 6.0软件作图。
2 结 果
2.1 抗阻力运动提高衰老的心功能
结果显示,与e-Ctrl组相比,抗阻力运动显著提高了老年鼠的心功能(P<0.01)。与y-Ctrl组相比,老年鼠的LVSP(P<0.01),LVEDP(P<0.01),+dp/dtmax(P<0.01),-dp/dtmax(P<0.01)等血流动力学参数都显著增加。而与e-Ctrl组相比,抗阻力运动降低了老年鼠的LVSP(P<0.05),LVEDP(P<0.01),+dp/dtmax(P<0.05),-dp/dtmax(P<0.05)等血流动力学参数,有统计学差异(见表1)。

表1 抗阻力运动对衰老心功能的影响Tab.1 The effect of resistance training on aged cardiac function
*P<0.05 与y-Ctrl组比较;**P<0.01 与y-Ctrl组比较;#P<0.05 与e-Ctrl组比较;##P<0.01 与e-Ctrl组比较。
2.2 抗阻力运动对衰老的心肌组织结构的影响
对心肌纤维的结构观察发现,y-Ctrl组大鼠心肌纤维呈整齐排列,心肌细胞结构完整且分布比较紧密(图1a)。而e-Ctrl组大鼠的心肌细胞形态结构改变,心肌细胞断裂,排列杂乱无章,且心肌细胞分布比较稀疏(图1b)。老年组大鼠经抗阻力运动后,显示心肌纤维排列较为整齐且分布较为紧密,体积也稍有增大(图1c)。心肌组织Masson染色结果显示,y-Ctrl组大鼠心肌组织结构完整,心肌细胞与胶原纤维交互分布(图1d)。而e-Ctrl组大鼠心肌组织发生损伤,结构遭受破坏,大量心肌细胞坏死,增加的胶原纤维呈条索状,分别包绕心肌束、部分胶原纤维融合呈深蓝色,表明了胶原纤维过度增生(图1e)。e-RT组大鼠心肌细胞明显增多,胶原纤维显著减少,表明抗阻力运动可改善衰老的心肌组织的结构(图1f)。

a-c: H&E染色结果,苏木素复染后细胞核呈紫色,伊红染后细胞质为红色。d-f: Masson染色结果,胶原纤维由苯胺蓝染胶原纤维变为蓝色,丽春红染心肌纤维为红色。a和d表示y-Ctrl组,b和e表示e-Ctrl组,c和f表示e-RT组。×400 图1 抗阻力运动对衰老的心肌组织结构的影响Fig.1 The effect of resistance training on aged myocardial structure
2.3 抗阻力运动重塑衰老的心肌线粒体结构
电镜下,y-Ctrl组大鼠心肌细胞具有正常的超微结构,闰盘结构规则无扩张现象,肌节明暗带清晰可见,线粒体形态呈带状排列,嵴清晰,细胞膜形态结构良好(图2a)。而e-Ctrl组大鼠的心肌细胞发生严重损伤,闰盘呈不规则排列且有扩张现象,肌节不完整,Z线的排列也出现不规则,线粒体形态结构破坏,嵴消失,空泡样形状增多,细胞膜也有损伤现象(图2b)。e-RT组大鼠心肌细胞形态结构属于基本正常,肌节也整齐排列,Z线规则,闰盘基本规则无扩张,线粒体数量增多,嵴清晰可见(图2c)。

a y-Ctrl组,b e-Ctrl组,c e-RT组。×30000 图2 抗阻力运动对衰老的心肌超微结构的影响Fig.2 The effect of resistance training on aged myocardial ultrastructure
2.4 抗阻力运动重塑衰老的心肌线粒体功能
与y-Ctrl组相比,e-Ctrl组PGC1α的表达显著下降(P<0.01)。抗阻力活动可以明显提高衰老诱导的PGC1α表达的降低(图3a,P<0.05)。与y-Ctrl组相比,e-Ctrl组SIRT1的表达显著下降(P<0.01)。则抗阻力活动也可明显提高衰老诱导的SIRT1表达的降低(图3b,P<0.01)。与y-Ctrl组相比,e-Ctrl组AMPKα1的表达显著下降(P<0.01)。e-RT组AMPKα1的表达也显著提高(图3c,P<0.01)。衰老诱导AMPKα2的表达显著降低(P<0.01),而抗阻力运动可以显著缓解衰老诱导的AMPKα2表达的降低(图3d,P<0.01)。
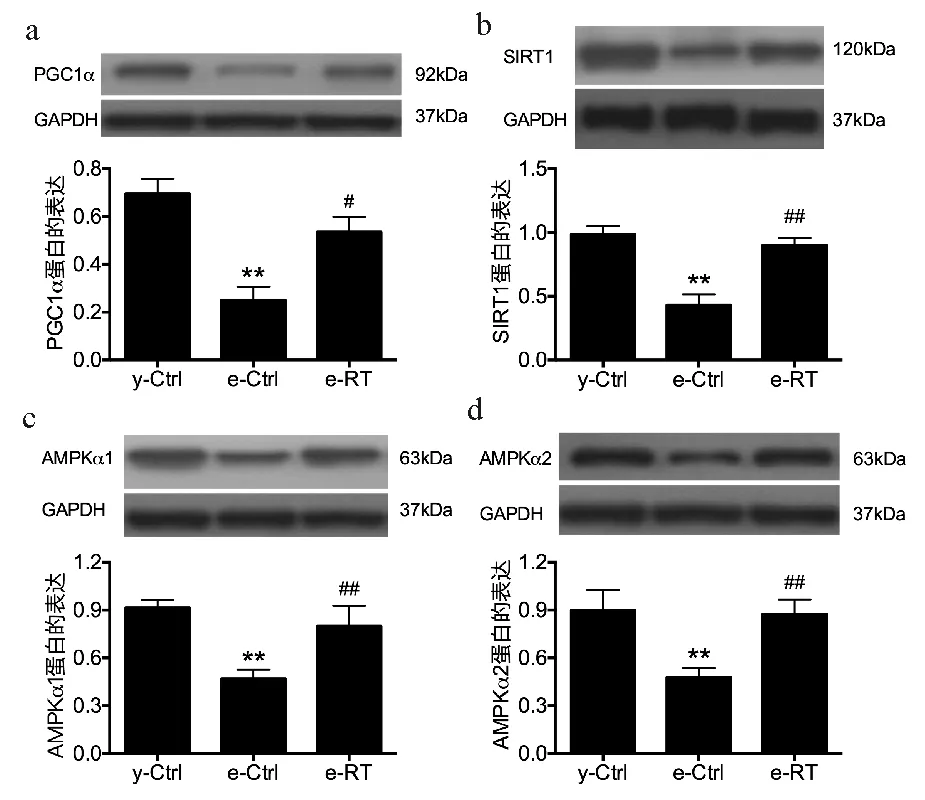
**P<0.01 与y-Ctrl组比较;#P<0.05 与e-Ctrl组比较;##P<0.01 与e-Ctrl组比较 图3 抗阻力运动对衰老的心肌线粒体功能的影响Fig.3 The effect of resistance training on aged myocardial mitochondrial function
3 讨 论
随着年龄增长,机体机能逐渐下降,主要表现为进行性衰老过程,心脏结构发生异常变化,导致射血功能降低,血管也发生退行性变化[8-10]。研究表明,有氧运动可以降低老年大鼠的收缩压,但并不能低至青年大鼠的收缩压状态[11]。抗阻力运动不仅可以提高老年大鼠的心系数,而且降低老年大鼠的收缩压和舒张压。这可能与抗阻力运动降低老年大鼠心肌的胶原纤维沉积有密切的关系。胶原和淀粉样蛋白的沉积,会导致动脉粥样硬化样斑块,舒缩功能障碍,血管的顺应性下降[11]。本研究的心肌细胞形态学观察也表明,老年大鼠的心肌细胞大量坏死严重,分布稀疏,且被大量的胶原纤维包裹。导致心功能下降。而8周的抗阻力运动改善心肌细胞的结构,缓解其大量坏死的状态,且胶原纤维的含量也被降低。长期的抗阻力运动可以使心血管系统产生变化;提高心肌收缩能力,增强泵血功能。
心肌线粒体的超微结构和亚细胞定位会随着年龄的增加发生显著的改变。衰老的心肌线粒体出现形态的扩大且变圆,基质空泡化,嵴变短甚至消失,而抗阻力运动可以改善这种由于衰老引起的心肌线粒体超微结构的异常。其可能与抗阻力运动可以使心肌更快速地排出衰老诱导的有害代谢产物的累积,保护线粒体的结构和功能有关。
PGC1α是线粒体适应运动的一个重要调控蛋白,其不仅促进新线粒体的形成,还可以维持线粒体内蛋白质的稳态[12]。对22月龄小鼠的研究发现,PGC1α的过表达能够减轻骨骼肌线粒体功能紊乱[13]。此外,PGC1α敲除小鼠的未折叠蛋白反应机制损害[14],表明通过PGC1α可以修复或者移除受损的的线粒体蛋白[15]。因此,PGC1α不仅可以通过促进新线粒体蛋白的合成,还可以通过维持线粒体蛋白对应激的反应来调控线粒体蛋白稳态。本研究表明,抗阻力运动可以提高老年大鼠心肌中PGC1α的表达,表示抗阻力运动可能通过PGC1α维持老年大鼠心肌线粒体蛋白的稳态。SIRT1是Sirtuins家族成员之一,SIRT1的组蛋白去乙酰化酶的激活可以促进多种基因的表达,减轻衰老诱导的代谢紊乱[16]。长时间的运动可以增加SIRT1的表达,并且消除年轻人和老年人之间SIRT1表达的差异[17]。与我们的研究一致,抗阻力运动提高老年大鼠心肌SIRT1的表达,使其与青年大鼠心肌SIRT1的表达几乎一致。AMPK可以提高线粒体的生物合成,以此增加能量的产生,而失活的AMPK导致老年大鼠的线粒体含量降低[18]。随着年龄的增长,AMPK对运动等刺激的反映逐渐迟钝。有研究表明,经过5天的有氧运动,AMPK的活性在老年大鼠中依旧保持较低状态[19]。因此,这样迟钝的信号在老年大鼠中可能会限制线粒体蛋白的合成,并且导致有害的线粒体蛋白的累积。而本研究中表明,抗阻力运动可提高老年大鼠心肌AMPK的表达。其原因可能是长期抗阻力运动导致线粒体产生适应性,从而导致AMPK的表达增加。研究表明,SIRT1与PGC1α共定位于线粒体[20],似乎是AMPK的下游,并且协调AMPK的活性[21]。因此,抗阻力运动可能通过AMPK/PGC1α/SIRT1信号通路改善老年大鼠的心肌线粒体功能。而进一步详细的机制有待下一步探索。
综上所述,长期抗阻力运动可以改善衰老的心功能,降低老年大鼠的收缩压和舒张压,保护心肌以及心肌线粒体结构的完整性,可能通过AMPK/PGC1α/SIRT1信号通路改善老年大鼠的心肌线粒体功能。抗阻力运动可作为老年人预防和延缓衰老的一种经济安全的方法。
参考文献:
[1] GUO X H. Antiaging effects of melatonin on the myocardial mitochondria of rats and associated mechanisms[J]. Mol Med Rep, 2017,15(1):403-410.
[2] GREDILLA R V, BOHR A,STEVNSNER T.Mitochondrial DNA repair and association with aging-an update[J].Exp Gerontol,2010,45(7-8):478-488.
[3] ALEXEYEV M F. Is there more to aging than mitochondrial DNA and reactive oxygen species[J].FEBS J, 2009,276(20):5768-5787.
[4] GLIEMANN L, NYBERG M, HELLSTEN Y.Effects of exercise training and resveratrol on vascular health in aging[J].Free Radic Biol Med, 2016,98:165-176.
[5] MEIRELES L C. Treadmill exercise induces selective changes in hippocampal histone acetylation during the aging process in rats[J]. Neurosci Lett, 2016,634:19-24.
[6] PETERSON C M, JOHANNSEN D L, RAVUSSIN E. Skeletal muscle mitochondria and aging: A review[J].J Aging Res, 2012. 2012:194821.
[7] BEDFORD T G. Maximum oxygen consumption of rats and its changes with various experimental procedures[J].Appl Physiol Respir Environ Exerc Physiol, 1979,47(6):1278-1283.
[8] MARUYAMA Y. Aging and arterial-cardiac interactions in the elderly[J]. Int J Cardiol, 2012,155(1):14-19.
[9] IRIGOYEN M C. Aging and baroreflex control of RSNA and heart rate in rats[J]. Am J Physiol Regul Integr Comp Physiol, 2000,279(5):R1865-1871.
[10] FRANKLIN S S. Hemodynamic patterns of age-related changes in blood pressure[J]. The Framingham Heart Study. Circulation, 1997,96(1):308-315.
[11] 刘晓东,石丽君,王德刚.运动对衰老大鼠心血管功能和肠系膜动脉反应性的影响[J].中国运动医学杂志,2013,32(4):316-322.
[12] ROGERS M A. Decline in VO2max with aging in master athletes and sedentary men[J].Appl Physiol (1985), 1990,68(5):2195-2199.
[13] WENZ T. Increased muscle PGC-1alpha expression protects from sarcopenia and metabolic disease during aging[J]. Proc Natl Acad Sci USA, 2009,106(48):20405-20410.
[14] WU J. The unfolded protein response mediates adaptation to exercise in skeletal muscle through a PGC-1alpha/ATF6alpha complex[J]. Cell Metab, 2011,13(2):160-169.
[15] BAKER B M, HAYNES C M.Mitochondrial protein quality control during biogenesis and aging[J]. Trends Biochem Sci, 2011,36(5):254-261.
[16] YOSHINO J. Nicotinamide mononucleotide, a key NAD(+) intermediate, treats the pathophysiology of diet-and age-induced diabetes in mice[J]. Cell Metab, 2011,14(4):528-536.
[17] LANZA I R. Endurance exercise as a countermeasure for aging[J]. Diabetes, 2008,57(11):2933-2942.
[18] LEE H Y. Targeted expression of catalase to mitochondria prevents age-associated reductions in mitochondrial function and insulin resistance[J]. Cell Metab, 2010,12(6):668-674.
[19] REZNICK R M. Aging-associated reductions in AMP-activated protein kinase activity and mitochondrial biogenesis[J].Cell Metab, 2007,5(2):151-156.
[20] AQUILANO K. Peroxisome proliferator-activated receptor gamma co-activator 1alpha (PGC-1alpha) and sirtuin 1 (SIRT1) reside in mitochondria: possible direct function in mitochondrial biogenesis[J].Biol Chem, 2010,285(28):21590-21599.
[21] CANTO C. Interdependence of AMPK and SIRT1 for metabolic adaptation to fasting and exercise in skeletal muscle[J].Cell Metab, 2010,11(3):213-219.

