Zn/Co-HMS催化氧化异戊醇生成异戊酸
胡乃宁,赵彬侠,刘林学,关文斌,韩锐暄,吴笑江,岳 能,贺贝贝,张小里
(西北大学 化工学院, 陕西 西安 710069)
异戊酸是生产香料异戊酸酯的重要原料,存在于缬草油、酒花油中[1]。传统工业生产常采用相转移催化法和分步氧化法的方式制备异戊酸,但这两种方法均需使用重金属盐,会对环境造成污染[2-3]。因此,选择绿色醇氧化合成途径具有重要意义。
以O2为氧化剂在催化剂作用下进行醇氧化具有原子利用率高,对环境无害的优点。Pd系、Ru系等均相催化剂用于醇类氧化已有报道,但此过程需在有机溶剂及高压条件下进行,对生产条件要求较高,同时均相催化剂存在难分离、回收等缺点[4]。近年来,Au/TiO2[5],Pd/SBA-16[6],Au/SBA-15[7],Ag-HMS[8],PdAu/Zn-Al LDHs/GO[9]等用于醇类氧化的非均相催化剂相继被报道,但此类催化剂的研究主要集中在贵重金属上,增加了生产成本。因此,研发出一种经济、高效的非均相催化剂对实际生产具有重要意义。
六方介孔硅分子筛(HMS)作为非均相反应催化剂的载体具有合成条件温和、比表面积大、热稳定性高等优点[10],白永燕等[11]综述了近年HMS的改性方法,认为向HMS骨架中引入金属,可大大提高HMS的催化性能。如Bhoware S S等[10]向HMS骨架中掺杂Co用于乙苯的氧化反应,Wang G J等[12]向HMS骨架中引入Zn用于噻吩的氧化反应, Saladino M L等[13]向HMS骨架中引入Ce用于乙醇部分氧化制乙醛中。另外,文献[14-15]用Ru和Fe改性HMS用于醇的氧化反应中取得较好反应效果,文献[16]中引入了Zn作为HMS改性剂,发现Zn能改变分子筛表面酸性并提高了产物选择性。由此可见,通过向分子筛骨架中引入金属(Co,Ce)与金属直接改性(Zn,Fe等)可改善分子筛的催化性能。因此,本文采用Zn为HMS金属改性剂并向其骨架中引入Co,制备了较为高效,绿色和经济的非均相金属改性HMS催化剂,并着重研究了Co和不同Zn源对异戊醇无溶剂催化氧化制备异戊酸的影响。
1 实 验
1.1 试 剂
十二胺(DDA),正硅酸乙酯(TEOS),硝酸锌[Zn(NO3)2·6H2O],硝酸钴[Co(NO3)2·6H2O],乙酸锌[Zn(CH3COO)2·2H2O],硫酸锌[ZnSO4·7H2O],氯化锌[ZnCl2],无水乙醇,异戊醇(以上均为分析纯)。
1.2 催化剂制备
HMS的制备:以TEOS为硅源,DDA为模板剂,将3.453g DDA溶于30mL乙醇和水的混合物中搅拌30min,再将16 mL TEOS和无水乙醇混合后加入到搅拌后的混合物中,45℃晶化室温老化后,再经离心、洗涤、干燥、550℃焙烧得到HMS。
Co-HMS(100)的制备:将DDA和0.208 1g硝酸钴溶于乙醇和水的混合物中,搅拌30min得到A液,将正硅酸乙酯与乙醇混合后滴加入A液中,在45℃晶化后再经干燥、焙烧得到掺杂Co的HMS,记为Co-HMS(100)(Si/Co物质的量比为100∶1)。
Zn/Co-HMS(100)的制备:将一定量的Co-HMS(100)分子筛溶解在硝酸锌溶液中浸渍12h,干燥后,再于550℃下焙烧4h即得到以硝酸锌为锌源的负载型催化剂(ZnO负载量为3%,质量分数),记为Zn/Co-HMS(100)-N。不同锌源催化剂的制备过程同上,以乙酸锌、硫酸锌、氯化锌为锌源制备的催化剂分别记为Zn/Co-HMS(100)-Ac,Zn/Co-HMS(100)-S,Zn/Co-HMS(100)-Cl。
1.3 催化剂表征
催化剂物相分析使用的XRD衍射仪为日本岛津公司生产的XRD-6100X,扫描速率10°/min,扫描范围2°~80°。N2吸附脱附比表面积与孔隙度分析仪为康塔AUT0S0RB-1C型全自动物理化学吸附分析仪,300℃预处理3h后进行分析测定。FT-IR分析仪为Nicolet 6700型红外光谱分析仪,波数测试范围为400cm-1~4 000cm-1。TG分析在TG209F3型热重分析仪上进行,升温速率为10℃/min,温度测试范围为35℃~800℃。TPD分析仪为美国康塔公司的CBT-1化学吸附仪,升温速率为10℃/min,扫描范围50℃~800℃。催化剂表面形貌分析使用的是日立TM3000电子显微镜。
1.4 催化剂性能评价
异戊醇催化氧化反应如下:将15mL异戊醇、一定量催化剂加入装有磁力搅拌与冷凝回流的三口烧瓶,以25mL/min的速率以鼓泡方式通入氧气,恒温下搅拌(600r/min)反应一定时间。产物在GC900A型气相色谱仪上进行检测分析(SE-30毛细管,FID检测,柱箱温度110℃,汽化及氢火焰温度均为200℃)。
2 结果与讨论
2.1 催化剂结构
2.1.1 XRD表征 图 1为催化剂的XRD谱图,从图1(a)可以看出催化剂HMS,Co-HMS(100)及4种Zn源催化剂均在2θ=2°~3°出现HMS的(100)特征衍射峰,保留了HMS的介孔结构[14, 17-18]。但是,从图1(a)中发现掺杂了Co之后HMS的(100)特征衍射峰从2θ=2.81°移至2.37°,这可能因为金属Co(dCo2+=74 pm,dCo3+=63 pm)的离子半径大于Si(dSi4+=42 pm)的离子半径,当Co部分取代Si后使材料的结构发生了变化,说明Co已成功进入到HMS骨架中。此外,4种Zn源催化剂的(100)特征衍射峰强度进一步降低,可能因为ZnO粒子进入到催化剂孔道内引起[19]。从图1(a),(b)中可以看出,负载后的催化剂未出现其他新峰,可能因为 Zn负载量少,且均匀分散于Co-HMS(100)表面及孔道中,因而在XRD中未出现衍射峰。

a HMS; b Co-HMS(100); c Zn/Co-HMS(100)-N; d Zn/Co-HMS(100)-Cl; e Zn/Co-HMS(100)-Ac; f Zn/Co-HMS(100)-S 图1 不同催化剂低角度(a)和高角度(b)XRD谱图Fig.1 XRD patterns of different samples (a) Low angle; (b) Wide angle
2.1.2 FT-IR表征 图2为催化剂的FT-IR谱图,可以看出掺杂Co和负载Zn后,催化剂的特征吸收振动峰基本不变,说明Co和Zn对HMS的结构未造成破坏,这与XRD得到的结论一致。其中,位于3 464cm-1和1 633cm-1的峰分别为载体上Si—OH伸缩振动吸收峰和吸附水—OH的弯曲振动吸收峰。位于1 085cm-1的峰为HMS中Si—O—Si的非对称伸缩振动吸收峰,可观察到吸收峰强度在掺杂Co之后明显下降。这可能是由于Co进入HMS骨架引起。位于802cm-1,468cm-1的峰分别对应Si—O—Si对称伸缩振动和弯曲振动峰[2, 21],位于966cm-1处的峰归属为HMS表面Si—OH的吸收峰。对比4种Zn源催化剂和Co-HMS(100)的红外吸收峰,峰形相似且未发现新峰,说明Zn均匀分布在载体表面,未出现团聚。
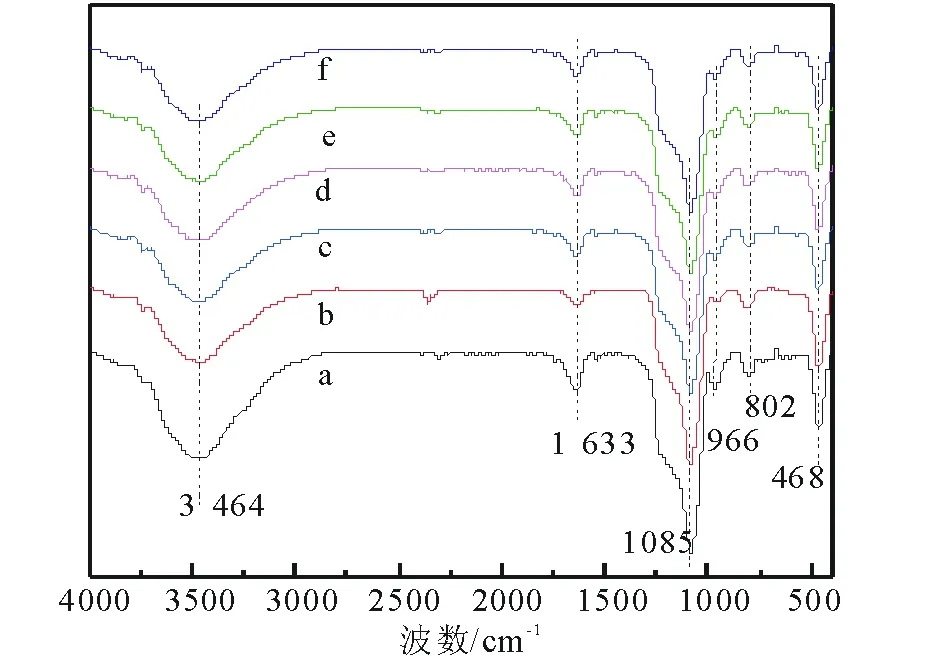
a HMS; b Co-HMS(100); c Zn/Co-HMS(100)-N; d Zn/Co-HMS(100)-Cl; e Zn/Co-HMS(100)-Ac; f Zn/Co-HMS(100)-S 图2 不同催化剂的FT-IR谱图Fig.2 The FT-IR spectrum of different catalysts
2.1.3 TG分析 对以硝酸锌[Zn(NO3)2·6H2O],乙酸锌[Zn(CH3COO)2·2H2O],硫酸锌[ZnSO4·7H2O],氯化锌[ZnCl2]为Zn源的催化剂未焙烧样品做了TG-DTG分析,如图3所示。
图3中4种Zn源催化剂的焙烧温度为550℃,均在50℃~100℃出现失重峰,此失重峰为样品脱除吸附水引起。其中,(a)在250℃的失重峰为ZnCl2溶于水后形成的配酸H{ZnCl2(OH)}分解所致,当温度升高至800℃未有失重峰出现,表明以ZnCl2为Zn源时,在焙烧温度下是以ZnCl2的形式存在于载体上[22];(b)中在200℃~300℃的失重峰为Zn(CH3COO)2·2H2O中结合水分解所致,430℃左右的失重峰为乙酸锌分解为ZnO,H2O和CO2所致,这表明以Zn(CH3COO)2·2H2O为Zn源时,在焙烧温度下是以ZnO的形式存在于载体上[23]。(c)中500℃~600℃为ZnSO4·7H2O中结合水的失重峰,740℃附近为硫酸锌分解失重峰,这表明以ZnSO4·7H2O为Zn源时,在焙烧温度下是以ZnSO4的形式存在于载体上[24]。(d)在100℃~200℃的失重峰为Zn(NO3)2·6H2O结合水和硝酸锌的分解峰,说明在焙烧之后是以ZnO的形式存在于载体上的[25]。

(a) Zn/Co-HMS(100)-Cl; (b) Zn/Co-HMS(100)-Ac; (c) Zn/Co-HMS(100)-S; (d) Zn/Co-HMS(100)-N 图3 不同催化剂的TG-DTG图谱Fig.3 TG-DTG spectrum of different catalysts
2.1.4 NH3-TPD酸性分析 图4是催化剂的NH3-TPD图谱,可知所有催化剂均在100℃~300℃和400℃~750℃出现了NH3脱附峰,分别对应弱酸位(L酸)和强酸位(B酸)[26]。对比a和b可知,Co-HMS(100)的弱酸含量几乎不变而强酸含量略有增加,对比c,d和b可知Zn/Co-HMS(100)-N和Zn/Co-HMS(100)-Ac的弱酸含量明显减小,而Zn/Co-HMS(100)-N的强酸含量略有增加,Zn/Co-HMS(100)-Ac的强酸含量略有减少。对比e,f和b发现,Zn/Co-HMS(100)-S和Zn/Co-HMS(100)-Cl的弱酸含量和强酸含量都大大增加。结合图3可以得出:550℃焙烧后,Zn以ZnO形式存在的催化剂Zn/Co-HMS(100)-N与Zn/Co-HMS(100)-Ac的NH3-TPD图谱曲线相似, Zn/Co-HMS(100)-N和Zn/Co-HMS(100)-Ac的弱酸含量相对Co-HMS(100)的弱酸含量减少,而Zn以ZnSO4和ZnCl2形式存在的催化剂Zn/Co-HMS(100)-S与Zn/Co-HMS(100)-Cl的弱酸含量较Co-HMS(100)的弱酸含量多。

a HMS; b Co-HMS(100); c Zn/Co-HMS(100)-N; d Zn/Co-HMS(100)-Ac; e Zn/Co-HMS(100)-S; f Zn/Co-HMS(100)-Cl 图4 不同催化剂的NH3-TPD图谱Fig.4 NH3-TPD spectrum of different catalysts
2.1.5 N2吸附脱附 图5是催化剂的N2吸附脱附等温线图谱。可以看出,所有样品的吸附附脱等温线均属于IV型等温线,且等温线形状相似,说明Co和Zn未对HMS的结构造成破坏,这与XRD及FT-IR得到的结论一致。图6是催化剂的孔径分布图。可以看出,Co-HMS(100)的孔径分布曲线右移,孔径增大;Zn/Co-HMS(100)-N 和Zn/Co-HMS(100)-Ac的孔径分布曲线相似。这可能是因为这两种催化剂焙烧后Zn的存在形式都是ZnO;Zn/Co-HMS(100)-S的孔径分布曲线左移,孔径减小,这可能是因为ZnSO4分子较大,进入催化剂孔道后占据较大空间所致[27]; Zn/Co-HMS(100)-Cl孔径分布曲线右移,这可能是因为ZnCl2堵塞小孔,小孔数量减小所致。表1为催化剂的结构参数,可以看出平均孔径的变化与孔径分布曲线的变化一致,催化剂的比表面积和总孔体积均随着Co掺杂和不同Zn源负载而下降。

图5 不同催化剂N2吸附脱附图谱Fig.5 N2 adsorption-desorption isotherms of different catalysts

a HMS; b Co-HMS (100); c Zn/Co-HMS (100)-N; d Zn/Co-HMS (100)-Ac; e Zn/Co-HMS (100)-S; f Zn/Co-HMS (100)-Cl 图6 不同催化剂孔径分布图谱Fig.6 The Pore size distribution of different catalysts
2.1.6 SEM形貌分析 为了探究催化剂的形貌对催化剂性能的影响,对4种Zn源催化剂做了SEM表征,如图 7所示。可以看出,催化剂Zn/Co-HMS(100)-N,Zn/Co-HMS(100)-Ac,Zn/Co-HMS(100)-S的SEM图相似,催化剂粒径相近,但Zn/Co-HMS(100)-N粒度较均匀。Zn/Co-HMS(100)-Cl与其他3种催化剂相比, 其粒径较大,面较粗糙,颗粒团聚现象较明显。在催化反应中,较小的催化剂粒径有利于催化剂积碳前驱体扩散[28],从而避免了催化剂积碳和失活。除此之外,较小的催化剂粒径也有利于反应物与产物传递,促进反应进行。

表1 不同催化剂的结构参数Tab.1 The structural parameters of different catalysts
表

a Zn/Co-HMS (100)-N; b Zn/Co-HMS (100)-Ac; c Zn/Co-HMS (100)-S; d Zn/Co-HMS (100)-Cl 图7 不同催化剂的SEM图Fig.7 SEM morphology micrograph of different catalysts
2.2 催化性能
表2中列出了不同催化剂在一定反应条件下的催化性能。其中,用X表示异戊醇的转化率,S表示异戊酸的选择性,Y表示异戊酸的收率(X=异戊醇的转化量/异戊醇的起始量,S=产物异戊酸的量/异戊醇的转化量,Y=产物异戊酸的量/异戊醇的起始量)。可以看出:Co-HMS(100)较HMS异戊醇的转化率和异戊酸的收率与选择性都有下降。Zn/Co-HMS(100)-N和Zn/Co-HMS(100)-Ac较Co-HMS(100)催化性能明显增加,
其中Zn/Co-HMS(100)-N表现出较好的催化活性,异戊醇的转化率、异戊酸的收率与选择性达到52.2%,26.9%和51.5%。而Zn/Co-HMS(100)-S和Zn/Co-HMS(100)-Cl较 Co-HMS(100)催化活性下降。催化剂的活性与催化剂的表面性质及孔道结构有关。强酸(B酸)为重要的活性位点,大多存在于孔道内[29];而弱酸(L酸)是催化剂发生积碳的重要原因[30]。因此,较多的强酸、较少的弱酸及合适的孔道结构有利于催化反应发生。催化剂Zn/Co-HMS(100)-N和Zn/Co-HMS(100)-Ac弱酸含量少,减少了积碳发生,而Zn/Co-HMS(100)-N具有较合适的孔径(图6)和较小的粒径(图7)有利于反应物和产物传递,因此Zn/Co-HMS(100)-N催化效果优于Zn/Co-HMS(100)-Ac。催化剂Zn/Co-HMS(100)-S和Zn/Co-HMS(100)-Cl几乎无催化活性,虽然催化剂Zn/Co-HMS(100)-Cl具有较大的孔径(表 1)和较多的强酸含量(表4),但其弱酸含量多、粒径大、催化剂团聚现象明显(图 7),导致催化剂积碳甚至失活,因此催化性能下降。除此之外,文中对反应的副产物进行了研究,如表 2所示, 催化剂Co-HMS异戊醛的选择性为23.5%,较HMS和其他四种负载型催化剂高,而Co-HMS中几乎不产生异戊酸异戊酯;催化剂Zn/Co-HMS(100)-N和 Zn/Co-HMS(100)-Ac异戊醛选择性分为6.7%和4.5%,低于HMS,而Zn/Co-HMS(100)-N和 Zn/Co-HMS(100)-Ac异戊酸异戊酯的选择性相对较高分别为13.6%和12.8%。Zn/Co-HMS(100)-S和Zn/Co-HMS(100)-Cl中几乎无异戊醛与异戊酸异戊酯生成。

表2 不同催化剂的催化性能Tab.2 Catalytic performance of different catalysts
注:反应条件为温度, 120℃; 异戊醇, 15mL; 催化剂, 0.5g;反应时间, 8h; O2, 25mL/min。
2.3 催化反应机理
为探究异戊醇催化氧化生成异戊酸的反应机理,做了以下5组实验:a 向体系中加入0.5 g HMS 不通入O2;b向体系中加入0.5 g HMS并通入O2;c 向体系中加入0.5 g Co-HMS(100)并通入O2;d向体系中加入0.5g Zn/Co-HMS(100)-N并通入O2;e向体系中加入少量水,0.5g Zn/Co-HMS(100)-N并通入O2反应结果如表 3所示。

表3 不同反应条件下异戊醇催化氧化效果Tab.3 The catalytic oxidation results of isoamyl alcohol under different reaction conditions
反应条件: 温度120℃; 异戊醇15mL; 催化剂0.5g;反应时间8h; O225mL/min。
可以看出,当反应体系中加入HMS不通入O2时,产物中未发现异戊酸和异戊醛;当反应体系中加入HMS并通入O2时,有少量异戊酸和异戊醛的产生;当反应体系中加入Co-HMS(100) 并通入O2时,发现产物中异戊醛的含量多于异戊酸的含量;反应体系中加入Zn/Co-HMS(100)-N 并通入O2时,发现异戊酸的含量较多且大于异戊醛的含量。综上所述,在异戊醇生成异戊酸的反应中Co能促进异戊醛生成,Co和Zn协同能促进异戊酸生成,O2在异戊醇生成异戊酸的整个过程都发挥了重要作用。文献[31-32]中研究发现有O2参与的羰基化合物制备中,氧气活化是反应的关键部分,过渡态金属如Cr,Co等具有未充满的价层d轨道能使O2激活,成为活化态氧。异戊醛中羰基CO的π键较δ键弱,易受到周围原子电子云的影响而断裂[33-34],Zn外层电子为4s23d10电子轨道全充满,电子云密度较大,会对CO的π键产生较大影响,使π键发生断裂。异戊醇及异戊醛分子结构特点及催化剂特性符合自由基反应历程,其可能的反应路线如图8所。
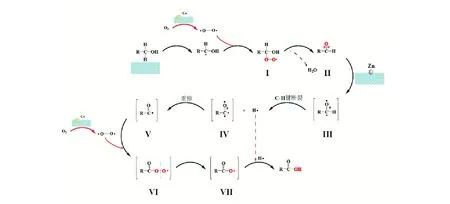
图8 Zn/Co-HMS(100)-N催化氧化异戊醇生成异戊酸反应机理(R=CH3CH(CH3)CH2)Fig.8 Reaction mechanism of isoamyl alcohol to isovaleric acid under Zn/Co-HMS(100)-N
第一步:Co原子激发产生的过氧自由基·O—O·与活化后的异戊醇生成中间体Ⅰ,中间体Ⅰ脱去1分子水生成异戊醛(Ⅱ)。反应第二步:异戊醛羰基中π键断裂生成中间体Ⅲ,Ⅲ中C—H易断裂生成中间体Ⅳ及H·,Ⅳ不稳定重排后生成中间体Ⅴ,Ⅴ与过氧自由基生成过氧酸Ⅵ,Ⅵ中脱去一个O·后得到中间体Ⅶ,Ⅶ与Ⅲ中产生的H·生成最终的异戊酸,Ⅵ中脱去的O·与下一轮反应中产生的O·生成·O—O·参与到反应中去。
由于自由基反应过程中有水产生,因此水会抑制自由基反应进行。如表3所示,向反应体系中加入少量水对提出的机理进行验证,可以看出添加水后,异戊醇的转化率,异戊酸的收率与选择性都减小,说明水抑制了反应进行,也佐证了该反应符合自由基机理。
3 结 论
本文研究了HMS,Co-HMS(100)及不同Zn源催化剂Zn/Co-HMS(100)-N,Zn/Co-HMS(100)-Ac,Zn/Co-HMS(100)-S和Zn/Co-HMS(100)-Cl用于异戊醇催化氧化制备异戊酸的反应效果。结果发现:不同Zn源催化剂均保留了载体的原有结构;焙烧后以ZnO存在的催化剂Zn/Co-HMS(100)-N。Zn/Co-HMS(100)-Ac具有较合适的比表面积,孔道结构及合适的酸含量及酸强度;焙烧后以ZnSO4和ZnCl2形式存在的催化剂Zn/Co-HMS(100)-S与Zn/Co-HMS(100)-Cl的弱酸含量增加。催化剂性能测试结果表明Zn/Co-HMS(100)-N较其他催化剂反应效果好,异戊醇的转化率、异戊酸的收率与选择性分别可以达到52.2%,26.9%和51.5%。而Zn/Co-HMS(100)-S和Zn/Co-HMS(100)-Cl几乎无催化活性。以Zn/Co-HMS(100)-N为催化剂,对异戊醇催化氧化生成异戊酸的反应机理进行了初步探讨,发现该反应符合自由基机理,催化剂的主要活性位点是Co与Zn,Co和Zn协同作用催化异戊醇生成异戊酸。
参考文献:
[1] 何优选, 李善吉. 香料异戊酸苄酯的绿色合成工艺研究[J]. 广州化工, 2010, 38(4): 96-97.
[2] WANG X, KAWANAMI H. Selective oxidation of alcohols to aldehydes and ketones over TiO2-supported gold nanoparticles in supercritical carbon dioxide with molecular oxygen[J]. Applied Catalysis A General, 2008, 349(1): 86-90.
[3] HADDADI H, KORANI E M, HAFSHEJANI S M, et al. Highly selective oxidation of sulfides to sulfones by H2O2catalyzed by porous capsules[J].Journal of Cluster Science, 2015, 26(6): 1-10.
[4] MA C Y, CHENG J, WANG H L, et al. Characteristics of Au/HMS catalysts for selective oxidation of benzyl alcohol to benzaldehyde[J]. Catalysis Today, 2010, 158(3-4): 246-251.
[5] ZHOU L, CHEN M, Wang Y, et al. Au/mesoporous-TiO2, as catalyst for the oxidation of alcohols to carboxylic acids with molecular oxygen in water[J]. Applied Catalysis A General, 2014, 475(1): 347-354.
[6] CHEN Y, LIM H, TANG Q, et al. Solvent-free aerobic oxidation of benzyl alcohol over Pd monometallic and Au-Pd bimetallic catalysts supported on SBA-16 mesoporous molecular sieves[J]. Applied Catalysis A General, 2010, 380(1-2): 55-65.
[7] MA C Y, DOU B J, LI J J, et al. Catalytic oxidation of benzyl alcohol on Au or Au-Pd nanoparticles confined in mesoporous silica[J]. Applied Catalysis B Environmental, 2009, 92(1): 202-208.
[8] JIA L, ZHANG S, GU F, et al. Highly selective gas-phase oxidation of benzyl alcohol to benzaldehyde over silver-containing hexagonal mesoporous silica[J]. Microporous & Mesoporous Materials, 2012, 149(1): 158-165.
[9] 马帅, 陈郑, 王家喜. 氧化石墨烯掺杂锌铝类水滑石负载钯金催化剂的制备及催化性能[J]. 化工进展, 2017,36(11): 4087-4092.
[10] BHOWARE S S, SHYLESH S, KAMBLE K R, et al. Cobalt-containing hexagonal mesoporous molecular sieves (Co-HMS): Synthesis, characterization and catalytic activity in the oxidation reaction of ethylbenzene[J]. Journal of Molecular Catalysis A Chemical, 2006, 255(1): 123-130.
[11] 白永燕, 陈平. 介孔材料HMS的改性及在催化反应中的应用[J]. 现代化工, 2016(10): 54-58.
[12] WANG G J, ZENG N. Preparation and catalytic properties of Zn-HMS molecular sieves[J]. Advanced Materials Research, 2012, 560-561: 300-304.
[13] SALADINO M L, MARTINO D F C, KRALEVA E, et al. Effect of the cerium loading on the HMS structure. Preparation, characterization and catalytic properties[J]. Catalysis Communications, 2013, 36(36): 10-15.
[14] 纪红兵, 钱宇, 王婷婷,等. 负载钌的HMS催化剂催化氧化醇[J]. 化工学报, 2006, 57(3): 577-581.
[15] 贾丽华, 张森, 宋贺,等. 铁改性HMS催化氧化苯甲醇合成苯甲醛[J]. 化工学报, 2009, 60(9): 2210-2214.
[16] 刘维桥, 雷卫宁, 尚通明,等. Zn对HZSM-5分子筛催化剂物化及甲醇芳构化反应性能的影响[J]. 化工进展, 2011, 30(9): 1967-1971.
[17] ZhANG P, ZHOU Y, FAN M, et al. Catalytic performance of PdCl2/Cu-HMS: Influence of hydrophobicity and structure of molecular sieves[J]. Applied Surface Science, 2014, 295(6): 50-53.
[18] PARSAFARD N, PEYROVI M H, RASHIDZADEH M. n-Heptane isomerization on a new kind of micro/mesoporous catalyst: Pt supported on HZSM-5/HMS[J]. Microporous & Mesoporous Materials, 2014, 200: 190-198.
[19] MATE V R, SHIRAI M, RODE C V. Heterogeneous Co3O4, catalyst for selective oxidation of aqueous veratryl alcohol using molecular oxygen[J]. Catalysis Communications, 2013, 33(9): 66-69.
[20] SELVARAJ M, LEE T G. t-Butylation of toluene with t-butyl alcohol over mesoporous Zn-Al-MCM-41 molecular sieves[J]. Microporous & Mesoporous Materials, 2005, 85(1): 59-74.
[21] ZHANG N, LI G, CHENG Z, et al. Rhodamine B immobilized on hollow Au-HMS material for naked-eye detection of Hg2+in aqueous media.[J]. Journal of Hazardous Materials, 2012, 229-230(43): 404-410.
[22] BI Y, WANG Y, CHEN X, et al. Methanol aromatization over HZSM-5 catalysts modified with different zinc salts[J]. Chinese Journal of Catalysis, 2014, 35(10): 1740-1751.
[23] 赵新宇, 李春忠, 郑柏存,等. 二水合醋酸锌热分解机理与动力学[J]. 华东理工大学学报, 1997,23(2):191-195.
[24] 李国强. 无机含氧酸及其盐热稳定性研究[J]. 西安建筑科技大学学报(自然科学版), 1997,29(1):69-73.
[25] 戴长文. 离子极化和硝酸盐热稳定性势标度[J]. 郑州大学学报(理学版), 1985,32(2):67-72.
[26] Jia A, Lou L L, Zhang C, et al. Selective oxidation of benzyl alcohol to benzaldehyde with hydrogen peroxide over alkali-treated ZSM-5 zeolite catalysts[J]. Journal of Molecular Catalysis A Chemical, 2009, 306(1-2):123-129.
[27] CANG R, LU B, LI X, et al. Iron-chloride ionic liquid immobilized on SBA-15 for solvent-free oxidation of benzyl alcohol to benzaldehyde with H2O2[J]. Chemical Engineering Science, 2015, 137: 268-275.
[28] RASOULI M, ATASHI H, MOHEBBI-KALHORI D, et al. Bifunctional Pt/Fe-ZSM-5 catalyst for xylene isomerization[J]. Journal of the Taiwan Institute of Chemical Engineers, 2017,78: 438-446.
[29] ZHAO Y X, BAMWENDA G R, GROTEN W A, et al. The chain mechanism in catalytic cracking: The kinetics of 2-methylpentane cracking[J]. Journal of Catalysis, 1993, 140(1): 243—261.
[30] BARZETTI T, SELLI E, MOSCOTTI D, et al. Pyridine and ammonia as probes for FTIR analysis of solid acid catalysts[J]. Journal of the Chemical Society Faraday Transactions, 1996, 92(8): 1401-1407.
[31] LIU P, DEGIRMENCI V, HENSEN E J M. Unraveling the synergy between gold nanoparticles and chromium-hydrotalcites in aerobic oxidation of alcohols[J]. Journal of Catalysis, 2014, 313(313): 80-91.
[32] BESSON M, GALLEZOT P. Selective oxidation of alcohols and aldehydes on metal catalysts[J]. Catalysis Today, 2000, 57(1): 127-141.
[33] 巨勇, 席婵娟, 赵国辉. 有机合成化学与路线设计[M]. 北京: 清华大学出版社, 2007:116-121.
[34] 陈治明. 有机合成原理及路线设计[M]. 北京: 化学工业出版社, 2010:50-58.

