NaCl胁迫对海滨木槿幼苗AsA-GSH循环的影响
孙 慧,吴 华,2,张 振,韩 榆,俞慈英,杜希华
(1. 山东师范大学 生命科学学院,山东省逆境植物重点实验室,山东 济南 250014;2. 中国农业科学院 烟草研究所,山东 青岛 266101;3. 浙江省舟山市农林科学研究院,浙江 定海 316000)
土壤盐渍化是全球性的生态问题。高盐逆境会对植物造成离子和渗透胁迫,引发氧化胁迫和营养亏缺。盐胁迫诱导产生的活性氧是造成细胞伤害的一个重要原因。在正常生理条件下,植物体内活性氧的产生和清除处于一种动态平衡状态。但在盐渍、干旱等逆境条件下,植物体内会产生大量的活性氧,引发细胞膜脂过氧化反应,影响细胞膜的完整性及各种酶的活性,使植物受害甚至死亡[1]。研究证实,抗坏血酸—谷胱甘肽循环(AsA-GSH cycle)系统是植物体内清除活性氧自由基的重要途径[2]。该循环途径中抗坏血酸过氧化物酶(ascorbate peroxidase,APX)和谷胱甘肽还原酶(glutathione reductase,GR),以及抗氧化剂抗坏血酸(AsA)和谷胱甘肽(GSH)能够有效地清除植物体内积累的活性氧,有助于提高植物的抗逆性。因此,可根据植物体内APX,GR等酶的活性和AsA,GSH等非酶物质含量的变化来衡量植物的抗逆性[3]。
海滨木槿Hibiscus hamabo为锦葵科Malvaceae木槿属Hibiscus落叶灌木或小乔木,主要分布于我国浙江定海、镇海、舟山岛西部及长山寺等,为浙江省珍稀濒危植物,具有耐盐碱、耐旱抗涝、耐土壤贫瘠等优良特性,花色艳丽,根系发达,对土壤的适应能力及抗风能力较强[4],既是沿海地区优良的堤岸防护林树种,也是宝贵的园林绿化树种。目前,关于海滨木槿的研究主要集中于形态特征、驯化栽培等方面[5],关于NaCl胁迫下海滨木槿生理响应方面的研究尚不多见,更未见有关NaCl胁迫对海滨木槿AsA-GSH循环影响的研究报道[6]。本研究设置了不同NaCl浓度梯度,对NaCl胁迫下不同时期海滨木槿幼苗AsA-GSH循环中各个组分进行了测定分析,分析了AsA-GSH循环参与调控海滨木槿耐盐的规律。
1 材料与方法
1.1 试验材料
海滨木槿种子由浙江省舟山市农林科学研究院提供,2013年11月采自舟山市定海区。以海滨木槿子叶期幼苗和早期幼苗为实验材料。
1.2 材料培养与处理
海滨木槿种子的预处理及萌发参照薄鹏飞等[7]的方法,于2014年6,7月分两批进行沙培。挑选饱满种子播于盛有细砂的塑料盆中,每天用清水浇灌1次,种子萌发后改用1/2 Hoagland营养液(pH 6.0)浇灌。一批待种子萌发长出2片子叶、第一片真叶尚未展开(子叶期幼苗);一批培养至具5~6片真叶(早期幼苗),进行盐处理。对照用1/2 Hoagland营养液浇灌,盐处理材料用含NaCl的1/2 Hoagland处理液浇灌,采用每12 h递增50 mmol·L-1NaCl的方式处理至终浓度分别为150和300 mmol·L-1。达到终浓度后,每天早晚各浇灌1次处理液,浇灌量为细砂持水量的2倍,以保持盐浓度的稳定。处理7~9 d后,分别取子叶期幼苗的子叶和早期幼苗的第2至第4位叶片,测定相关生理指标,每个处理重复3次。
1.3 试验方法
SOD(超氧化物歧化酶)活性的测定参照刘志礼等[8]的方法并稍作修改。取0.1 g叶片加入1.5 mL提取介质,4℃,15 000 rpm 离心 15 min,反应体系由 0.01 mL 酶液与 4mL 反应介质 (50 mmol·L-1PBS,pH 7.0;1 mmol·L-1EDTA;130 mmol·L-1Met;77.12 μmol·L-1NBT;80.2 μmol·L-1核黄素)组成,在 72 μmol·m-2·s-1日光灯下反应20 min,以不加酶液的体系为对照,测定560 nm处的吸光度值,以每分钟内NBT抑制光化还原50%为一个酶活单位(U)。
APX活性的测定按Nakano等[9]的方法。
GR活性的测定参照Foster等[10]的方法,稍加修改。酶提液同SOD,反应体系为0.15 mL酶液加入2.6 mL反应介质(50 mmol·L-1PBS,pH 7.0;1 mmol·L-1EDTA;5 mmol·L-1MgCl2),加 0.2 mL 1 mmol·L-1的 NADPH和0.05 mL 10 mmol·L-1GSSG,以2.95 mL反应介质加0.05 mL GSSG的反应体系作对照,混匀后立刻记下340 nm处的起始(0 min)吸光度值,以后每隔1 min记录1次,连续测5 min。以每分钟内氧化1 μmol NADPH的酶量作为一个酶活单位(U)。
AsA含量的测定根据Tanaka等[11]的方法,并加以改进。取0.1 g叶片加入1.5 mL提取介质(5%(W/V)TCA;1 mmol·L-1EDTA)和少量石英砂在冰上研磨至匀浆,4℃,15 000 rpm离心15 min,上清液即为AsA待测液,取0.2 mL待测液+1.4 mL PBS(pH 7.8)+0.4 mL 10% TCA+0.4 mL 4% 2,2-联吡啶+0.2 mL 3% FeCl3,测定吸光度值。
GSH含量的测定采用Nagalakshmi等[12]的DTNB检测法;H2O2含量测定参照邹琦[13]的方法;O2·-产生速率测定参照王爱国等[14]的方法。
1.4 数据处理
采用Microsoft Excel 2003和SPSS 17.0软件进行数据和统计学分析,所测得的数据用平均数加减标准差表示。
2 结果与分析
2.1 NaCl胁迫对2种不同期海滨木槿幼苗SOD,APX和GR活性的影响
在盐胁迫条件下抗氧化酶活性的变化趋势可作为衡量细胞清除活性氧能力的重要指标[12]。由图1可知,150,300 mmol·L-1NaCl处理下,海滨木槿体内SOD活性均显著高于对照,随着盐浓度的增加,子叶期幼苗SOD活性呈先升高后下降的趋势,而早期幼苗SOD活性表现出不断上升的趋势,表明一定浓度的NaCl处理可诱导SOD活性的增加。图2,图3显示,2种不同时期海滨木槿幼苗的APX,GR活性与SOD活性表现出相同的变化趋势,表明在一定浓度盐胁迫下海滨木槿可以维持较高的SOD,APX和GR活性,并且不同时期的海滨木槿对盐度的敏感性不同。过高的盐浓度使子叶期幼苗3种抗氧化酶活性下降,而早期幼苗在较高盐浓度时抗氧化酶活性仍持续升高,表明此期幼苗较子叶期幼苗抗氧化能力增强。
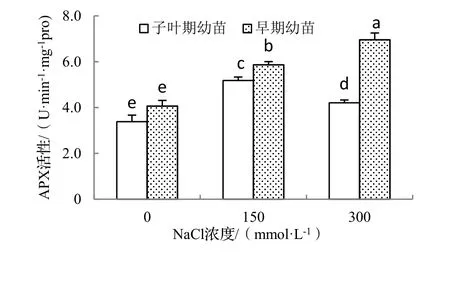
图2 不同浓度NaCl处理对2种不同期海滨木槿幼苗APX活性的影响Figure 2 Effect of NaCl treatment on APX activity of different stage of seedlings of H. hamabo
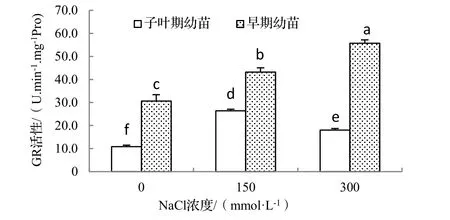
图3 不同浓度NaCl处理对2种不同期海滨木槿幼苗GR活性的影响Figure 3 Effect of NaCl treatment on GR activity of different stage of seedlings of H.hamabo
2.2 NaCl胁迫对2种不同期海滨木槿幼苗抗氧化物质含量的影响
从图4可以看出,不同浓度NaCl处理下,子叶期海滨木槿幼苗AsA含量随着NaCl浓度的升高表现出下降的趋势,在300 mmol·L-1时最低;而早期幼苗中AsA含量与盐浓度呈正相关,表明一定浓度的盐胁迫可使此期的海滨木槿AsA合成能力增强。在相同NaCl浓度梯度(150,300mmol·L-1)处理下的海滨木槿,GSH含量表现出与AsA含量相同的变化趋势(图5),表明早期幼苗GSH合成能力得到提升,比子叶期幼苗具有了更强的耐盐能力。
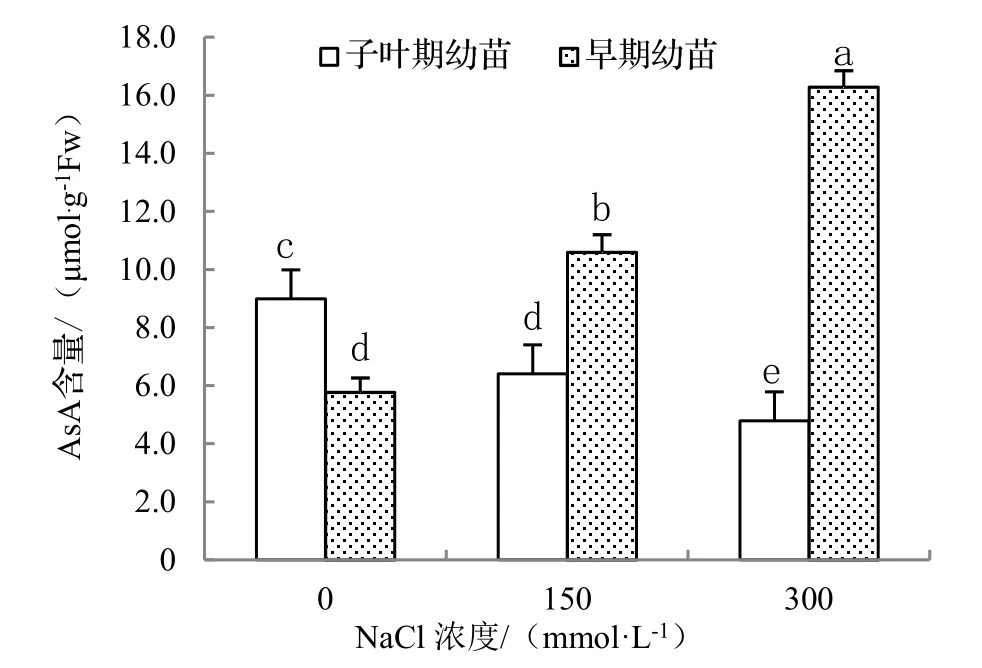
图4 不同浓度NaCl处理对2种不同期海滨木槿幼苗AsA含量的影响Figure 4 Effect of NaCl treatment on AsA content of different stage of seedlings of H. hamabo
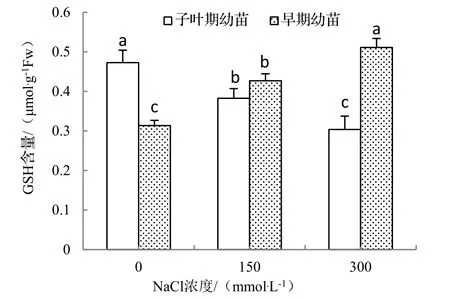
图5 不同浓度NaCl处理对2种不同期海滨木槿幼苗GSH含量的影响Figure 5 Effect of NaCl treatment on GSH content of different stage of seedlings of H. hamabo
2.3 NaCl胁迫对2种不同期海滨木槿幼苗活性氧代谢的影响
由图6,图7结果显示,在不同浓度NaCl处理下,海滨木槿子叶期幼苗和早期幼苗O2·-的产生速率和H2O2含量均随盐浓度的升高而呈不断上升趋势,且与对照差异显著,在300 mmol·L-1时达到最高。这表明随着盐浓度升高,海滨木槿受害程度加深,加速了O2·-的产生速率,体内H2O2积累量增加。

图6 不同浓度NaCl处理对2种不同期海滨木槿幼苗 O2·-产生速率的影响Figure 6 Effect of NaCl treatment on O2·- rate of different stage of seedlings of H. hamabo

图7 不同浓度NaCl处理对2种不同期海滨木槿幼苗H2O2含量的影响Figure 7 Effect of NaCl treatment on H2O2 content of different stage of seedlings of H. hamabo
3 结论与讨论
高盐逆境下植物体内活性氧的动态平衡被打破,O2·-的产生速率和H2O2的含量会随之增加[15]。SOD是植物体内重要的保护酶,可通过歧化反应高效消除体内积累的O2·-,将其转化为H2O2后通过AsA-GSH循环被清除[16-17]。刘志礼等[8]对螺旋藻进行NaCl胁迫处理,发现一定浓度NaCl处理下,螺旋藻体内SOD活性升高。也有研究发现,100 mmol·L-1NaCl处理对海滨木槿种子萌发[18]及幼苗生长[6]均有显著的抑制作用。在本实验中,用不同浓度的 NaCl胁迫处理海滨木槿幼苗,SOD活性均显著高于对照,这与何奇江等对雷竹 Phyllostachys praecox‘Prevernalis’进行盐胁迫处理得出的结论相一致[19]。子叶期海滨木槿SOD活性随盐浓度升高呈先升高后下降趋势,早期幼苗SOD的活性则与盐浓度呈正相关,可能是子叶期幼苗对盐的耐受能力较弱,只能清除较低盐浓度下产生的活性氧,当子叶中ROS积累超过其清除限度时,植物体内抗氧化酶系统遭到破坏,导致SOD活性下降。
APX,GR是AsA-GSH循环中的关键酶。APX定位于植物细胞的叶绿体和细胞质中,是一种催化AsA捕捉H2O2的抗氧化酶,APX活性的增加有助于植物抗性的提高[20]。GR是与NADPH电子传递功能有关的一种黄素蛋白,可以利用NADPH作为反应底物,将GSSG还原为GSH,是AsA-GSH循环中最后一步的关键性酶,对维持AsA和GSH的循环再生具有重要意义。本研究发现,与海滨木槿早期幼苗中APX和GR活性随盐浓度升高而持续升高的趋势不同,子叶期幼苗在不同浓度盐处理下的两种酶活性虽显著高于对照,但在 300 mmol·L-1NaCl处理下两种酶活性略有下降,可能是高盐浓度下产生的过量活性氧攻击了防御系统中的生物功能分子,使两种酶遭受损伤。这进一步表明子叶期海滨木槿只能耐受较低浓度的盐胁迫,防御能力较弱,而早期幼苗耐盐性提高。
AsA和GSH是AsA-GSH循环系统中重要的抗氧化剂,两者通常协同作用来清除植物体内过多的活性氧。AsA作为APX的反应底物将H2O2还原成H2O,清除盐胁迫产生的H2O2毒害[21],而AsA被氧化形成MDHA和DHA,MDHA和DHA在MDAR和DHAR作用下循环再生AsA[22];GSH含量的升高可以增强植物对逆境的抵抗力,也是植物对胁迫环境的一种应激反应,并且也有研究证实外源的GSH可以明显提高植物活性氧清除系统中抗氧化剂含量和抗氧化相关酶的活性[23]。
本文实验结果显示,子叶期海滨木槿在较高浓度NaCl(300 mmol·L-1)处理下AsA和GSH含量下降,这可能与子叶期幼苗器官还未发育完全有关;而早期幼苗在盐胁迫条件下可维持高水平的AsA,GSH含量以保证AsA-GSH循环的高效运转,有助于及时清除活性氧,这说明海滨木槿幼苗可能具备较高的AsA,GSH周转和再生的能力以抵抗盐胁迫造成的氧化损伤。不同浓度盐处理下,海滨木槿子叶和叶片中O2·-的产生速率和H2O2的含量均随NaCl浓度的升高而升高,表明盐胁迫会引发氧化胁迫,导致子叶和早期幼苗中活性氧积累,而且盐浓度越高,氧化损伤越严重。
综上所述,不同生长时期的海滨木槿在遭遇盐胁迫时,体内均有高效协同的抗氧化防御机制,使其对盐胁迫有一定的耐受性。其中,AsA-GSH循环在不同期海滨木槿幼苗应答盐胁迫中可能发挥了重要作用,并且从子叶期到早期幼苗,该循环系统逐步完善,有利于海滨木槿耐盐能力增强。
[1] 吕新民,杨怡帆,鲁晓燕,等. NaCl胁迫对酸枣幼苗AsA-GSH 循环的影响[J]. 植物生理学报,2016,52(5):736-744.
[2] 李晓云,王秀峰,吕乐福,等. 外源NO对铜胁迫下番茄幼苗根系抗坏血酸——谷胱甘肽循环的影响[J]. 应用生态学报,2013,24(4):1023-1030.
[3] 陈坤明,宫海军,王锁民. 植物抗坏血酸的生物合成、转运及其生物学功能[J]. 西北植物学报,2004,24(2):329-336.
[4] 徐树华. 海滨木槿的驯化试验及开发利用[J]. 浙江林业科技,1996,16(2):33-36.
[5] 李会欣,吴明,方炎明,等. NaCl胁迫对海滨木槿叶片生理特性的影响[J]. 植物资源与环境学报,2010,19(3):55-61.
[6] 孙宏丽,商宏艳,姚叶,等. NaCl与KCl处理对海滨木槿生长特性的影响[J]. 山东林业科技,2011,41(6):13-16.
[7] 薄鹏飞,孙秀玲,孙同虎,等. NaCl胁迫对海滨木槿抗氧化系统和渗透调节的影响[J]. 西北植物学报,2008,28(1):113-118.
[8] 刘志礼,李鹏云. NaCl胁迫对螺旋藻生长及抗氧化酶活性的影响[J]. 植物学通报,1998,15(3):43-47.
[9] NAKANO Y,ASADA K. Hydrogen peroxide is scavenged by ascorbate-specific peroxidase in spinach chloroplasts[J]. Plant Cell Physiol,1981,22(5):867-880 .
[10] FOSTER J G,HESS J L. Responses of superoxide dismutase and glutathione reductase activities in cotton leaf tissue exposed to an atmosphere enriched in oxygen [J]. Plant Physiol,1980,66(3):482-487.
[11] TANAKA K,SUDA Y,KONDO N,et al. O3 tolerance and the ascorbate-dependent H2O2decomposing system in chloroplasts[J]. Plant Cell Physiol,1985,26(7):1425-1431.
[12] NAGALAKSHMI N. PRASAD M N V. Responses of glutathione cycle enzymes and glutathione metabolism to copper stress in Scenedesmusbijugatus[J]. Plant Sci,2001,160(2):291-299.
[13] 邹琦. 植物生理学实验指导[M].北京:中国农业出版社,2000:159-170.
[14] 王爱国,罗广华. 植物的超氧物自由基与羟胺反应的定量关系[J]. 植物生理学通讯,1990,26(6):55-57.
[15] ZHAO H,YE L,WANG Y,et al. Melatonin increases the chilling tolerance of chloroplast in Cucumber seedlings by regulating photosynthetic electron flux and the ascorbate-glutathione cycle[J]. Front Plant Sci,2016,7.
[16] MCCORD J M,FRIDOVICH I. Superoxide dismutase an enzymic function for erythrocuprein (hemocuprein)[J]. J Biol Chem,1969,244(22):6049-6055.
[17] 靳雯棋,毕英飞,王晶,等. 野山参与园参抗坏血酸-谷胱甘肽循环代谢差异的比较[J]. 中草药,2017,48(2):373-376.
[18] 薄鹏飞,孙秀玲,宋杰,等. NaCl胁迫对海滨木槿种子萌发及Na+,K+含量的影响[J]. 安徽农业科学,2008,36(8):3098-3100.
[19] 何奇江,李楠,王波,等. 盐胁迫对雷竹生理生化特性的影响[J]. 浙江林业科技,2011,31(1):44-48.
[20] FOYER C H,NOCTOR G. Ascorbate and glutathione: the heart of the redox hub[J]. Plant Physiol,2011,155(1):2-18 .
[21] SMIRNOFF N,WHEELER G L. Ascorbic acid in plants: biosynthesis and function[J]. Critic Rev Biochem Mol Biol,2000,35(4):291-314.
[22] JIN Y H,TAO D L,HAO Z Q,et al. Environmental stresses and redox status of ascorbate[J]. Acta Bot Sin,2003,45(7):795-801.
[23] 鲁丽丽,刘耕,李君,等. 外源 GSH 对NaCl胁迫下二色补血草盐害缓冲机理的研究[J]. 山东师范大学学报:自然科学版,2006,21(2):108-111.

